基于Markov模型对泛基因型直接抗病毒药物治疗慢性丙型肝炎的药物经济学评价
2022-07-12张新建
哈 娜 张新建 海 鑫
丙型肝炎是因感染丙型肝炎病毒(hepatitis C virus, HCV)所导致的传染性肝脏疾病。有研究显示,55%~85%患者在感染HCV 6个月会转变成为慢性丙型肝炎(chronic hepatitis C, CHC)[1],部分患者将出现进行性肝纤维化,最终发展成为代偿性肝硬化、失代偿性肝硬化,甚至肝细胞癌(hepatocellular carcinoma, HCC),严重危害患者的生命健康。流行病学数据显示,中国CHC患者约有1 000万,为世界上CHC患者数量最多的国家[2]。文献[3]报道在2016年中国因丙型肝炎所导致的肝癌病死率为0.000 4%,肝硬化病死率为0.000 2%。并且丙型肝炎患者的医疗成本随着疾病进展也不断增加,给患者个人和社会造成沉重的经济负担。因此为中国丙型肝炎患者寻求有效的预防与治疗方案成为关键问题。
HCV基因易变异,目前至少可分为6个基因型及多个亚型。我国丙型肝炎患者在基因型分布上,基因1b、2、3、6型占比最多,分别为56.8%、24.1%、9.1%、6.3%,少见4型和5型的相关报道[4]。因为至今尚未研发出有效的预防性丙型肝炎疫苗,所以疾病的早期筛查和针对性治疗是应对的重要手段。丙型肝炎主要通过药物进行抗病毒治疗,主要治疗目标是实现持续病毒学应答(sustained virological response, SVR)。2019年版的《丙型肝炎防治指南》明确指明,CHC患者的抗病毒治疗已进入直接抗病毒药物(direct antiviral agents, DAAs)的泛基因型时代。指南优先推荐无干扰素的泛基因型方案,并且除失代偿期肝硬化、DAAs治疗失败的少数特殊人群外,不需要联合利巴韦林治疗。泛基因型全口服DAAs治疗方案可以减少基因分型的检测,简化治疗流程;并且在多个不同临床特点的人群中采用统一的治疗方案,药物之间的相互作用较少,能够很好满足临床治疗的需求,更加适用于基层医疗单位对CHC患者实施治疗和管理。
目前,聚乙二醇干扰素(polyethylene glycol interferon, Peg-IFN)联合利巴韦林(ribavirin, RBV),即PR治疗方案仍是我国现阶段HCV感染者接受治疗的主要方案。虽然PR方案亦适用于所有基因型患者,但该方案治疗周期长,SVR率较低,并且采用皮下注射,患者的用药依从性较差,同时可导致流感样症候群、骨髓抑制、内分泌系统紊乱等诸多不良反应[5]。自2017年以来陆续有DAAs在中国上市,其中包括索磷布韦/维帕他韦、格卡瑞韦/哌仑他韦、索磷布韦联合达拉他韦等泛基因型DAAs。以DAAs为基础的治疗方案治愈率高于90%且不良反应小,显示出良好的有效性和安全性,但药品价格相对昂贵。
本研究基于中国医疗卫生体系视角,通过构建Markov模型,模拟CHC的疾病进展过程,对已在中国上市的3种泛基因型DAAs治疗方案与传统的Peg-IFN为基础的PR方案进行对照分析,估算不同治疗方案下患者的资源消耗和健康产出,为临床医生及相关医疗机构的合理决策提供经济学依据。
1 资料与方法
1.1 模型结构与假设
根据CHC的罹患和迁延特点,参考国内外相关研究[6-7],本研究设定Markov模型共包含9种疾病/健康状态:分别为无肝硬化CHC、代偿性肝硬化、失代偿性肝硬化、HCC、无肝硬化CHC获得SVR、代偿性肝硬化获得SVR、肝移植第1年、肝移植后期(≥2年)和死亡。不同疾病状态之间的转换关系见图1。模型循环周期为1年,研究时限设定为终身(最长至100岁)。
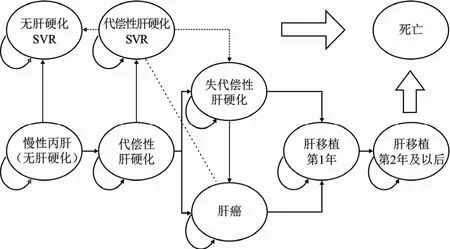
图1 CHC Markov模型结构
假设患者分别以非肝硬化CHC或代偿性肝硬化2种初始健康状态进入模型接受治疗。根据不同初始健康状态以及两组患者治疗结束后能否获得SVR,患者将分别处于获得SVR状态,或因治疗失败仍然处于慢性HCV感染状态。没有获得SVR的CHC患者,根据疾病自然进展可逐步发展成为代偿性肝硬化、失代偿性肝硬化和HCC,同时处于失代偿性肝硬化或HCC状态的患者均有可能接受肝移植。无肝硬化的患者获得SVR后疾病不再进展,而代偿性肝硬化患者获得SVR后,仍有可能进展为失代偿性肝硬化或HCC,但概率明显小于未获得SVR患者[8]。同时由于病毒清除后肝脏的再生功能,代偿性肝硬化SVR患者亦存在一定概率向非肝硬化SVR状态转移[9]。所有患者均可能发生死亡,处于无肝硬化CHC和代偿性肝硬化以及获得SVR患者不会直接因肝病死亡,可按全因死亡率计算其死亡发生率。处于失代偿性肝硬化、HCC、肝移植状态的患者还存在肝脏疾病引发的死亡风险。同时针对模型演算进行简化假设:1)第一个循环周期患者只是接受药物治疗,不发生疾病状态之间的相互转移;2)患者接受不同治疗方案的用药依从性均为100%;3)所有患者只接受一个周期的药物治疗,并且治愈后再次复发患者不再进入模型进行演算。
1.2 模型参数设置
1.2.1 模拟队列人群特征 依据肝组织病理学Metavir 评分标准[1],本研究的目标人群设定为中国初治CHC患者,包括无肝硬化CHC患者(F0~F3阶段)和代偿性肝硬化患者(F4阶段);排除处于失代偿性肝硬化或HCC阶段,以及合并感染乙型肝炎病毒或人类免疫缺陷病毒患者。患者的基线特征来自中国的一项丙型肝炎队列研究[4],其中患者平均年龄为44.5岁,男性人数占比为52%。非肝硬化患者和代偿性肝硬化患者比例分别为93.9%和6.1%。
1.2.2 治疗方案和临床疗效 本研究选择已在中国上市的3种泛基因型DAAs药物,包括复合制剂(索磷布韦/维帕他韦和格卡瑞韦/哌仑他韦)以及联合治疗方案(索磷布韦联合达拉他韦)作为试验药物。由于索磷布韦/维帕他韦/伏西瑞韦复合制剂仅被推荐用于DAAs治疗失败的患者,故本研究未纳入该方案。同时因为PR治疗方案仍为中国现阶段的主要治疗方案,故本研究选择PR治疗方案作为对照方案。 采用SVR作为疗效指标。4种治疗方案在非肝硬化CHC患者和代偿性肝硬化患者中的SVR 率主要来源于在亚洲或中国开展的Ⅲ期临床试验以及真实世界临床数据(表1)。一项来自亚洲的Ⅲ期临床试验结果显示,375例CHC患者接受12周索磷布韦/维帕他韦治疗后,非肝硬化患者和代偿性肝硬化患者SVR率分别为97.16%和98.95%[10]。两项在亚洲开展的Ⅲ期随机对照临床试验(VOYAGE-1和VOYAGE-2)[11],其中VOYAGE-1研究结果显示,546例非肝硬化CHC患者接受8周格卡瑞韦/哌仑他韦治疗后,SVR率为97.34%;VOYAGE-2研究结果显示,160例代偿性肝硬化患者接受12周格卡瑞韦/哌仑他韦治疗后,SVR率为96.82%。索磷布韦联合达拉他韦的SVR率来自两项中国丙型肝炎患者联合治疗的真实世界临床数据,56例无肝硬化CHC患者接受12周治疗后,SVR率为98.1%[12];87例代偿性肝硬化患者接受24周治疗后,SVR率为94.3%[13]。以Peg-IFN为基础的PR方案自2015年以来已在国内广泛应用,基于文献检索,无肝硬化CHC患者经过48周聚乙二醇干扰素α-2a联合RBV治疗后,获得SVR率为76.0%[14];同时基于真实世界临床数据,代偿性肝硬化患者接受48周联合治疗后,获得SVR率为68.5%[15]。

表1 不同治疗方案患者的SVR率
1.2.3 转移概率 CHC的自然疾病进程主要通过模型中不同健康状态之间的转移概率来表示。本研究Markov模型各状态间的转移概率见表2。其中非肝硬化CHC向代偿性肝硬化的转移概率来自日本针对非肝硬化患者感染HCV的随访研究[16]。代偿性肝硬化进展至失代偿性肝硬化和HCC的转移概率,失代偿性肝硬化发展成为肝癌的转移概率,以及失代偿性肝硬化和肝癌患者发生肝脏疾病相关的死亡率,分别来自针对代偿性肝硬化患者和失代偿性肝硬化患者进行的随访研究[17-18]。失代偿性肝硬化和肝癌患者进行肝移植手术的概率来自综述研究[19],肝移植和肝移植后期发生死亡的概率来自针对中国肝移植人群的统计分析数据[20]。代偿性肝硬化患者获得SVR后进展为失代偿性肝硬化和HCC的概率要低于未获得SVR的患者,相应的转移概率来自针对CHC患者进行的5年随访研究[21]。同时获得SVR的代偿性肝硬化向非肝硬化SVR的转归概率来自针对HCV 患者在接受药物治疗前后肝组织功能状态影响变化的综述研究[22]。
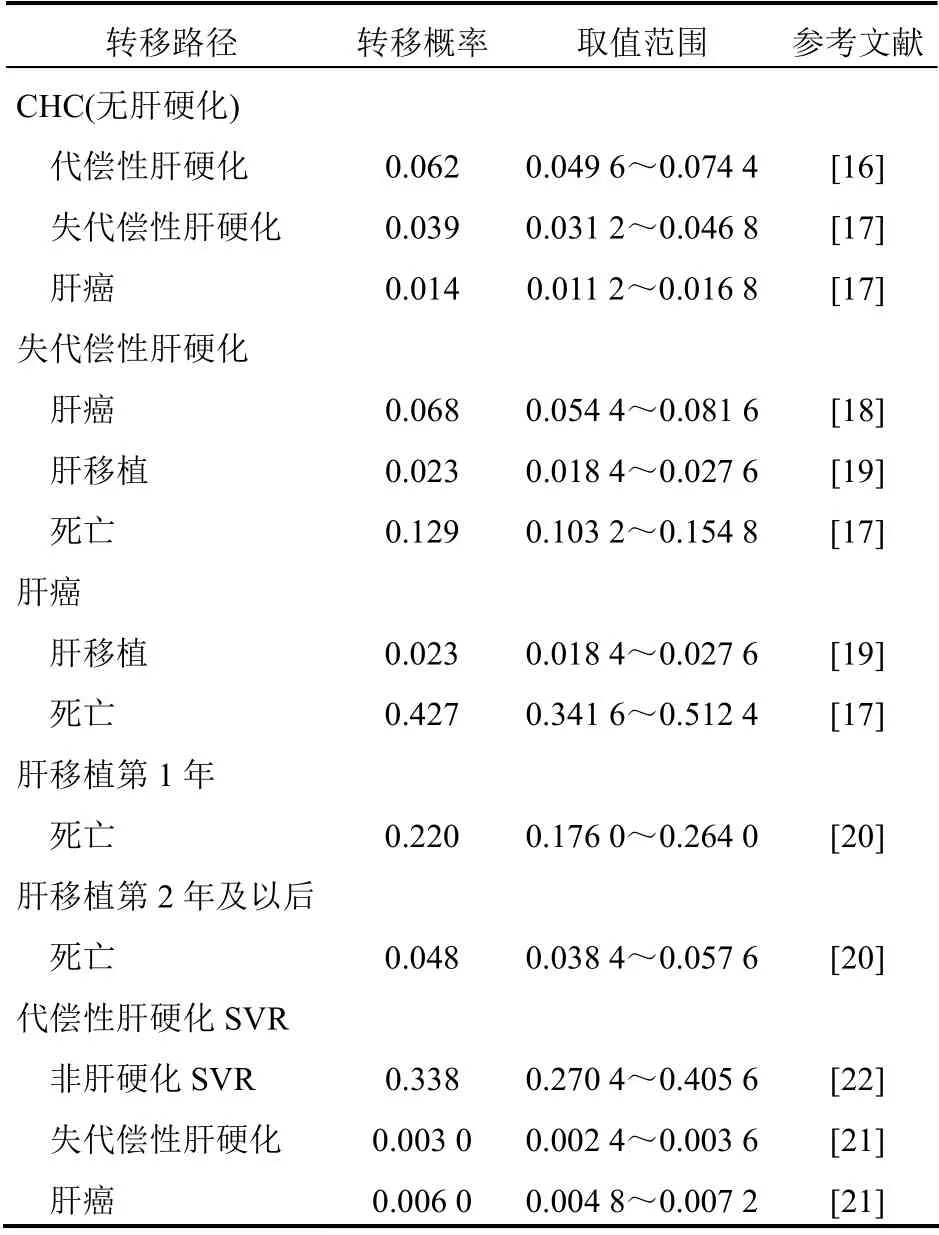
表2 Markov模型各状态之间的转移概率
对于非肝硬化CHC、非肝硬化CHC获得SVR、代偿性肝硬化、代偿性肝硬化获得SVR 4种健康状态的患者,其死亡率依据世界卫生组织(WHO)发布的中国人群全因死亡率[23]进行计算。其中非肝硬化SVR状态的死亡率与普通人群相同;代偿性肝硬化SVR状态的死亡率是普通人群的1.4倍[24];非肝硬化CHC患者和代偿性肝硬化患者的死亡率是普通人群的2.37倍[25]。此外,上述文献中查到的全因死亡率和相关事件发生率,需要通过转换公式P=1-exp(-rt)[26],将事件发生率转化成相应的转移概率。
1.2.4 健康效用值 健康效用值主要反映CHC患者在不同健康状态下的健康相关生命质量。本研究健康效用值主要包括CHC患者在不同健康状态下的效用值、治疗期间的效用值以及获得SVR后的效用值。各状态健康效用值见表3。其中不同健康状态下的效用值来自两项针对CHC患者生命质量的系统评价[27-28]。患者在获得SVR后增加的效用值来自英国针对HCV感染者的卫生评估报告[29]。由于治疗过程中不良反应的发生对患者的生命质量会产生不良影响,根据相关研究[30],分别针对包含Peg-IFN的治疗方案和不包含Peg-IFN的治疗方案2种情况,对治疗期间的效用值进行不同程度的折减。

表3 CHC患者各健康状态效用值
1.2.5 治疗成本 本研究从中国医疗卫生体系视角出发进行分析,故只计算CHC相关的直接医疗成本,包括不同治疗方案的药品费用与不同健康状态的管理成本。见表4。其中药品价格来自药智网公布的各省药品中标价的中位数(截至2019年12月)[31]。健康状态管理成本综合了治疗成本、药品成本、检查成本和住院成本等疾病支出。不同健康状态的管理成本来自我国针对丙型肝炎人群的直接医疗成本研究[32]和中国肝移植注册的相关统计数据[33]。根据文献[34]报道,代偿性肝硬化患者获得SVR后,其年均直接医疗成本是未获得SVR患者的0.709倍。上述所有成本均根据中国居民消费价格指数(CPI)调整为2019年的数值。除利巴韦林片外,本研究中的其他药品都是相应原研企业的药品。
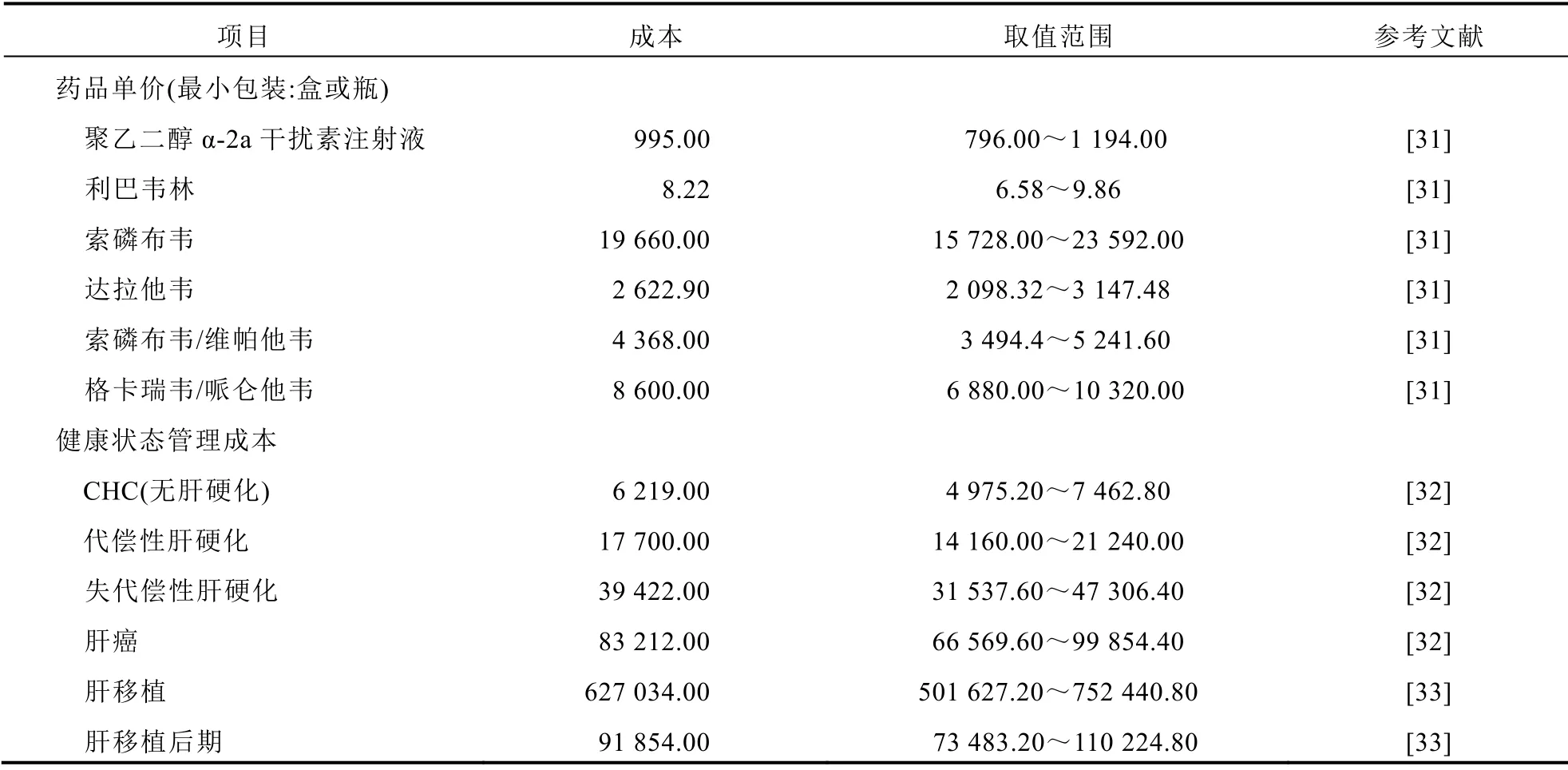
表4 直接医疗成本(元)
1.3 模型分析
将上述模型参数代入模型,运用Treeage Pro 2019软件进行计算。采用质量调整生命年(quality adjusted life year, QALY)作为健康产出衡量指标,计算不同治疗方案之间的增量成本-效用比(incremental cost-utility ratio, ICUR)。设定意愿支付阈值为70 892元/QALY(2019年我国人均国内生产总值(GDP)),并对所有成本和健康产出均按5%的年贴现率进行贴现[35]。在单因素敏感性分析中,贴现率取值范围为0%~8%,SVR率、转移概率、健康效用值以及成本数据的取值范围参照文献中相应变量的最大值和最小值。分析结果用飓风图形式呈现。概率敏感性分析 设定SVR率、转移概率及效用值服从Beta分布,成本数据服从Gamma分布,通过对模型进行1 000次的蒙特卡洛模拟,以增量成本-效用比散点图的形式显示相关分析结果。通过阈值分析计算不同DAAs方案具有同等成本-效用的阈值价格和降价幅度。
2 结果
2.1 基础分析结果
4种治疗方案的成本-效用分析结果见表5。基于Markov模型的回乘分析结果显示,对非肝硬化CHC患者,3种泛基因型DAAs方案索磷布韦/维帕他韦、格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦的终身健康结果分别比传统PR方案增加0.238 4、0.239 6和0.244 7 QALYs,终身治疗成本分别比传统PR方案减少36 096.62元、6 990.01元和4 572.45元。在增加QALYs的同时均不同程度降低终身治疗成本,故3种泛基因型DAAs方案与传统PR方案比较均为绝对优势方案。同时在所有DAAs方案中,与索磷布韦/维帕他韦方案比较,格卡瑞韦/哌仑他韦方案的终身健康结果虽然增加了0.001 2 QALYs,但终身治疗成本比索磷布韦/维帕他韦方案增加29 106.61元;索磷布韦联合达拉他韦方案的终身健康结果虽然比索磷布韦/维帕他韦方案增加了0.006 3 QALYs,但终身治疗成本却增加31 524.17元。因此,在所有治疗方案中,索磷布韦/维帕他韦方案最具成本-效用优势。
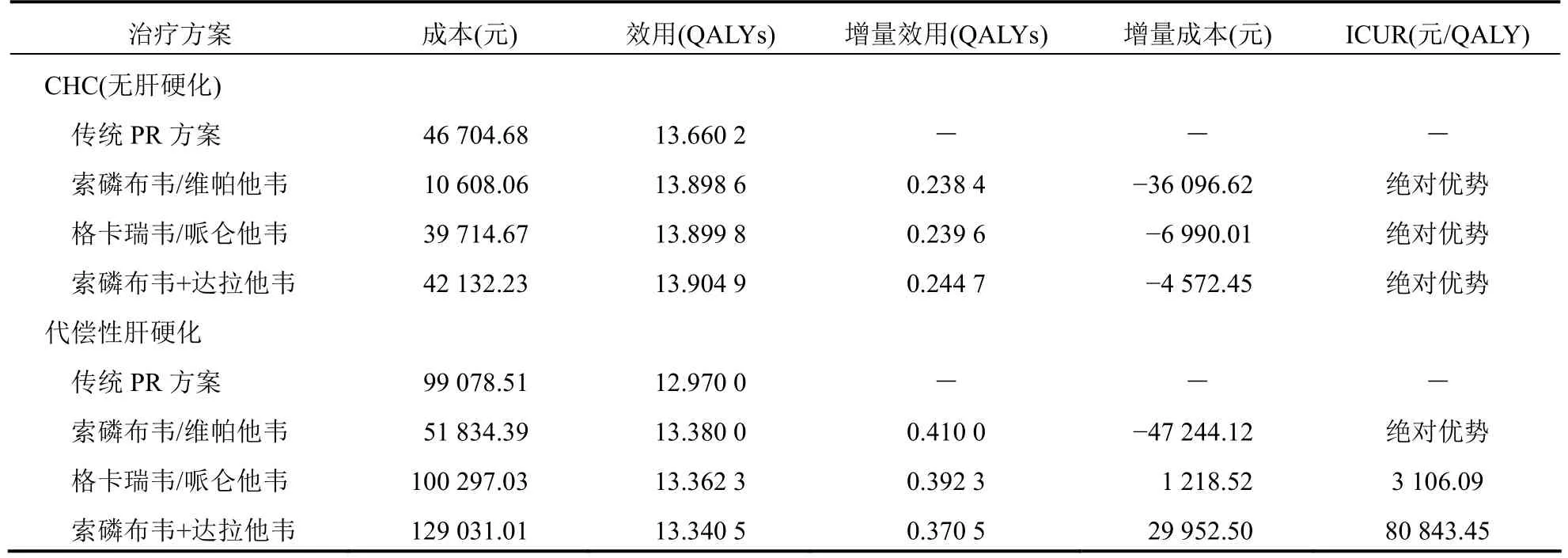
表5 4种治疗方案的成本-效用分析结果
对于代偿性肝硬化患者,3种泛基因型DAAs方案索磷布韦/维帕他韦、格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦的终身健康结果分别比传统PR方案增加0.410 0、0.392 3和0.370 5 QALYs;索磷布韦/维帕他韦方案的终身治疗成本比传统PR方案减少47 244.12元,格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦方案的终身治疗成本分别比传统PR方案增加1 218.52元和29 952.50元。在所有治疗方案中,索磷布韦/维帕他韦方案的QALYs最高而终身治疗成本最低,是具有绝对成本-效用优势的治疗方案。同时根据增量成本-效用分析结果,格卡瑞韦/哌仑他韦方案与传统PR方案比较的ICUR为3 106.09元/QALY,索磷布韦联合达拉他韦方案与传统PR方案比较的ICUR为80 843.45元/QALY。本研究设置的阈值标准为70 892 元/QALY(2019年我国人均GDP),故格卡瑞韦/哌仑他韦方案增加的成本完全可以接受,依然具有显著的经济学优势。根据《中国药物经济学评价指南及导读(2015版)》的推荐,ICUR值在1~3倍人均GDP之间时,增加的成本是可以接受的,表示仍然具有经济性。当意愿支付阈值从2019年我国人均GDP的1倍(70 892元/QALY)增加到3倍(212 676元/QALY)时,索磷布韦联合达拉他韦方案增加的成本是可以接受的,与传统PR方案比较亦具有一定的经济学优势。
2.2 单因素敏感性分析结果
由于索磷布韦/维帕他韦方案在非肝硬化和代偿性肝硬化患者中,与传统PR方案相比均为绝对优势方案,故单因素敏感性分析选取格卡瑞韦/哌仑他韦方案和索磷布韦联合达拉他韦方案分别与传统PR方案进行比较。图2~4分别是非肝硬化CHC患者和代偿性肝硬化患者的单因素敏感性分析飓风图,图中展示了对ICUR变化范围影响最大的前10位参数。在非肝硬化CHC和代偿性肝硬化两组患者中排在第一位的影响因素分别是传统PR方案治疗CHC患者的SVR率和格卡瑞韦/哌仑他韦方案初始治疗成本。所有参数在设定范围内变化时,均不影响模型结果的稳定性,与基础分析结果一致。
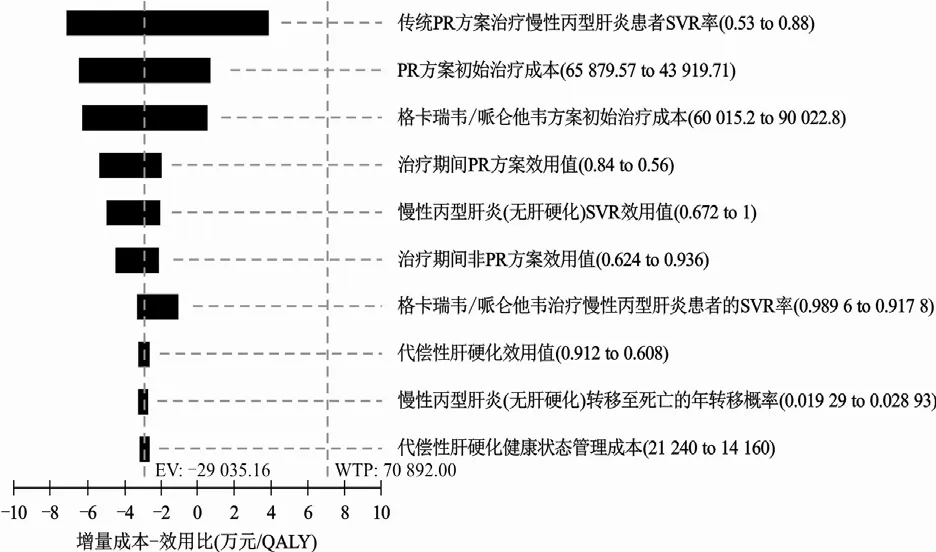
图2 非肝硬化组:格卡瑞韦/哌仑他韦vs.传统PR 方案飓风图

图3 非肝硬化组:索磷布韦联合达拉他韦vs.传统PR 方案飓风图
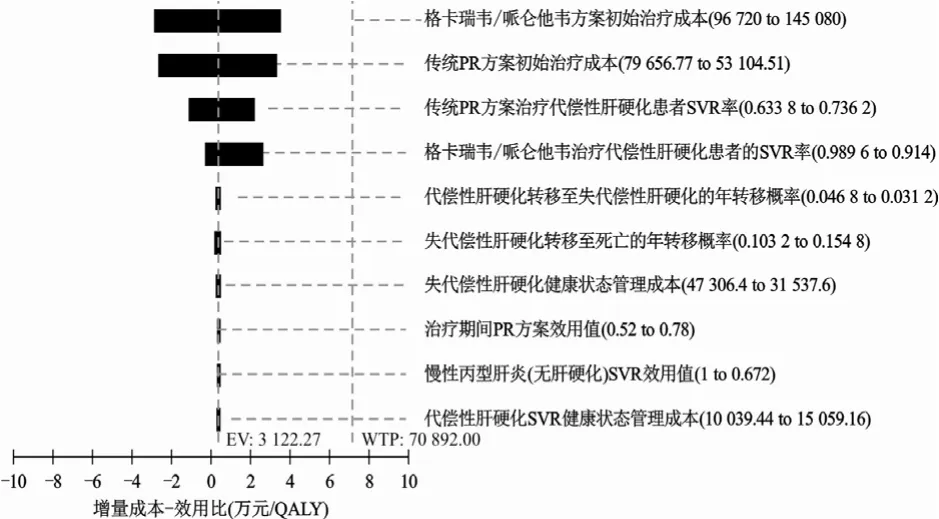
图4 代偿性肝硬化组:格卡瑞韦/哌仑他韦vs.传统PR 方案飓风图
2.3 概率敏感性分析结果
由于针对非肝硬化CHC患者,3种泛基因型DAAs治疗方案与传统PR方案比较均为绝对优势方案,故本研究选取在代偿性肝硬化患者中,3种泛基因型DAAs治疗方案分别与传统PR方案相比较,通过二阶蒙特卡洛模拟进行概率敏感性分析。以增量效用作为横坐标,增量成本作为纵坐标,在成本-效用的平面图上以散点的形式展示ICUR的分布情况,其中斜线代表意愿支付阈值(70 892元/QALY),从而得到ICUR散点图。索磷布韦/维帕他韦与传统PR方案比较的ICUR散点图(图5)显示,ICUR散点全部分布在绝对优势象限(100.0%),当阈值为70 892元/QALY时,索磷布韦/维帕他韦具有成本-效用优势的概率为100.0%。格卡瑞韦/哌仑他韦与传统PR方案比较的ICUR散点图(图6)显示,ICUR散点分别分布在绝对优势象限(45.9%)和效用优势象限(54.1%),当阈值为70 892元/QALY时,格卡瑞韦/哌仑他韦具有成本-效用优势的概率为99.8%。索磷布韦联合达拉他韦方案与传统PR方案比较的ICUR散点图(图7)显示,ICUR散点全部分布在效用优势象限,在ICUR<70 897元/QALY区间概率为43.1%,在ICUR>70 897元/QALY区间概率为56.9%,因此当阈值为70 892元/QALY时,格卡瑞韦/哌仑他韦具有成本-效用优势的概率为43.1%。结果表明,与传统PR方案比较,索磷布韦/维帕他韦具有绝对成本-效用优势;当阈值为70 892元/QALY时,格卡瑞韦/哌仑他韦亦具有显著的成本-效用优势。

图5 代偿性肝硬化组:索磷布韦/维帕他韦vs.传统PR 方案增量成本-效用散点图
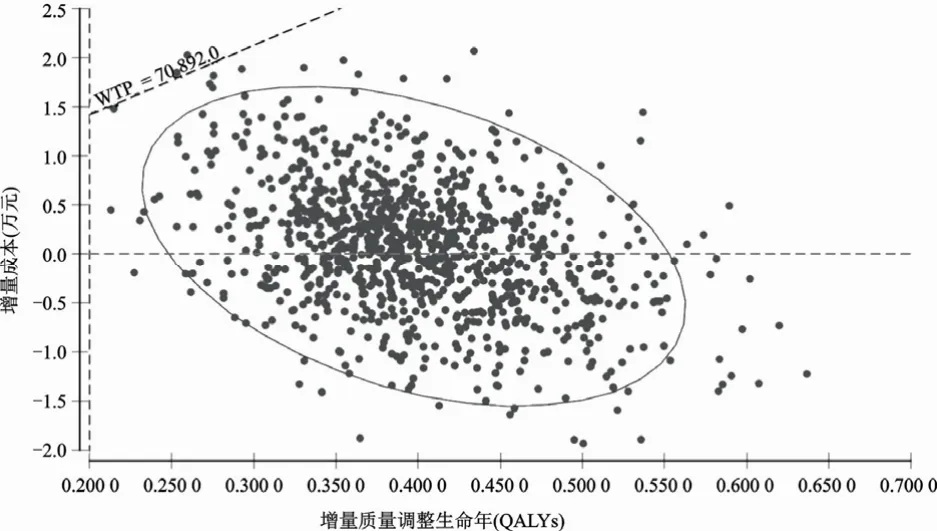
图6 代偿性肝硬化组:格卡瑞韦/哌仑他韦vs.传统PR 方案增量成本-效用散点图

图7 代偿性肝硬化组:索磷布韦联合达卡他韦vs.传统PR方案增量成本-效用散点图
2.4 阈值分析
基础分析中,对于非肝硬化CHC患者,与索磷布韦/维帕他韦方案比较,格卡瑞韦/哌仑他韦方案和索磷布韦联合达拉他韦方案终身健康结果虽然分别增加了0.001 2和0.006 3 QALYs,但终身治疗成本 比索磷布韦/维帕他韦方案分别增加29 106.61元和31 524.17元,ICUR分别为24 255 508元/QALY和5 003 836元/QALY,明显高于本研究的意愿支付阈值(70 892元/QALY),并且亦大于3倍人均GDP(212 676元/QALY,意愿支付阈值的上限值)。因此与索磷布韦/维帕他韦方案比较,格卡瑞韦/哌仑他韦方案和索磷布韦联合达拉他韦方案在目前价格下均不具有成本-效用优势。保持其他参数不变,分别降低格卡瑞韦/哌仑他韦、索磷布韦和达拉他韦的药品价格。当格卡瑞韦/哌仑他韦单价下降至1 672.80元(药品价格下调幅度80.5%),其与索磷布韦/维帕他韦相比较的ICUR为70 316.67元/QALY,此时该方案具有同等的成本-效用优势。同时当索磷布韦单价下降至3 932.00元(药品价格下调幅度80.0%),达拉他韦单价下降至464.00元(药品价格下调幅度82.3%),索磷布韦联合达拉他韦方案与索磷布韦/维帕他韦相比较的ICUR为70 517.46元/QALY,此时该方案亦具有同等的成本-效用优势。
3 讨论
CHC是导致终末期肝病的重要原因,不但严重损害患者的身体健康和生命质量,还给患者个人和社会带来沉重的疾病负担。WHO提出到2030年将消除病毒性肝炎威胁作为公共卫生的目标。如若成功消除病毒性肝炎,需要90%感染者得到诊断以及80%确诊患者得到有效治疗。泛基因型DAAs治疗方案的应用是实现这一目标的主要推荐方案[36]。本研究通过构建Markov模型,对比分析了新型泛基因型DAAs方案与传统PR治疗方案,对于中国初治CHC患者的长期药物经济学优势。
研究结果表明,对于中国初治非肝硬化CHC患者而言,与传统PR方案比较,3种泛基因型DAAs方案均增加了QALYs(增加0.238 4~0.244 7 QALYs),而显著降低了终身医疗成本(降低4 572.45~36 096.62元),因此3种泛基因型DAAs方案均为绝对优势方案。同时在所有DAAs方案中,索磷布韦/维帕他韦相对于格卡瑞韦/哌仑他韦、索磷布韦联合达拉他韦2种方案,在较小的QALYs差距下(13.898 6 vs 13.899 8 QALYs;13.898 6vs13.904 9 QALYs),却具有最少的终身医疗成本(10 608.06元 vs 39 714.67元;10 608.06元 vs 42 132.23元)。因此,对于初治非肝硬化CHC患者而言,索磷布韦/维帕他韦方案最具成本-效用优势。对于代偿性肝硬化患者,索磷布韦/维帕他韦方案的QALYs 最高而终身治疗成本最低,依然是绝对优势方案。格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦方案与传统PR方案比较,ICUR分别为3 106.09元/QALY和80 843.45元/QALY;前者小于本研究设定的意愿支付阈值70 892 元/QALY(2019年我国人均GDP),后者明显小于2019年我国人均GDP的3倍(212 676元/QALY,意愿支付阈值的上限值),因此与传统PR方案比较,格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦方案亦具有显著的药物经济学优势。敏感性分析显示,治疗方案的初始治疗成本(主要决定因素为药品价格)和治疗方案的SVR率对结果的影响最大。同时研究结果表明,由于代偿性肝硬化疾病程度较重,在每种治疗方案下获得的QALYs 均低于非肝硬化CHC患者。并且代偿性肝硬化患者在各治疗方案下的终身医疗成本(51 834.39~129 031.01元)显著高于非肝硬化患者的相应医疗成本(10 608.06~46 704.68元)。因此当患者疾病进展为代偿性肝硬化时再接受治疗,其疾病负担明显高于在非肝硬化阶段接受治疗,增加的疾病负担主要体现在治疗后期的健康管理成本上。因此对患者及早采取治疗措施可明显降低患者和社会的经济负担。
目前,我国临床已有多种泛基因型DAAs治疗方案,但仅有索磷布韦/维帕他韦进入2019年版国家医保药品目录,丙型肝炎患者尤其是非基因1b型患者的用药选择仍然存在较大的局限性。本研究以基础分析中最具经济学优势的索磷布韦/维帕他韦作为对照方案,通过成本-效用分析和阈值分析,测算若格卡瑞韦/哌仑他韦和索磷布韦联合达拉他韦方案达到同等经济性,格卡瑞韦/哌仑他韦、索磷布韦和达拉他韦需分别降价80.5%、80.0%和82.3%。药品价格谈判机制的建立是我国政府为深化医保支付制度改革,建设全民医保体系的重要举措。我国HCV的感染率较高,目前医保已较大程度保障了PR治疗方案的可负担性,然而新型DAAs药物与传统PR方案比较,具有显著的长期成本-效用优势。中国医保部门作为药品市场的主要支付方具备较强的议价能力,应在支付能力范围内,将更多远期控费效果好的创新药纳入谈判清单,采用包括竞争性谈判等多种方式将药品价格降至合理区间,提高诸如丙型肝炎新型治疗药物DAAs等创新药的可及性和可负担性。丙型肝炎作为可以治愈的传染性疾病,其治愈不仅对患者的健康有益,还能减少对他人的传播,可带来很大的社会效益。
本研究还存在以下几点局限性:1)由于缺乏相关的流行病学数据,本研究未将合并感染乙型肝炎病毒或人类免疫缺陷病毒等特殊人群纳入本项研究进行分析。2)本研究未考虑当患者在治疗期间退出中断治疗,以及治愈后复发或再感染HCV等诸多临床事件,这可能与真实世界中患者的实际情况存在一定差异。
综上所述,对于非肝硬化和代偿性肝硬化CHC患者,所有泛基因型DAAs治疗方案与传统PR方案比较,均具有显著的药物经济学优势,其中索磷布韦/维帕他韦最具成本-效用优势。建议通过药品价格谈判机制等多项举措,提高更多丙型肝炎创新药DAAs的可及性和可负担性。
