丁苯酞对脓毒症大鼠肠系膜动脉内皮的保护作用
2022-07-12陈雪梅孙贝贝陈雪祎王海华
陈雪梅,李 慧,方 莹,孙贝贝,王 静,陈雪祎,王海华
(皖南医学院 1.生理学教研室;2.药学院,安徽 芜湖 241002)
脓毒症是由感染引发严重多器官功能障碍的危重病症,病死率高居不下[1]。脓毒症引起的抗感染和器官衰竭治疗已有很大的进步,但高昂的治疗费用和不佳的预后给患者家庭和社会带来严峻的挑战。在脓毒症期间,血管功能障碍是其重要的病理生理变化,可引起组织缺血缺氧、器官功能障碍甚至导致机体功能严重衰竭[2]。微血管是机体的主要阻力血管,脓毒症首先引发其结构功能的损伤,直接或间接地影响疾病的转归[3-4],深入研究脓毒症微血管功能变化及其机制,可寻找保护性措施。
丁苯酞(N-butylphthalide,NBP)主要用于改善急性缺血性脑卒中造成的精神功能损伤[5],有研究证实,其还具有控制炎症反应、减轻线粒体受损、调节微循环等作用[6]。本研究通过建立脓毒症大鼠模型,观察不同浓度的NBP对脓毒症大鼠肠系膜动脉内皮功能的作用及其机制,为脓毒症及其并发症的防范和治疗提供新的实验依据。
1 材料与方法
1.1 实验动物 40只体质量(240±10)g雄性SPF级大鼠,许可证号SCXK(鲁)20190003。
1.2 试剂与器材 NBP注射液(恩必普药业公司);肾上腺素(PE,远大医药公司);乙酰胆碱(ACh,上海麦克林公司);硝普纳(SNP,广东宏远公司);一氧化氮合酶(NOS)抑制剂(L-NAME,sigma公司);可溶性鸟苷酸环化酶(SGC)抑制剂(NS-2028,sigma公司);微血管张力测定仪(danish myo technology A/S公司)。
1.3 分组及血流动力学指标 40只大鼠随机分为假手术(SHAM)组、脓毒症(CLP)组、丁苯酞低剂量干预(CLP+NBP-L)组(NBP 4 mg/kg)、丁苯酞高剂量干预(CLP+NBP-H)组(NBP 6 mg/kg),各10只。SHAM组仅开关腹处理,CLP组用盲肠结扎穿孔术(CLP)建立模型,CLP+NBP-L组和CLP+NBP-H组于术后6、12、24 h腹腔注射药物,24 h后麻醉大鼠,行右颈总动脉插管,测左心室舒张末压(LVEDP)和左心室内压最大上升/下降速率(±dp/dtmax)[7-9]。
1.4 大鼠血清中IL-6和TNF-α水平检测 采血静置30 min后3 000 r/min离心10 min,取上清液,保存于-80℃冰箱。根据ELISA试剂盒说明书操作。
1.5 肠系膜动脉血管结构的观察 将肠系膜动脉固定、脱水、包埋、切片、HE染色,对比镜下各组血管组织结构的区别,用Image J软件分析管壁厚度/管腔半径(WT/LR)的变化[10]。
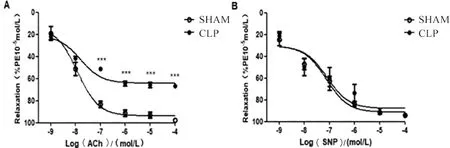
1.6 肠系膜动脉舒张功能检测 将血管环标准化后[11],用60 mmol/L的高钾溶液分两次预收缩血管,两次收缩的张力均>3 mN且收缩幅度差别<10%时,说明血管功能正常[12]。加入1×10-5mol/L的PE,待血管张力平稳后添加1×10-4mol/L的ACh,血管舒张>60%,说明血管内皮完整,可用于后续实验[13-14]。加入浓度为1×10-5mol/L的PE,当收缩达到平台期时依次加入终浓度为1×10-9~1×10-4mol/L的ACh/SNP(图1),观察各组的肠系膜动脉中,不同浓度的ACh/SNP的舒张强度(△ACh/SNP=PE的收缩平台值-ACh/SNP舒张反应峰值)和舒张效应(舒张强度/PE收缩强度的百分比),并作出剂量-效应曲线。浴槽中分别孵育L-NAME、NS-2028 30 min(1×10-4mol/L)后再进行上述操作。
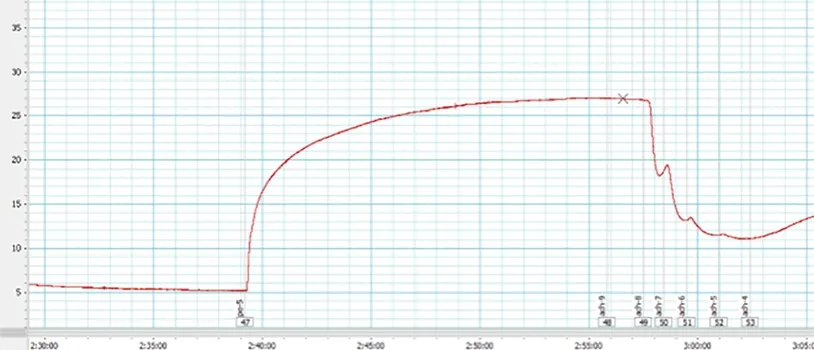
图1 肠系膜动脉环舒张效应检测
1.7 肠系膜中eNOS活性及NO含量的检测 肠系膜组织匀浆后2 500 r/min离心10min,吸取上清液,分别运用酶联免疫吸附法、硝酸还原法测定肠系膜动脉组织中eNOS活性和NO含量。

2 结果
2.1 大鼠肠腔及心功能变化 SHAM组大鼠精神状况佳,肠腔无病理改变,心功能正常。CLP组大鼠精神萎靡、肠腔粘连坏死,有恶臭味和血性液体,LVEDP和±dp/dtmax等心功能参数下降(P<0.05),表明CLP大鼠建模成功(图2,表1)。CLP+NBP-L组和CLP+NBP-H组较CLP组的LVEDP、±dp/dtmax参数恢复(P<0.05)(表1)。表明NBP对脓毒症大鼠的腹腔炎症状况有所改善。

A.SHAM组;B.CLP组;C.CLP+NBP-L组;D.CLP+NBP-H组。
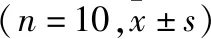
表1 大鼠心功能变化
2.2 大鼠血清炎性因子变化 CLP组大鼠血清中IL-6和TNF-α水平较SHAM组增高(P<0.05),CLP+NBP-L组和CLP+NBP-H组较CLP组减少(P<0.05)(表2)。表明脓毒症能引发机体产生炎症反应,而NBP可减轻脓毒症引起的这种反应。
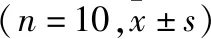
表2 大鼠血清炎性因子变化
2.3 大鼠肠系膜动脉结构变化 HE染色结果显示,CLP组血管壁较SHAM组增厚,CLP+NBP-L组和CLP+NBP-H组较CLP组变薄(图3);与CLP组相比,其他3组血管壁壁厚及WT/LR均降低(P<0.05)(表3)。表明脓毒症导致大鼠肠系膜动脉的舒缩功能障碍,而NBP对脓毒症大鼠肠系膜动脉的舒缩功能障碍有改善作用。

A.SHAM组;B.CLP组;C.CLP+NBP-L组;D.CLP+NBP-H组。
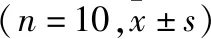
表3 肠系膜血管壁厚与WT/LR值的比较
2.4 肠系膜动脉舒张功能变化
2.4.1 ACh/SNP介导的SHAM组与CLP组肠系膜动脉的舒张反应 与SHAM组相比,CLP组ACh介导的肠系膜动脉在加入浓度为1×10-7mol/L的ACh后,舒张功能减弱(P<0.001),SNP介导的舒张功能差异无统计学意义(P>0.05),表明脓毒症可能损伤了大鼠肠系膜动脉的内皮舒张功能(图4)。
2.4.2 ACh介导的CLP组和SHAM组与CLP+NBP-L组、CLP+NBP-H组的肠系膜动脉的舒张反应 与CLP组相比,CLP+NBP-L组、CLP+NBP-H组ACh介导的肠系膜动脉在加入浓度为1×10-9mol/L的ACh时,舒张功能增强(P<0.001),但舒张功能趋向于SHAM组(P>0.05),表明NBP可以改善脓毒症大鼠肠系膜动脉内皮舒张功能的减弱(图5)。
***P<0.001。
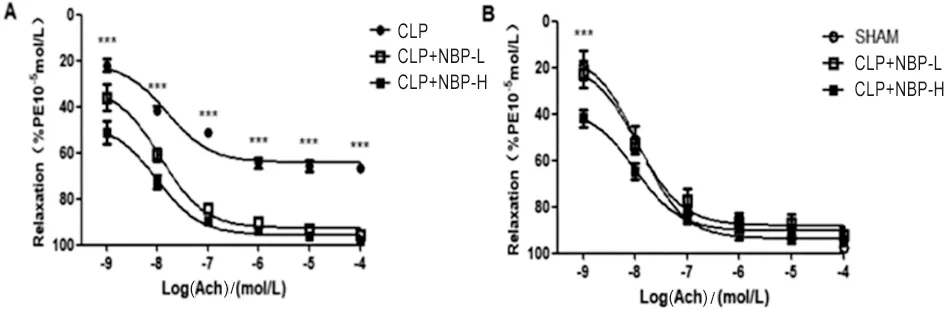
***P<0.001。
2.4.3 抑制剂干预组大鼠肠系膜动脉对ACh的反应 加入NOS抑制剂L-NAME和sGC抑制剂NS-2028后,SHAM组和CLP+NBP-L组、CLP+NBP-H组ACh介导的肠系膜动脉的舒张作用大部分被抑制(P<0.001),而CLP组无明显改变(P>0.05)。表明NBP对脓毒症大鼠内皮舒张功能的改善可能与NO-sGC-cGMP信号通路作用有关(图6)。
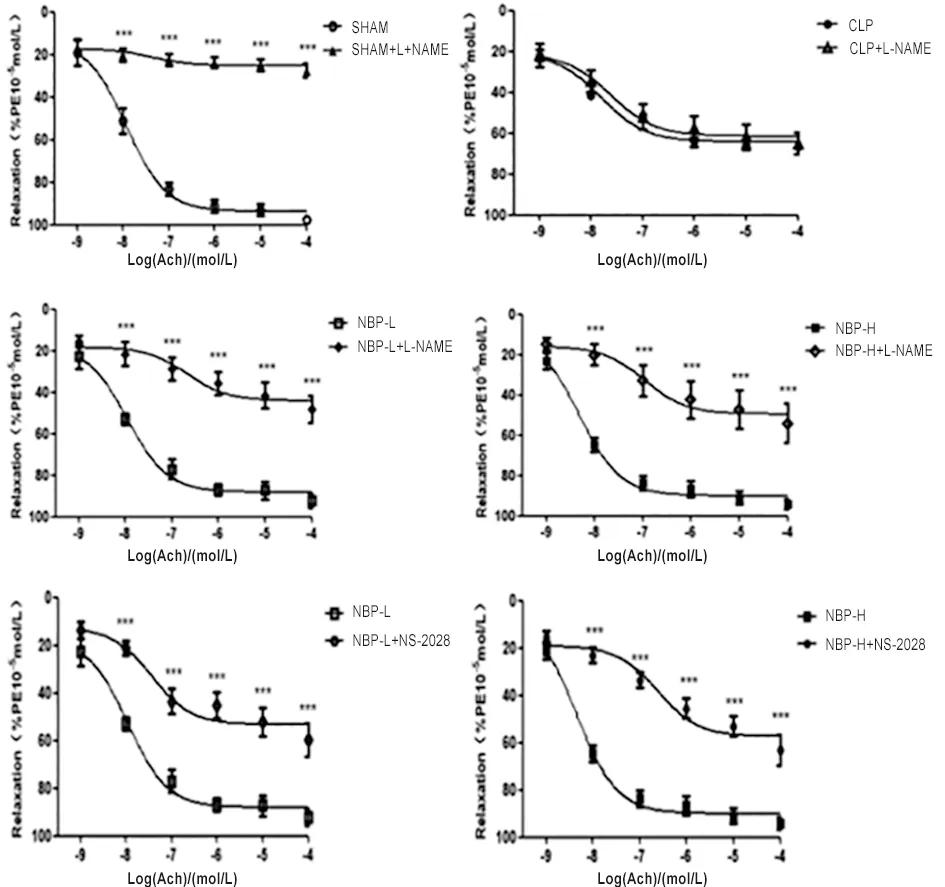
***P<0.001。
2.5 肠系膜中eNOS、NO水平变化 CLP组大鼠肠系膜中eNOS活性和NO含量较SHAM组降低(P<0.05),CLP+NBP-L组和CLP+NBP-H组较CLP组增高(P<0.05)。表明NBP对脓毒症大鼠内皮舒张功能的改善与NO-sGC-cGMP信号通路有关(表4)。
表4 肠系膜中eNOS、NO水平比较
3 讨论
血管内皮细胞具有调控血管舒缩的功能。微循环对机体的内环境稳态和新陈代谢至关重要。患脓毒症时,血管内皮细胞被病原体直接感染,脂多糖作为细菌细胞壁的主要成分可激活血管内皮细胞表面的识别受体,使细胞释放出大量的炎症介质。肠系膜动脉作为机体的阻力血管,其内皮结构和功能常常受损,从而引起机体微循环功能障碍[15],常为临床上重症患者病情恶化的触发因素[2],直接或间接地影响病程的结局。
NO是在血管内皮细胞中由NOS催化L-arginine转化而来,再经脂溶性扩散入平滑肌细胞,激活sGC,升高cGMP水平,减少胞内游离的Ca2+浓度,引起血管舒张。微血管张力实验中,用60 mmol/L的高钾溶液预收缩血管,其机制是改变血管平滑肌细胞膜外钾离子使其超极化,通过电压门控钙通道开放外钙内流触发钙库释放钙离子而实现的;PE的缩血管机制是使血管平滑肌细胞内的Ca2+水平升高。
NBP主要成分来自于芹菜籽[16],研究显示其能够提高血管内皮细胞的NO水平,减轻和修复神经元的损伤[17]。本研究结果证实NBP对脓毒症大鼠内皮舒张功能的改善是通过增强eNOS活性使NO的水平升高。临床上联合尤瑞克林治疗发现,NBP能够抑制ET-1的生成,提高NO的分泌,从而缓解血管内皮功能的损伤[18]。大鼠一般状况及形态学检测表明NBP对脓毒症大鼠有明显的改善,生化检测显示NBP能减轻脓毒症大鼠血清中IL-6和TNF-α水平,微血管功能实验证实NBP对脓毒症大鼠血管损伤有保护作用,呈内皮依赖性,分别用L-NAME和NS-2028孵育后,明显逆转NBP对脓毒症大鼠血管损伤的改善作用。
总之,NBP对脓毒症大鼠心血管和内皮功能损伤具有保护作用,其机制可能是通过调节NO-sGC-CGMP信号通路实现的。
