花生蛋白的浓度对其超声改性效果的影响
2022-07-12张淑艳章绍兵张语青
张淑艳,章绍兵,陈 林,张语青
河南工业大学 粮油食品学院,河南 郑州 450001
花生在我国种植面积广阔[1],主要分布于黄淮流域、东南沿海与长江流域。近年花生的需求量不断增加,同时产量也在不断攀升。花生蛋白是一种优质蛋白,富含氨基酸,具有较高的营养价值[2]。研究表明,由于分子结构差异,花生蛋白的溶解性、乳化性和凝胶性等重要功能特性均无法和大豆蛋白相媲美,导致其在食品工业中的应用受到了很大限制[3]。
近年来研究人员通过物理[4-6]、化学[7-8]以及酶[9-11]等多种方法对花生蛋白进行改性并取得了一定进展。其中高场强超声处理作为一种新型非热技术,具有快速、高效等特点。超声波技术的主要原理是通过空化泡、加热、动态搅动、剪切力和湍流等物理效应作用于改性对象[12]。Zhang等[6]将花生蛋白(8 g/L)超声处理后,发现亚基条带并未改变,内源荧光光谱与表面疏水性有所变化;黄六容等[13]超声处理花生蛋白(0.01 g/mL)后,荧光光谱显示蛋白分子有所展开,二级结构中β-折叠含量减少;张文等[14]研究发现超声处理花生蛋白(6 g/L)后,花生蛋白在66.2 kDa 附近条带增加,且在14.4 kDa处生成新条带,α-螺旋含量降低。虽然目前针对花生蛋白已开展了较多的超声改性研究,但研究结论尚存在一定差异。对蛋白进行超声处理时,样品浓度可能是影响改性效果的重要因素,如同样是针对乳清蛋白进行研究,Jambrak等[15]发现蛋白质亚基超声后发生明显降解,而O′Sullivan等[16]却报道亚基无变化,比较研究方法可知,他们在超声处理乳清蛋白时样品浓度相差了100倍。
目前在蛋白质超声改性研究中,通过改变超声时间、功率和环境条件(热、离子强度和pH值等)研究蛋白质结构的报道较多,但蛋白质浓度对超声改性效果的影响仍然未知。蛋白质的结构决定其功能,只有掌握蛋白质经超声处理后结构的变化,才能使其在食品加工中得到合理应用。作者以花生蛋白为研究对象,在固定超声处理强度的基础上,改变超声体系中蛋白与水的质量体积比(以下简称蛋白浓度),研究花生蛋白的浓度对其分子结构的影响。
1 材料与方法
1.1 材料与试剂
花生:市售。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒:合肥新恩源生物技术有限公司;8-苯胺-1-萘磺酸(ANS): 上海源叶生物科技有限公司 ;十二烷基硫酸钠(SDS):天津市天力化学试剂有限公司;5,5′-二硫代-双-2-硝基苯甲酸(DTNB):上海索莱宝生物科技有限公司;盐酸胍:上海麦克林生化科技有限公司;溴化钾、三氯乙酸、尿素、三羟甲基氨基甲烷、甘氨酸、乙腈(色谱纯):天津市科密欧化学试剂有限公司。
1.2 主要仪器与设备
SCIENTZ-IID超声波细胞粉碎机:宁波新芝生物科技有限公司;G9800A 荧光分光光度计、Agilent 1260高效液相色谱: 美国安捷伦有限公司;BT-9300S激光粒度分布仪:丹东百特仪器有限公司;Tensor II傅里叶红外光谱仪:德国Bruker公司;TSKgel GMPWXL色谱柱:日本Tokyo公司;Zeta sizer Nano ZS90纳米粒度电位仪:英国马尔文。
1.3 花生蛋白的提取
将适量花生放入粉碎机,打成花生浆,放置48 h后备用。按照m(花生浆)∶V(蒸馏水)=1∶ 6(g/mL)混合搅匀,用2 mol/L的氢氧化钠调节浆液pH值为10,再将浆液于50 ℃恒温水浴锅中150 r/min振荡30 min,4 000 r/min离心15 min去除上层油、乳以及沉淀得水相。调节pH值为4.5,使蛋白酸沉析出,水洗2次后4 000 r/min离心10 min得到花生蛋白(PPI),冷冻干燥后备用。
1.4 花生蛋白的超声处理
取适量冷冻干燥后的花生蛋白,加入蒸馏水分别配制成0.005、0.010、0.050、0.100、0.150 g/mL花生蛋白溶液,为使花生蛋白充分溶解,用氢氧化钠溶液调节pH值为8.0。将探头插入花生蛋白液面下2 cm处,冰水浴控温,超声功率400 W,时间5 min(工作2 s,间歇3 s)。花生蛋白样液超声处理后冷冻干燥,备用。对照组的花生蛋白浓度为0.010 g/mL,未经超声处理。
1.5 花生蛋白结构性质的测定
1.5.1 SDS-PAGE
采用文献[17]的方法并稍加改动。配制样品为3 mg/mL,样液与蛋白上样缓冲溶液各10 μL等体积混合,沸水浴5 min,浓缩胶中电压80 mV,分离胶中电压120 mV。待电泳完成后考马斯亮蓝染色2 h,脱色液脱色后观察亚基条带情况。
1.5.2 表面疏水性的测定
采用文献[18]的方法并稍加改动,用荧光探针法测定样品表面疏水性。将蛋白样品溶解于pH 8的0.01 mol/L磷酸盐缓冲液,配制样液浓度为0.05、0.06、0.07、0.08、0.09、0.10 mg/mL。取4 mL不同浓度蛋白样液分别加入20 μL ANS(8 mmol/L)充分混匀。激发波长380 nm,发射波长480 nm下测定样液荧光吸收强度。以荧光强度对蛋白浓度作图,斜率表示该样品的表面疏水性。
1.5.3 内源荧光光谱的测定
采用文献[19]的方法并稍加改动,测定蛋白样品内源光谱图。将蛋白样品溶解于pH 8的0.01 mol/L磷酸盐缓冲液,稀释蛋白至合适浓度,取适量样液,在激发波长290 nm、扫描范围300~400 nm条件下,记录最大发射波长(λmax)。
1.5.4 暴露游离巯基与二硫键的测定
采用文献[20]的方法并稍加改动,将蛋白样品溶解于Tris-Gly 缓冲溶液,充分溶解后5 000 r/min离心15 min,取上清液测定蛋白浓度。向3 mL的上清液中加入50 μL 4 mg/mL DTNB溶液,混匀后室温放置1 h,以缓冲溶液为空白对照,在412 nm处测定吸光度。暴露游离巯基含量按照公式(1)计算。
(1)
式中:A412为吸光度;C为样品蛋白浓度,mg/mL。
采用文献[21]的方法并稍加改动,30 mg蛋白样品加入4.7 g盐酸胍,用Tris-Gly 缓冲溶液定容至10 mL。取1 mL样液加入4 mL脲-盐酸胍溶液和50 μL Ellman试剂,412 nm处测定吸光度,根据公式(2)计算游离巯基含量。
(2)
式中:D为稀释倍数。
取1 mL样液加入50 μLβ-巯基乙醇和4 mL脲-盐酸胍溶液,25 ℃放置1 h,加入10 mL 12%的三氯乙酸,25 ℃放置1 h,5 000 r/min离心15 min,将沉淀用12%三氯乙酸洗涤2次后溶于5 mL的8 mol/L尿素中,待沉淀完全溶解加入40 μL Ellman试剂,412 nm处测定吸光度,根据公式(2)计算出总巯基含量,根据公式(3)计算二硫键含量。
(3)
1.5.5 二级结构的测定
花生蛋白二级结构采用傅里叶红外光谱仪测定。充分烘干的溴化钾与蛋白样品按照质量比100∶ 1充分研磨混匀压片,扫描波数范围400~4 000 cm-1。测定结果采用Peak Fit 4.12软件进行分析处理。
1.5.6 粒径的测定
采用纳米粒度电位仪测定可溶性蛋白样品粒径。将蛋白样品溶解于pH 8的0.01 mol/L磷酸盐缓冲液,充分溶解后5 000 r/min离心15 min,取上清液测定蛋白含量(考马斯亮蓝法),稀释上清液至合适浓度,取1.2 mL样液于粒径仪测定。由仪器自带软件处理后可得出花生蛋白平均粒径和多分散性指数(polydispersity index,PDI)。
1.5.7 花生蛋白分子量的分布测定
选用TSKgel GMPWXL柱子对蛋白样品进行HPLC分离。流动相采用V(0.1 mol/L 磷酸缓冲液+0.1 mol/L 硫酸钠)∶V(乙腈)=8∶ 2。测定前,所有蛋白质样品均通过0.45 μm膜过滤,进样量为20 μL,采样时间60 min,蛋白质的检测波长280 nm。
1.6 数据分析
所有试验至少重复2次,数据均以平均值±标准差表示,采用SPSS 22软件对数据进行Duncan方差分析(P<0.05),采用Origin软件作图。
2 结果与讨论
2.1 超声处理下不同蛋白浓度对花生蛋白亚基组成的影响
目前有关花生蛋白亚基组成在超声处理前后变化的研究结论并不一致,研究者使用的花生蛋白浓度也各不相同。由图1可知,与对照组的花生蛋白相比,超声处理下各浓度的花生蛋白并没有产生新的亚基条带,同时也没有亚基条带的消失(在更高超声强度下处理也是如此,结果未展示)。可见,超声处理下无论体系中蛋白浓度如何变化,均不能使花生蛋白分子酰胺键断裂,这与Zhang等[6]的研究结论一致。
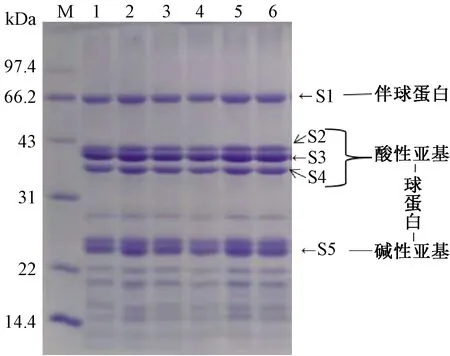
注:M为标准分子质量蛋白;1为对照组花生蛋白;2—6为400 W 超声处理5 min的花生蛋白(蛋白浓度分别为0.005、0.010、 0.050、0.100、0.150 g/mL)。图1 不同浓度花生蛋白超声处理后的亚基组成Fig.1 Subunit composition of peanut protein with different concentrations after ultrasonic treatment
2.2 超声处理下不同蛋白浓度对花生蛋白表面疏水性和内源荧光光谱的影响
如图2所示,超声处理后的花生蛋白表面疏水性明显改变。与对照组花生蛋白相比,400 W条件下低浓度蛋白(0.005、0.010、0.050 g/mL)超声处理5 min后表面疏水性略有增加;而0.100 g/mL的花生蛋白经同等超声强度处理后,表面疏水性显著增加;随着花生蛋白浓度的增大,蛋白表面疏水性反而下降。此外,与对照组花生蛋白的内源荧光最大发射波长(329 nm)相比,不同浓度的花生蛋白经超声处理后,只有0.100 g/mL花生蛋白的λmax(331 nm)发生了明显红移。超声波的作用机理主要是空穴效应,在超声过程中空化泡不断炸裂并循环往复。导致低浓度时蛋白表面疏水性和λmax改变不明显的原因可能是:此时的低浓度蛋白体系不适合产生强烈的空穴效应;即使空穴效应强烈,但体系中蛋白分子数量较少时对空穴效应有逃避的可能。而当蛋白浓度过高时(如0.150 g/mL),体系黏度也随之显著增加,会影响空化泡的形成,此时同样不利于蛋白质的改性。说明在过低或过高的蛋白浓度下,超声波不会显著改变花生蛋白的表面疏水性和内源荧光最大发射波长。
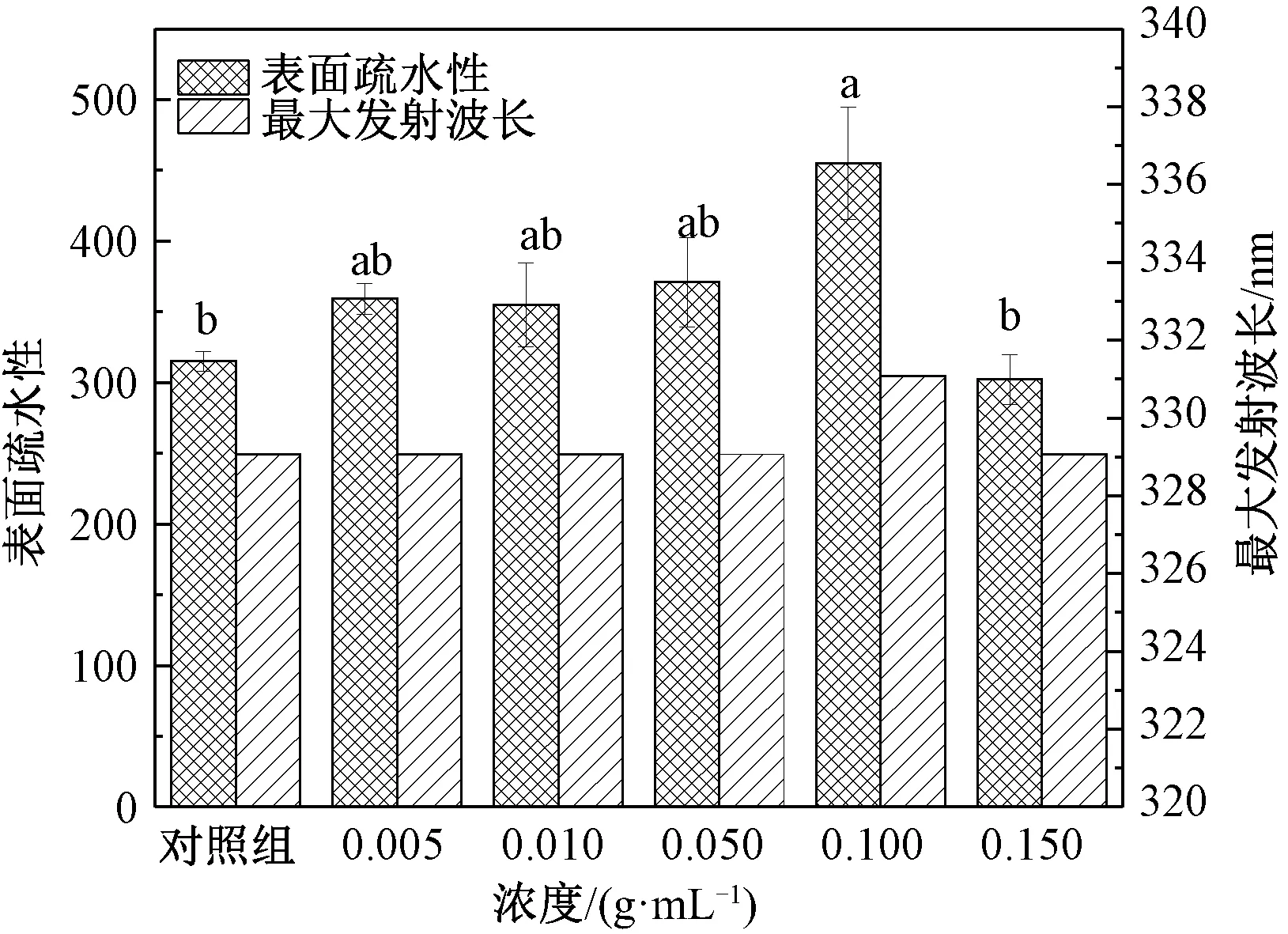
注:不同小写字母表示差异显著(P<0.05)。图3、图4同。图2 不同浓度花生蛋白超声处理后的 表面疏水性和内源荧光发射波长Fig.2 Surface hydrophobicity and endogenous fluorescence emission wavelengths of peanut protein with different concentrations treated by ultrasound

图3 不同浓度花生蛋白超声处理后的暴露游离 巯基与二硫键含量Fig.3 Content of exposed free sulfhydryl groups and disulfide bonds after ultrasonic treatment of peanut protein with different concentrations
2.3 超声处理下不同蛋白浓度对花生蛋白暴露游离巯基与二硫键含量的影响
暴露游离巯基的含量可以反映蛋白结构的变化。如图3所示,同等强度超声处理后,与对照组花生蛋白相比,各个浓度超声处理后花生蛋白的暴露游离巯基含量均显著增加,应该是蛋白分子展开所致,这与李侠等[22-23]对花生蛋白超声处理的研究结果一致。蛋白浓度0.005~0.100 g/mL时,超声处理后暴露游离巯基含量逐渐增大,在0.100 g/mL时达到最大;当浓度增大到0.150 g/mL时,暴露游离巯基含量有所下降,这与表面疏水性的改变趋势一致,进一步说明在蛋白浓度0.100 g/mL进行超声处理时,花生蛋白分子的展开程度最高。
对于蛋白质而言,半胱氨酸残基中的巯基可以与二硫键相互转化。蛋白分子可以通过二硫键连接形成更大的蛋白聚集体。如图3所示,同等强度超声处理后,与对照组花生蛋白相比,各个浓度超声处理后花生蛋白的二硫键数量都有所增加,其中以0.010 g/mL的花生蛋白超声处理后二硫键含量增加最为显著。说明超声促使蛋白表面游离巯基含量增加后,这些游离巯基之间还发生了部分交联。
2.4 超声处理下不同蛋白浓度对花生蛋白二级结构的影响
通过红外光谱图中酰胺Ⅰ带(1 700~1 600 cm-1)测定蛋白质二级结构的变化,一般认为:β-折叠(1 600~1 640 cm-1),无规则卷曲(1 640~1 650 cm-1),α-螺旋(1 650~1 660 cm-1),β-转角(1 660~1 700 cm-1)[24]。由表1所得到的二级结构分布可知,不同浓度花生蛋白经超声处理后与对照组花生蛋白相比,α-螺旋与无规则卷曲含量不存在显著性差异,但0.010 g/mL蛋白浓度处理时β-折叠含量显著下降,β-转角含量显著增加。说明该蛋白浓度下超声破坏了部分β-折叠片中的氢键,促使其多肽链反转180°形成了β-转角[25]。总体来说,花生蛋白在超声后二级结构变化较小,这可能与超声强度较弱有关。
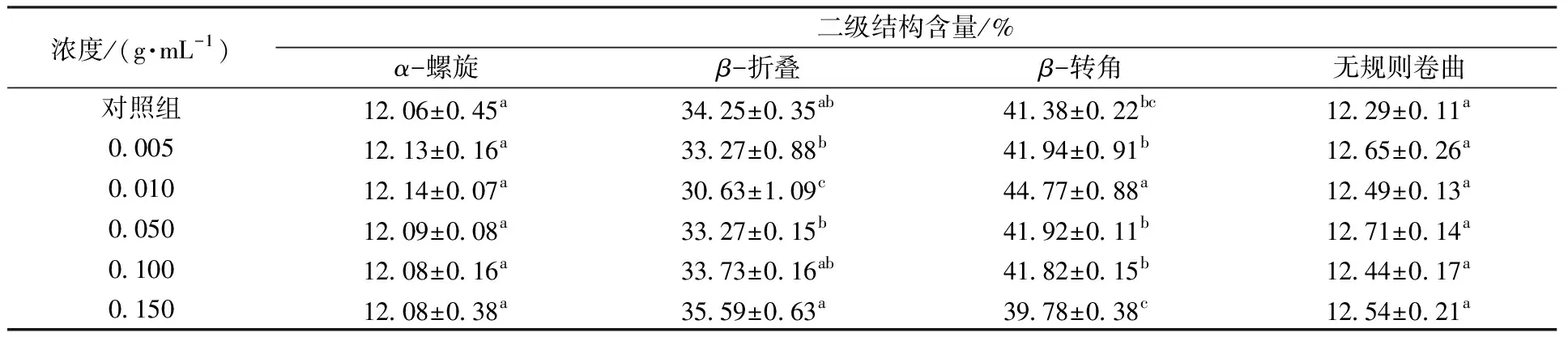
表1 不同浓度花生蛋白超声处理后的二级结构分布Table 1 Secondary structure distribution of peanut protein with different concentrations after ultrasonic treatment
2.5 超声处理下不同蛋白浓度对花生蛋白粒径的影响
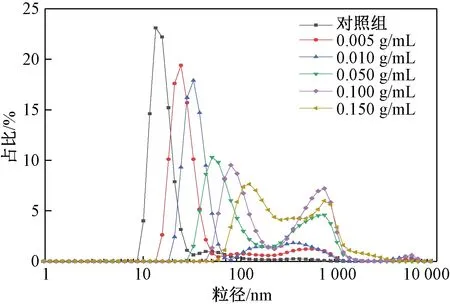
图4 不同浓度花生蛋白超声 处理后的粒径分布Fig.4 Particle size distribution of peanut protein with different concentrations after ultrasonic treatment
由图4可知,对照组蛋白和0.005 g/mL超声处理的可溶性蛋白粒径分布相对集中,主要呈现1个大峰,而超声处理下其他浓度的蛋白粒径分布主要呈现2个大峰。由表2可知,对照组花生蛋白分子的平均粒径164.47 nm,经过超声处理后,各个浓度的花生蛋白的平均粒径均显著增大,在花生蛋白浓度0.100 g/mL时,超声处理后的蛋白粒径达到263.23 nm,可能原因是此时蛋白分子充分展开后暴露出更多的疏水基团(图2),分子间疏水相互作用增强导致蛋白质分子聚集,平均粒径随之增加。PDI可以反映所测定样品体系中粒径的分布情况,数值越小代表该样品分布比较均匀。0.005 g/mL花生蛋白经过超声处理后PDI最小,说明该浓度下蛋白超声后粒径分布最均匀。值得注意的是,目前也有关于蛋白质在超声后粒径减小的研究报道[26-27],这很有可能与研究者采用的超声强度不同有关。尝试在更高超声强度下(500 W,5 min)处理花生蛋白,发现其平均粒径减小,这说明高超声强度虽然不会使蛋白亚基发生降解,但可能会通过破坏亚基间疏水相互作用导致其相互离解。

表2 不同浓度花生蛋白超声处理后的平均 粒径与PDITable 2 Average particle size and PDI of peanut protein with different concentrations after ultrasonic treatment
2.6 超声处理下不同蛋白浓度对花生蛋白分子量分布的影响
如图5所示,根据分子排阻高效液相色谱测定,对照组花生蛋白按分子量不同分为P1、P2和P3三大类组分,不同浓度的蛋白超声处理后主要组分的出峰时间明显前移,表明有更大分子量的新组分(可溶性蛋白聚集体)生成,这也和蛋白粒径分布测定的结果(图4)相互印证,说明适当强度的超声处理可以促使花生蛋白发生聚集,分子量增加,与Jiang等[28]的报道一致。由于样品在测定前通过了0.45 μm膜过滤,一些具有更大粒径(如超过500 nm)的蛋白聚集体在液相色谱图上得不到体现。不同浓度的蛋白色谱图之间差异并不大,但对0.005 g/mL蛋白进行超声处理时,蛋白分子量的增加幅度略小。此外,花生蛋白经超声处理后出现了少量更低分子量的组分,说明在此超声强度作用下,虽然蛋白亚基聚集的现象更加明显,但同时也会有少量亚基从原有蛋白寡聚体中发生解离。因此,可以推断花生蛋白在超声作用下亚基的聚集和解离现象同时存在,究竟以哪种现象为主则与超声强度有关。

图5 不同浓度花生蛋白超声处理后的 分子量分布Fig.5 Molecular weight distribution of peanut protein with different concentrations after ultrasonic treatment
3 结论
在本研究的超声体系中,无论蛋白浓度高低,都不能使花生蛋白亚基发生降解,然而蛋白浓度对其他结构特性(表面疏水性、内源荧光光谱、暴露游离巯基含量和二级结构)有显著影响。在低超声强度下各个浓度花生蛋白的平均粒径均显著增大,在高超声强度下平均粒径则显著减小。在超声过程中蛋白分子聚集和亚基解离现象同时存在,低强度超声主要引起分子聚集(可能通过暴露的活性基团相互作用),高强度超声主要引起亚基解离(可能通过破坏分子内/间的非共价作用力)。已有关于蛋白超声改性的研究选用的蛋白浓度较低,本研究发现一定超声强度下,蛋白浓度会显著影响超声改性效果,因此,为达到蛋白分子结构特性的预期改性目标,超声时选择合适的蛋白浓度十分重要。
