重症监护病房耐碳青霉烯类肠杆菌目细菌的耐药特征
2022-07-12马思宇徐天祎马立艳首都医科大学附属北京友谊医院检验科北京00050首都医科大学临床检验诊断学系北京00069
马思宇,徐天祎,马立艳(.首都医科大学附属北京友谊医院检验科,北京00050;.首都医科大学临床检验诊断学系,北京00069)
耐碳青霉烯类肠杆菌目细菌(carbapenem resistant Enterobacterales, CRE)的检出率正在逐年上升,且传播力强,已成为近十年来全球重大公共卫生问题之一。2017年世界卫生组织发布的《全球抗生素耐药细菌优先性列表》中,CRE位于优先1级-危急[1]。2021年全国细菌耐药监测网显示,肺炎克雷伯菌对亚胺培南的耐药率高达23.1%[2]。中国CRE监测网数据表明,CRE的死亡率为33.5%,血流感染30 d病死率为46.2%,所致侵袭性感染的治疗用药选择非常有限[3]。
重症监护病房患者由于病情危重、免疫功能抑制、侵入性操作多等,发生CRE感染的机会大大增加,医院感染控制和抗菌药物管理也更加困难。本研究收集2019—2020年北京友谊医院重症监护病房临床分离CRE菌株,对其耐药特征进行检测和分析,旨在为临床抗感染治疗选药和医院感染控制提供科学依据。
1 材料与方法
1.1菌株来源 收集2019年1月1日至2020年10月31日北京友谊医院重症监护病房分离CRE菌株,标本来源于血液、腹腔引流液、胆汁、尿液和痰液,剔除同一患者相同部位重复菌株。所有菌株经基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)鉴定,-80 ℃保存备用。
1.2试剂和仪器 E-test条(郑州安图生物公司),药敏纸片(英国Oxiod公司),黏菌素标准品(中国食品药品检定研究院),阳离子调节肉汤(cation adjusted Mueller-Hinton broth, CAMHB)(英国Oxiod公司),基因组DNA提取试剂盒、PCR相关试剂(上海生工生物公司)。ABI 7500 PCR仪、3730 XL测序仪(美国应用生物系统公司),电泳仪(美国Bio-Rad公司)。
1.3药物敏感性试验 采用E-test条进行头孢曲松、头孢他啶、哌拉西林/他唑巴坦、亚胺培南、美罗培南、氨曲南、阿米卡星、环丙沙星和左氧氟沙星药物敏感性试验;采用纸片扩散法进行头孢他啶/阿维巴坦药敏试验,按照美国临床和实验室标准协会(CLSI) M100-S31药物敏感折点进行结果判读[4]。按需氧菌的抗菌药物稀释法敏感性试验(CLSI M07-A11, 2018)进行黏菌素微量肉汤稀释法药敏试验,每个试验孔中药物终浓度范围为0.062 5~64 mg/L,参照EUCAST 10.0版药物敏感折点进行结果判读,黏菌素最低抑菌浓度(minimum inhibitory concentration, MIC)≤2 mg/L敏感,>2 mg/L耐药[5]。CRE定义为肠杆菌目细菌对美罗培南、亚胺培南、厄他培南中介或耐药,或产碳青霉烯酶。药敏试验质控菌株为大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853,肺炎克雷伯菌ATCC 700603、BAA 1705和BAA 1706。
1.4耐药基因检测 按照基因组DNA提取试剂盒说明书提取待测菌株DNA作为模板。采用PCR方法检测待测菌株中的碳青霉烯酶基因(blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48)[6]。由上海生工生物公司合成引物。反应条件为:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 40 s,72 ℃ 50 s,30个循环;72 ℃ 5 min。采用多重PCR方法检测待测菌株中质粒介导的黏菌素耐药基因(mcr-1、2、3、4和5),引物序列参照文献[7]。多重PCR反应体系总体积50 μL,包括PCR Master Mix 25 μL,5对上、下游引物各2.2 μL,ddH2O 1 μL,模板2 μL。反应条件:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火56 ℃ 60 s,延伸72 ℃ 60 s,25个循环;72 ℃再延伸5 min。PCR产物行15 g/L琼脂糖凝胶电泳,将所有PCR阳性扩增产物送上海生工生物公司测序,测序结果在NCBI网站进行BLAST比对。将测序证实为靶基因扩增产物的菌株作为PCR反应的阳性质控菌株。引物序列及产物长度见表1。

表1 耐药基因检测所用引物和扩增产物长度
1.5多位点序列分型(multilocus sequence typing, MLST) PCR扩增(http://bigsdb.web.pasteur.fr/klebsiella/primers_used.html)86株肺炎克雷伯菌7个管家基因(rpoB、infB、phoE、mhd、pgi、gapA、tonB),扩增产物送上海生工生物公司测序,结果提交http://www.mlst.net进行分析,确定临床分离株的序列分型。
1.6数据分析 采用WHONET 5.6软件(http://www.whonet.org/software.html)进行药敏结果的统计分析。
2 结果
2.1重症监护病房CRE菌株分布和药敏试验结果 共检出98株CRE,分别来自痰液(32/98,32.7%)、血液(24/98,24.5%)、胆汁(16/98,16.3%)、尿液(15/98,15.3%)和腹腔引流液(11/98,11.2%)。其中,耐碳青霉烯类肺炎克雷伯菌(CR-KPN)在所有CRE菌株中占优势(86/98,87.8%),其次是耐碳青霉烯类大肠埃希菌(CR-ECO,6/98,6.1%)和耐碳青霉烯类阴沟肠杆菌(CR-ECL,6/98,6.1%)。98株CRE菌株对头孢曲松、头孢他啶、哌拉西林/他唑巴坦、环丙沙星、亚胺培南和美罗培南的耐药率均为100.0%,对左氧氟沙星、氨曲南和阿米卡星的耐药率分别为89.6%、87.5%和36.4%,对头孢他啶/阿维巴坦和黏菌素的耐药率分别为4.1%和7.1%。CR-KPN菌株对各种药物的MIC分布见表2。
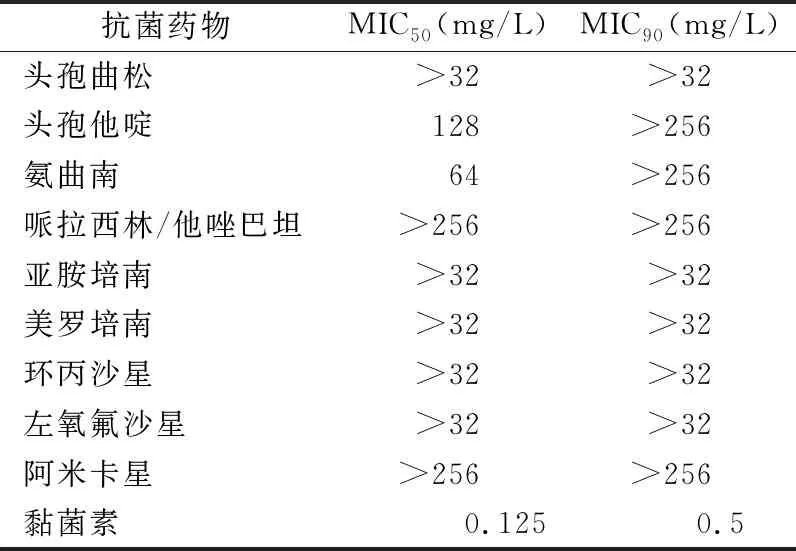
表2 CR-KPN菌株药敏试验结果
2.2碳青霉烯酶基因检测结果及MLST分型结果 98株CRE菌株中,碳青霉烯酶的检出率为84.7%(83/98)。仅携带blaKPC-2的菌株检出率最高,为75.5%(74/98),以CR-KPN为主。只携带blaNDM-1的菌株次之,为6.1%(6/98),以CR-ECO 和CR-ECL 为主。3株CR-KPN同时携带blaKPC-2和blaNDM-1,未检测到blaOXA-48、blaVIM-1和blaIMP-4型碳青霉烯酶。CR-KPN的MLST分型显示,ST11为主要克隆株,占83.7%(72/86),其次为ST37型,占5.8%(5/86),此外还检出2株ST258和1株ST147,另有6株未知型别。
2.3多重PCR检测mcr基因的携带情况 98株CRE中mcr-1的检出率为3.1%(3/98),包括2株CR-KPN和1株CR-ECO。携带mcr-1耐药基因的2株CR-KPN中仅有1株黏菌素药敏结果为耐药(MIC为4 mg/L),携带mcr-1耐药基因的1株CR-ECO黏菌素药敏结果为敏感。7株CRE菌株黏菌素药敏试验为耐药,但仅在1株CR-KPN中检出mcr-1耐药基因。91株CRE菌株黏菌素药敏结果为敏感,MIC分别为1 mg/L和2 mg/L,其中1株CR-ECO和1株CR-KPN检出mcr-1耐药基因。见表3。部分扩增产物电泳见图1。

表3 多重PCR和肉汤微量稀释法检测黏菌素耐药情况
注:M,100~3 000 bp Ladder;1,阳性质控;2和3,部分待测菌株;4,阴性质控。
3 讨论
本研究中,重症监护病房分离的CRE菌株主要来自痰液和血液,可能与重症患者应用抗菌药物、制动卧床体位、机械通气、接受创伤性手术或者侵入性操作治疗有关。张安汝等[8]研究证实,患者发生CRE感染前30 d内有气管插管、三/四代头孢菌素、碳青霉烯类和喹诺酮类药物使用史是CRE感染的独立危险因素,也是感染CRE后死亡的独立危险因素。因此,对重症监护病房患者更应加强抗菌药物使用管理,建议进行耐药菌的主动筛查,以减少CRE感染的发生,提高患者生存率。
我院重症监护病房分离的CRE菌株呈多重耐药,部分菌株仅保留了对头孢他啶/阿维巴坦和黏菌素的敏感性。但是,随着头孢他啶/阿维巴坦和黏菌素在临床中的应用,相应的耐药菌株也相继出现。本研究中,CR-KPN菌株以产A类丝氨酸碳青霉烯酶KPC-2型为主,而CR-ECO和CR-ECL菌株以产B类金属酶NDM-1为主,CRE中未检测到碳青霉烯酶基因的菌株可能与外排泵基因(acrAB,tolC)表达增多、膜孔蛋白基因(ompK35,ompK36)功能缺失或突变有关[9]。
头孢他啶/阿维巴坦2015年在美国上市,是美国食品药品管理局批准的第一个用于治疗CRE感染的抗菌药物。头孢他啶/阿维巴坦是一个三代头孢菌素(头孢他啶)和一个新型β内酰胺酶抑制剂组成的复合制剂,后者可以抑制A、C和D类β-内酰胺酶,在临床使用中可以提高CR-KPN感染患者14 d临床治愈率和30 d死亡率[10-11]。因此,在重症监护病房分离到CRE菌株时,进行碳青霉烯酶酶型或基因型检测非常重要,直接影响抗菌药物的选择和临床治疗效果。
黏菌素直接作用于革兰阴性细菌外膜的脂多糖而发挥抗菌活性,在我国主要用于畜牧业,2017年进入临床使用,但使用率较低。本研究在98株CRE菌株中共检出7株黏菌素耐药菌株,黏菌素耐药率为7.1%。根据文献报道,黏菌素耐药流行病学数据在国内不同地区、不同国家之间均存在一定差异[12-13]。因此,需要针对特定人群尤其是重症监护病房患者进行定向监测。2015年,Liu等[14]学者首次在家畜中发现肠杆菌目细菌质粒携带的黏菌素耐药基因mcr-1,该基因由质粒介导,可在不同种属间水平播散,给临床治疗和感染防控带来极大困难。Wang等[15]研究发现,mcr-1在黏菌素耐药肺炎克雷伯菌中的检出率为23.5%,本研究中7株CRE对黏菌素耐药但mcr检测阴性,提示黏菌素耐药可能存在质粒介导的mcr基因外其他的耐药机制,如pmrA/pmrB系统上调表达、新的mcr基因出现、外排泵活化或异质性耐药等[16-18],从而导致脂多糖发生修饰,黏菌素耐药发生。
本研究中,CR-KPN菌株最常见的基因型别为ST11型,既往研究证实该克隆株传播性强,是临床重症感染的主要病原菌[19]。因此,在重症监护病房更应严格执行手卫生,做好环境清洁和消毒,加强患者监测和环境监测,遵守患者隔离和接触预防原则,从而防止CRE菌株在医院环境内的传播。此外,知晓本病区CRE的流行情况、耐药特征后,临床医生应根据指南和规范更为合理地使用抗菌药物,并做好抗菌药物的保护工作。
综上,重症监护病房分离的CRE菌株对大多数临床常用抗菌药物显示多重耐药,虽然头孢他啶/阿维巴坦和黏菌素保持了较好的抗菌活性,但已经出现对这2种药物耐药的菌株。为了避免出现治疗效果不佳和感控难度加大,需要根据每株菌的药敏试验结果结合患者机体状况和重要脏器功能,谨慎选择用药,同时加强感染控制措施,避免耐药菌株进一步传播。
