某新建医院2017—2020年耐碳青霉烯类肺炎克雷伯菌分子流行病学特征分析*
2022-07-12王婷杜鸿程肖霞邓春敏赵晨苏州科技城医院检验科江苏苏州553苏州大学附属第二医院检验科江苏苏州5004
王婷,杜鸿,程肖霞,邓春敏,赵晨(.苏州科技城医院检验科,江苏苏州553;.苏州大学附属第二医院检验科,江苏苏州 5004)
肺炎克雷伯菌是引起临床感染的重要病原菌之一,可引发呼吸道、血流、尿路等一系列肠外感染,严重者可危及生命[1-2]。碳青霉烯类抗菌药物是对抗肺炎克雷伯菌感染的有效利刃[3]。随着抗菌药物的广泛甚至不合理使用,近年来耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae, CRKP)检出率逐年增高[4]。CRKP检出情况在我国不同地区不同医疗机构也存在很大差异[5]。日益严峻的耐药形势给临床抗感染治疗带来了新的挑战。
苏州科技城医院是一家地处苏州西部地区的公立三级综合性医院,2016年5月正式投入使用,至2017年初,临床各病区陆续全部开放。以往有关新建医院的肺炎克雷伯菌相关研究较少,本研究通过一系列实验,分析该院肺炎克雷伯菌的临床分布、耐药变迁,以及CRKP的分子生物学特征等,为该院防治肺炎克雷伯菌感染提供实验室依据,为进一步探讨新建医院环境下如何有效预防和控制医院感染提供参考。
1 材料与方法
1.1菌株来源 收集2017—2020年苏州科技城医院微生物室分离的763株肺炎克雷伯菌,包括44株CRKP,剔除同一患者相同菌株。
1.2仪器与试剂 Phoenix-100 System全自动微生物鉴定/药敏仪(BD公司),PCR 仪(Applied Biosystems公司),脉冲场凝胶电泳仪、Gel Doc XR凝胶成像系统分析仪(Bio-Rad公司);PCR检测试剂(赛默飞公司),限制性内切酶XbaⅠ(NEW ENGLAND BioLabs公司),GelRed核酸染料(Biotium公司),蛋白酶K(索莱宝公司),琼脂糖凝胶粉(瑞士Lonza 公司)。
1.3菌株鉴定和药敏试验 采用Phoenix-100 System全自动微生物鉴定/药敏仪进行菌株鉴定和8类共17种抗菌药物的最低抑菌浓度(minimum inhibitory concentration, MIC)分析。药敏结果判读参照2017—2020年当年版美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准[6]。质控菌株选择大肠埃希菌ATCC 25922,购于国家卫健委临床检验中心。采用东华病案系统查询患者临床资料,WHONET5.4软件及东华LIS系统统计数据。
1.4脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分析 用PFGE技术对44株CRKP进行同源性分析。取200 μL新鲜菌悬液加入10 μL蛋白酶K(20 mg/mL),与10 g/L的琼脂糖1∶1混匀后加入模具制备胶块;经蛋白酶K消化2 h,洗涤后用限制性内切酶XbaⅠ酶切。配制1.0%凝胶进行PFGE,设置电泳参数:电压6 V/cm,电泳温度14 ℃,电泳方向角度变换:120°,泵速70 r/min。电泳时间18~19 h,脉冲时间为5~40 s。Marker选用苏州大学附属第二医院苏州市临床微生物学重点实验室保存的标准菌株H9812。电泳结束后,用GelRed染色液染色,凝胶成像系统拍摄图像,并用Gel J软件对结果进行分析。
1.5CRKP的耐药性研究
1.5.1耐药基因的筛选 对CRKP菌株用PCR法筛选碳青霉烯酶编码基因blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48。阳性对照物为苏州大学附属第二医院苏州市临床微生物学重点实验室经测序确定并保存的菌株,特异性引物由该实验室根据GenBank中发表的基因序列设计[7],委托上海生工生物公司合成,引物序列见表1。用吸附柱法提取细菌基因组DNA,反应体系共15 μL,包括:2×Taq PCR Master Mix 7.5 μL,ddH2O 4.5 μL,10 μmol/L上、下游引物各0.75 μL,模板1.5 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。行10 g/L琼脂糖凝胶电泳(5 V/cm)20 min,凝胶成像系统分析PCR产物。各类型的阳性扩增产物送上海生工生物工程公司测序,采用ABI 3730XL基因测序仪,测序方法为sanger法测序,结果与GenBank数据库原序列进行比对。

表1 耐药基因PCR引物序列
1.5.2质粒接合转移实验 以PCR扩增阳性的产碳青霉烯酶菌株为供体菌,以E.coliE600(利福平抗性)为质粒受体菌进行接合转移实验。挑取供体菌、受体菌单个菌落分别接种于含0.5 μg/mL美罗培南的1 mL LB培养液中,35 ℃、250 r/min震荡培养16~18 h。取供、受体菌液100 μL共同加入2 mL新鲜LB培养液中,在35 ℃、100 r/min轻微震荡下接合5~6 h,最后吸取100 μL接合菌液涂布美罗培南和利福平双抗性的LB平板,35 ℃温育过夜。以平板上长出的单个菌落为模板,进行菌株鉴定、常用抗菌药物药敏试验,以及PCR扩增碳青霉烯酶基因,筛选出疑似阳性接合子,对扩增产物测序比对,鉴定质粒接合转移子。
1.5.3全基因组测序分析 选取PCR扩增结果呈KPC阳性的肺炎克雷伯菌1株,使用Omega Bio-Tek细菌DNA试剂盒分离基因组DNA,在NovaSeq 6000测序仪上进行测序,使用SPAdes3.11组装校正的数据,进行二代全基因组序列测定分析。
2 结果
2.1肺炎克雷伯菌临床分布特征 该院2017、2018、2019、2020年分离出的肺炎克雷伯菌分别为143株、214株、220株、186株。763株菌中,50.98%分离自痰液,其次是尿液30.80%,血液12.06%,分泌物7.73%;23.07%分离自神经外科,其次是呼吸内科17.96%,重症监护病区(intensive care unit, ICU)13.37%,肿瘤内科10.22%和康复科8.65%等。
2.2肺炎克雷伯菌耐药情况分析 各年度肺炎克雷伯菌对常用抗菌药物的耐药情况见表2。从耐药趋势看,对氨基糖苷类、复方磺胺类耐药率相对稳定;对碳青霉烯类、氨曲南、头孢菌素类、β-内酰胺酶抑制剂复合物的耐药率呈逐年上升趋势。
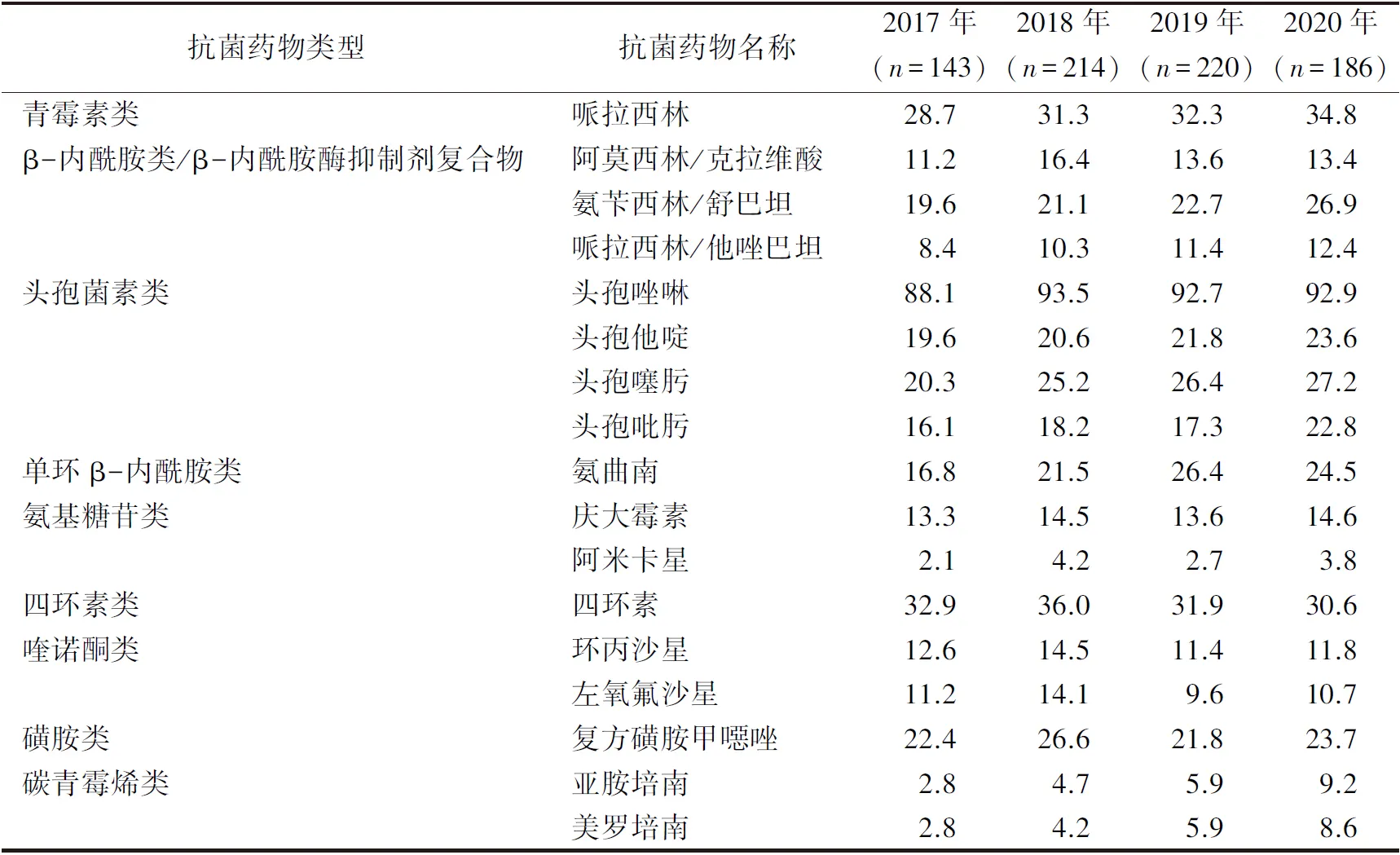
表2 2017—2020年肺炎克雷伯菌对常用抗菌药物的耐药率(%)
2.3CRKP临床分布特征及耐药情况分析 2017—2020年,各年CRKP在肺炎克雷伯菌中的占比分别为2.80%(4/143)、4.67%(10/214)、5.91%(13/220)、9.14%(17/186)。从标本类型来看,86.36%(38/44)分离自痰液,9.09%(4/44)分离自尿液,4.55%(2/44)分离自其他标本。从临床分布来看,40.91%(18/44)分离自神经外科,29.55%(13/44)分离自ICU,11.36%(5/44)分离自肿瘤内科,9.09%(4/44)分离自康复科,9.09%(4/44)分离自其他科室。耐药结果显示,CRKP菌株对阿米卡星、头孢他啶耐药率稍低,分别为51.3%、72.8%,对其他抗菌药物的耐药率均在90%以上。
2.4CRKP的PFGE结果 经Gel J软件分析,以相似度≥80%为同一克隆型作为判断标准,PFGE结果显示,44株CRKP有32个克隆型,无主要克隆型,其中A22型、A26型占比分别为11.4%(5/44)、9.1%(4/44),为相对优势克隆型;其次为A27、A29,均占6.8%(3/44)。部分电泳图见图1。

注:M,标准菌株H9812;1~6,实验菌株。
2.5CRKP菌株耐药机制研究结果
2.5.1耐药基因筛选结果 PCR扩增结果显示有32株菌株碳青霉烯酶基因阳性,分别是2017年blaKPC阳性2株,2018年blaKPC阳性7株,2019年blaKPC阳性6株、blaNDM阳性3株,2020年blaKPC阳性7株、blaNDM阳性3株、blaIMP阳性2株、blaKPC+blaNDM均阳性2株,未检测到blaVIM、blaOXA-48阳性菌株。另有12株菌株未检测到碳青霉烯酶基因。扩增产物送上海生工测序比对,均证实为目的基因片段,其中携带blaKPC基因的菌株均为KPC-2型。部分PCR产物电泳结果见图2、3、4。

注:M,DNA marker;1~11,实验菌株;12,blaKPC阳性对照;13,阴性对照。
注:M,DNA marker;1~5,实验菌株;6,blaNDM阳性对照;7,阴性对照。
注:M,DNA marker;1~2,实验菌株;3,blaIMP阳性对照;4,阴性对照。
2.5.2接合转移实验结果 接合转移子经鉴定为大肠埃希菌,MIC药敏试验结果为亚胺培南、美罗培南耐药,其他类抗菌药物敏感,受体菌为全敏感大肠埃希菌,PCR扩增及测序结果均证实7株blaKPC、2株blaNDM阳性菌株接合转移成功。临床资料显示其中5株blaKPC阳性菌株均来自神经外科。部分接合转移子PCR扩增产物电泳图见图5。

注:M,DNA marker;1,blaNDM阳性对照;2,阴性对照;3~8,双抗板上部分接合转移子blaNDM扩增阳性产物。
2.5.3全基因组测序结果 从筛选出的碳青霉烯酶基因阳性率最高的blaKPC菌株中选取1株CRKP,进行二代全基因组序列测定分析,根据ResFinder网站注释的耐药基因分布图,其中有磷霉素耐药基因1种(14%),氨基糖苷类耐药基因2种(29%),β-内酰胺类耐药基因占57%,其中A类碳青霉烯类耐药基因KPC-2占14%,其余43%均为其他β-内酰胺类耐药基因。由此可见该菌株为KPC-2型。
VFDB网站注释的毒力基因分类较多,根据注释结果,该株菌内没有肺炎克雷伯菌常见的rmpA、rmpA2等毒力基因,有少见的iutA、iroN等毒力基因,且提示有与编码Ⅳ型菌毛相关的pilW基因。
根据测序结果,分析克雷伯菌属7个管家基因(pgi,rpoB,tonB,gapA,mdh,infB,phoE)的序列,得出该株菌为ST11型。
3 讨论
相比同地区其他传统三级医院[8-10],该院肺炎克雷伯菌对各类抗菌药物的耐药率普遍偏低。但随着住院病人的增加,抗菌药物在各临床科室广泛使用,总体耐药率呈逐年升高趋势。与胡付品等研究报道的2020年全国CRKP的检出率高达22.4%[9]相比,该院的CRKP检出率较低,但建院不到一年即出现CRKP菌株,检出率由2017年的2.80%上升至2020年的9.14%,增幅明显。这一研究结果应引起院感等相关部门重视,医院投入使用之初即应严格规范抗菌药物的合理使用,防止致病菌耐药率的过度增长。
本研究中CRKP菌株对常用抗菌药物的耐药率均较高,给临床抗感染治疗带来一定困难。研究表明,联合应用替加环素、多黏菌素、磷霉素等药物治疗CRKP感染的效果明显优于单药治疗[11]。近年来,新型β-内酰胺酶抑制剂合剂,如头孢哌酮/舒巴坦、头孢他啶/阿维巴坦,在CRKP感染的治疗中也发挥重要作用[12]。本研究中无相关抗菌药物的耐药数据,建议该院微生物室立即开展多黏菌素、替加环素、磷霉素、新型β-内酰胺酶抑制剂合剂等抗菌药物的药敏试验,并积极开展相关耐药基因检测,为临床医师合理选择抗菌药物治疗CRKP感染提供有效的实验室依据。
PFGE聚类分析结果显示,该院CRKP菌株型别较多,呈散在分布,与何红等[13]报道的CRKP在长沙市第一医院等医院呈现主要克隆型传播不同,这可能与新建医院运行时间短,感染防控措施有效有关。临床资料显示,A22、A26型菌株均来自2019年10月至2020年4月神经外科、ICU住院患者,部分患者有神经外科、ICU转换住院经历;A27、A29型部分菌株来自2020年下半年康复科患者,且患者前期有神经外科、ICU住院史,表明该院CRKP仍在神经外科、ICU存在小范围克隆传播。这些病区多为重症患者,创伤性操作多,免疫力低下,可能增加CRKP感染机会。另外,CRKP易在环境中定存,如空气粉尘颗粒、物体表面等,该院需高度重视克隆株的出现,严格采取有效隔离措施及环境消毒,规范医护人员无菌操作[14],同时加强耐药菌株的监测,防止耐药菌株进一步传播。
相关报道显示,产KPC-2酶是国内肺炎克雷伯菌对碳青霉烯类耐药的主要机制[15],其次是产NDM酶,产OXA-48的CRKP菌株也偶被报道[16],blaIMP、blaVIM的检出率较低[17]。本研究32株CRKP中,blaKPC-2型24株,为主要型别,其次是blaNDM型8株,与国内流行趋势大体一致。有研究提示多种耐药基因共存可能是导致医院CRKP广泛耐药的重要原因[18]。相比较陈金云等[19]研究报道的浙江地区4家公立三级医院近年来分离出的104株CRKP中,blaKPC阳性102株,blaIMP阳性2株,本研究中CRKP的耐药基因型由2017年、2018年仅出现blaKPC型,2019年增加了blaNDM型,到2020年又增加了blaIMP型,blaKPC、blaNDM共存型,逐年多样性,耐药形势相当严峻,应引起临床抗感染治疗的高度重视。
目前已有研究表明,blaKPC主要存在细菌的质粒上,不需要依赖膜孔蛋白的丢失,可单独引起碳青霉烯类耐药,并且可以在不同菌种间水平传播,易导致院内爆发流行[20]。在本研究的接合转移实验中,接合转移成功的blaKPC阳性菌株中有4株为A22型、2株为A26型,临床资料显示,这6株菌有5株来自神经外科,1株来自ICU,且PFGE结果分型中A22、A26型的9株菌均表达KPC-2基因,表明该型菌株已经引起小范围传播流行,后期感控部门及相关科室应严密监控该型CRKP菌株的检出情况,可以对CRKP患者采取隔离措施,同时醒目标识,如佩戴多重耐药菌腕带,还需进一步加强医疗设施的消毒,减少人员探视,加强手卫生等,防止耐药质粒水平传播,造成更大范围更多菌种的多重耐药情况发生。
rmpA和rmpA2基因主要编码一种黏液因子,在肺炎克雷伯菌中存在rmpA和rmpA2基因,则表现为高黏液性[21]。相关报道表明,CRKP菌株中,高黏液型菌株有高致病性[22]。IutA是铁载体相关受体蛋白,在大肠埃希菌中较多见,在临床环境中,含铁载体受体的菌株可对肠道产生致病性[23]。编码Ⅳ型菌毛相关的pilW基因及其直系同源物是Ⅳ型菌毛特定的脂蛋白[24],pilW是一种多功能蛋白质,常见于奈瑟菌中,在肺炎克雷伯菌中比较少见[25]。测序结果中该代表菌株无rmpA、rmpA2毒力基因,表明该菌非高黏液型,致病性相对较弱,但携带有以往肺炎克雷伯菌中比较少见的iutA、iroN、pilW等基因,不排除有新的致病因素出现,需后期进一步研究探索。
肺炎克雷伯菌耐碳青霉烯类抗菌药物的主要机制是产碳青霉烯酶,此外还存在其他机制可导致碳青霉烯类抗菌药物耐药,常见的是突变孔蛋白、超广谱β-内酰胺酶、AmpC机制,另外药物外排泵、青霉素结合蛋白的修饰等也会导致其对碳青霉烯类耐药[26]。本研究中有12株菌未检测出碳青霉烯酶编码基因,推测这12株CRKP的耐药表型可能与上述机制相关。
由于新建医院尚处于运行初始阶段,标本量有限,本研究的部分结论有待进一步探讨。综上所述,该新建医院CRKP的检出率呈逐年上升趋势,耐药基因型逐渐多样性,应予以高度关注,严格规范抗菌药物的使用,控制耐药菌株传播。
