乌江渡水库沉积物风干和过筛处理与原始沉积物中微生物群落的差异比较分析*
2022-07-11徐韬,陈晨,杨飞,田楼,杨阳▲
徐 韬,陈 晨,杨 飞,田 楼,杨 阳▲
(1贵州师范大学材料与建筑工程学院,贵州 贵阳 550025;2贵州师范大学生命科学学院,贵州 贵阳 550025)
0 引言
湖泊微生物作为食物网重要的组成成分,发挥着重要的作用。水库中的沉积物是水库内源污染源[1]。表层沉积物是微生物聚居和进行物质代谢和循环的主要场所和介质,微生物通过同化分解等代谢过程来影响沉积物中甚至水体中的营养盐及污染物的分布、转化和利用等。细菌在微食物网中对物质和能量的循环起着关键的作用。沉积物细菌种类丰富,代谢活性高,且对环境变化响应迅速,因此,水体沉积物微生物群落可以作为水环境变化和演替的重要指标,对了解水环境的营养和污染状态有重要作用[2]。目前,已有大量对湖泊/水库沉积物微生物群落的研究,然而,对贵州省内云贵高度的湖泊/水库中水体和沉积物微生物群落结构、分布还远远不够[3-5]。云贵高原湖泊区是中国五大湖区最小的湖区[6],相对于平原水体,高原湖泊/水库相对独立,对气候变化敏感,且对认为的干扰更加敏感。高原水体中蕴含着大量的微生物资源,因此,对其中微生物群落的研究能够帮助我们更清楚地认识贵州省内高原水库中微生物的群落特征,从而进一步了解水体的营养状态和物质循环机制。
传统微生物的研究离不开微生物的分离和培养,然而自然界中,尤其是水体中的绝大部分微生物很难在实验室被培养[7]。随着技术的发展,对沉积物微生物群落的研究主要基于测序的手段开展,包括扩增子测序和宏基因组测序等技术。测序技术为从群落水平了解水体微生物的生态特征打开了新篇章[8-9]。然而,研究中对沉积物样品的采集和处理存在不同,有的研究选择于采样时直接保存沉积物待DNA提取[10-14],有的研究则进行风干过筛处理后再进行DNA提取[15-16]。那么,原始沉积物和风干过筛处理后的沉积物中微生物群落是否有较大的差异呢?造成这些差异的原因是什么呢?本研究选取乌江渡水库4个采样点的沉积物,分别进行风干处理和风干后过筛处理,对处理后和原始的沉积物进行16S rRNA测序,在初步了解乌江渡水库沉积物微生物群落结构的基础上,进一步比较分析风干和过筛处理对沉积物细菌群落结构的差异,从而为沉积物微生物样品的处理提供了数据支持和依据。
1 材料与方法
1.1 样品采集
乌江渡水库位于乌江流域,是西南地区重要的水系之一。乌江渡水库地处贵州省息烽县和遵义县交界处,是乌江干流第十一个梯级电站的第六级,为典型的峡谷型水库。该水库属于季节性调水,总库容23亿m3,平均水深154 m,水库总面积48 km2。乌江流域的水库均有不同程度的水产养殖,因此,其水体沉积物中有不同程度的营养盐和重金属聚集[17]。该水库平均水力滞留时间为30~135天(丰水期和枯水期)。
于2021年5月在乌江渡水库设置4个采样点,分布为江口(JK)、漩塘(XT)、息烽河(XF)和偏岩河(PY)(图1)。采样点选取在干流与支流的交汇处,沿着乌江流域分布。采用抓斗式采泥器采集沉积物样品,收集表层(0~5 cm)的沉积物,于冰盒中保存,每个采样点抓取3次,混合后成为1个样品,每个样品分成3份,1份直接保存为原始沉积物,1份自然风干5天后冻存(dried),另1份自然风干5天后过100目筛后冻存(filtered)。
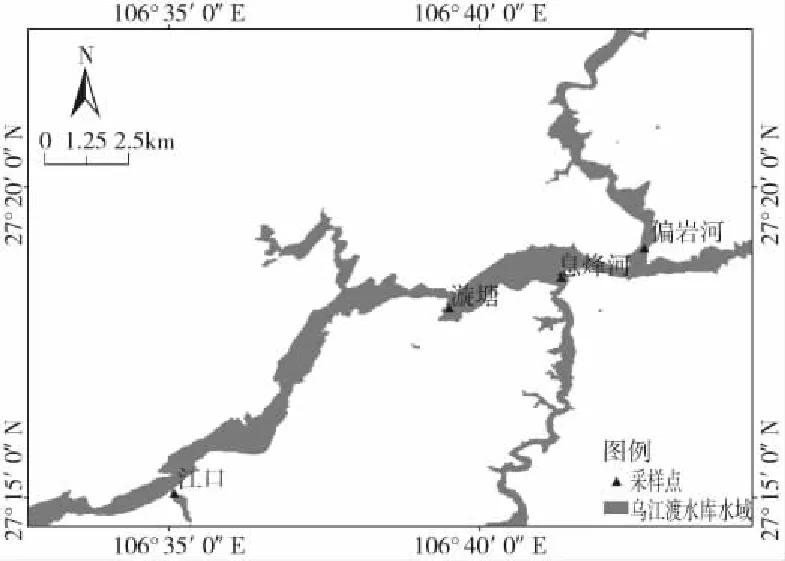
图1 乌江渡采样点地理位置分布图Fig.1 Distribution of sampling sites in Wujiangdu Reservoir
1.2 沉积物DNA提取和测序
用ALFA-seq Advanced Soil DNA kit试剂盒进行基因组DNA提取后,利用1%琼脂糖凝胶电泳检测DNA完整性和纯度,利用NanoDrop One检测DNA浓度和纯度。以基因组DNA为模板,选择515F和806R引物对16S v4-v5区域进行PCR扩增。按照NEBNext Ultra DNA Library Prep Kit for Illumina标准流程进行建库,之后使用Illumina Hiseq2500 平台对构建的扩增子文库进行PE250测序。
1.3 数据分析
测序数据通过paired-end raw read数据过滤和拼接获得原始拼接序列,用Mothur软件进行质量过滤后得到有效的拼接片段(Clean Tags)。用usearch软件对所有样品的全部clean tags进行聚类,以97%的一致性将序列聚类成为OTU。为了有效地后序分析,利用Qiime从每个OTU所属的序列中,抽取出现频数最高的序列来代表相应的OTU。利用Qiime中的assign_taxonomy.py脚本和RDP Classifier方法,将每个OTU的代表序列与Greengenes数据库进行比对获得物种注释信息,从而得出所有序列物种来源。利用PICRUSt软件,基于OTU的物种注释和丰度信息,将KEGG数据库中已有基因组的原核生物16S rRNA序列与SILVA数据库中16S rRNA序列进行关联,然后将KEGG数据库已有的原核物种基因组进行序列。
用R软件进行后续数据处理,主要包括计算群落多样性指数(OTU数目、Simpson指数、Shannon指数、均匀度指数、Chao1和ACE)和Bray-Curtis距离。方差分析(ANOVA)用于比较不同处理直接细菌群落多样性指数的差异,运用PCoA排序方法研究不同处理细菌群落的相似性,ANOVA和PCoA使用“vegan”程序包进行[18]。
2 结果与分析
2.1 沉积物微生物群落组成
在原始沉积物中,4个采样点共检测到5869-6210个OTUs,风干或过筛处理后分别检测到6359-6488个和6186-6414个OTUs。在门水平上,原始、风干和过筛后沉积物的微生物群落中,变形菌门(Proteobacteria)为主要优势类群,相对丰度均大于30%,其相对丰度在风干和过筛后有一定程度的降低。绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)的相对丰度在风干和过筛处理后升高,成为次优势类群。其次在风干和过筛处理组为拟杆菌门(Bacteriodetes)和放线菌门(Actinobacteria),而在原始沉积物中为Bacteriodetes和硝化螺旋菌门(Nitropspirae)。Actinobacteria在风干和过筛后其相对丰度从 3.5%升高至7.5%和7.8%(图2)。

图2 各处理组沉积物微生物群落优势类群(门水平和纲水平)相对丰度(control:原始沉积物;dried:风干沉积物;filtered:过筛沉积物)Fig.2 Relative abundance of dominant bacterial groups bydifferent treatment(phylum and class level)
Proteobacteria在各组中均为优势类群,主要包括γ-Proteobacteria,Δ-Proteobacteri和α-Proteobacteria。其中,γ-Proteobacteria为主要优势类群,分别占比19%、16.6%和16.1%,在原始沉积物中,第二优势类群为Δ-Proteobacteria(10.8%),这一类群在风干处理组和过筛处理组中相对丰度降低,α-Pro-teobacteria的相对丰度为5.3%、5.5%和5.7%。Chloroflexi中厌氧绳菌纲(Anaerolineae)的相对丰度从原始沉积物中的7.4%升高至12.9%和11.4%。
选取5类门水平和纲水平优势细菌进行方差分析,结果表明,不同优势细菌在原始沉积物、风干和过筛沉积物中存在显著性差异。将风干和过筛两组处理进行对比,在门水平和纲水平上,优势细菌差异均不显著(p>0.05)。

表1 不同处理沉积物中优势细菌相对丰度方差分析Tab.1 ANOVA analysis of the relative abundance of dominantbacterial groups by different treatment
2.2 沉积物微生物群落多样性比较
风干处理后微生物OTU数目、Chao1指数和ACE指数增多,原始沉积物中OTU数目最少。Simpson、Shannon指数和均匀度指数无较大差异。ANOVA检测结果显示各个采样点之间的多样性指数差异不显著(p>0.1)(图3)。

图3 乌江渡水库各采样点多样性指数(JK:江口;PY:偏岩;XF:息烽;XT:漩塘)Fig.3 Diversity indexes of each sampling site inWujiangdu Reservoir
2.3 沉积物微生物群落结构和功能比较
原始沉积物微生物群落异质性较高,4个采样点微生物群落差异较大,而风干和过筛之后的沉积物中微生物群落在图中分布集中,而原始沉积物群落分布范围较大,相互之间有一定的距离(图4)。PerMANOVA检验结果显示,除了种水平上群落结构差异不显著(p=0.34),其他分类水平(包括:属、科、目、纲)上风干和过筛处理后微生物群落结构有显著的差异(p<0.01)。基于不同的分类水平的数据进行NMDS排序分析,排序图中风干和过筛处理后的沉积物微生物群落较原始微生物群落更为集中。韦恩图结果显示三组处理沉积物微生物群落有共同OTU 154个,原始沉积物、风干和过筛处理后沉积物微生物群落特有OTU,分别为80个、66个和67个(图5)。

图4 沉积物微生物群落排序(Control:原始沉积物;dried: 风干沉积物;filtered:过筛沉积物)Fig.4 PCoA ordination of sediment bacterial communities
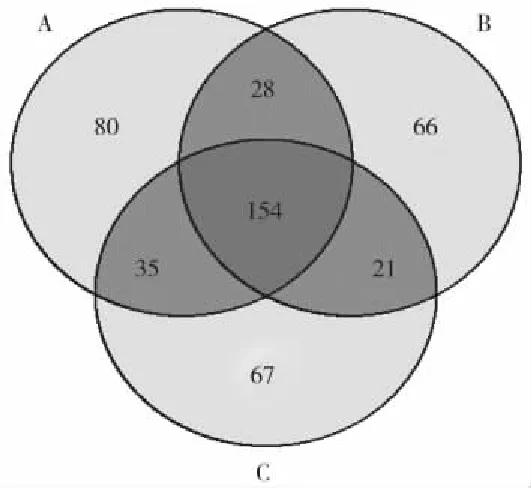
图5 不同处理沉积物微生物Venn图(A:原始沉积物;B:风干沉积物;C: 过筛沉积物)Fig.5 Venn diagram of sediment bacterial communities bydifferent treatments
将各个采样点原始、风干和过筛后的沉积物微生物群落进行比较分析,计算Bray-Curtis距离发现,在种属水平上,XF站点群落结构差异最大,而在门、纲、目和科水平上,PY站点群落差异最大(图6)。

图6 各采样点原始、风干和过筛后沉积物中微生物不同分类水平上群落Bray-Curtis距离(a.Species: 种;b.Genus:属;c.Family:科;d.Order:目;e.Class:纲;f: Phylum:门;JK:江口;PY:偏岩;XF:息烽;XT:漩塘)Fig.6 Bray-Curtis distance of sediment bacterial communitiesby different treatments at different taxonomic levels
不同处理沉积物微生物群落16S基因预测功能进行比较,结果显示,16S基因功能预测注释主要为代谢相关基因,其次为基因信息处理相关(图7)。三组处理直接预测功能基因相对丰度无显著差异,其中功能集中在以碳水化合物代谢、氨基酸代谢和辅助因子及维生素代谢相关的基因(图7b)。
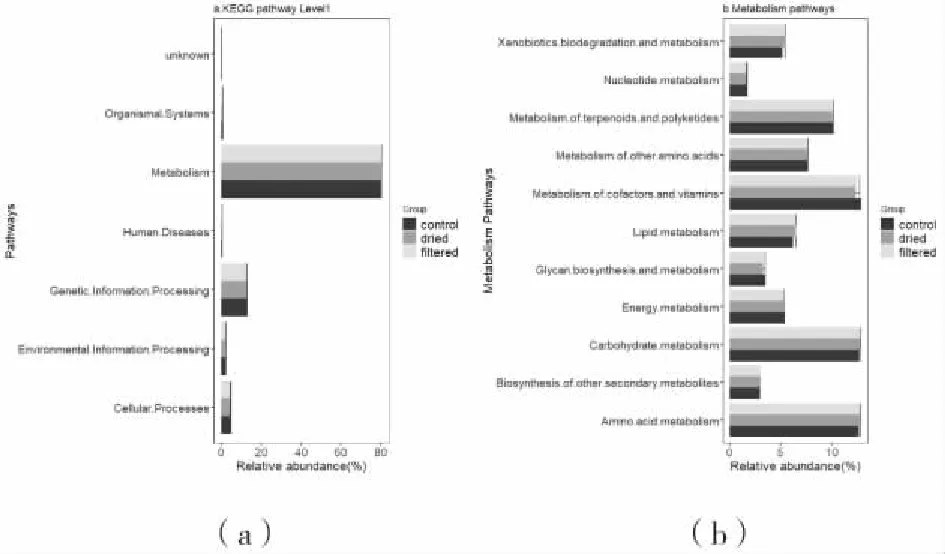
图7 基因功能注释KEGG基因相对丰度Fig.7 Relative abundance of KEGG functional genes
3 讨论
3.1 乌江渡水库沉积物细菌群落特征
湖泊/水库沉积物中主要优势类群包括变形菌门、酸杆菌门、放线菌门、拟杆菌门、厚壁菌门等[19],这与本研究的结果一致。乌江渡水库沉积物中的主要优势类群为Proteobacteria,其中主要包括γ-Proteobacteria和Δ-Proteobacteria。这些微生物在水体有机物污染降解、碳循环和地球化学循环中起到重要作用。Poteobacteria可能与底泥的各种营养盐及其生物化学过程有密切关系。大多数Proteobacteria在碳和氮代谢过程中具有重要作用,尤其对于可降解的有机质具有很强的代谢能力,在富营养化水体中常见。其中α-Proteobacteria,β-Proteobacteria,γ-Proteobacteria中包含许多反硝化细菌,能够进行自养或异养反硝化。Chloroflexi为光能自养型细菌,兼性厌氧,也存在专性厌氧菌[20],可以在不同条件下生存,其中多数种类与有机污染物降解有关。作为优势类群之一的绿弯菌,可能在乌江渡水库的污染物降解方面起着重要作用。放线菌门在降解有机物过程中起着主要作用,拟杆菌门主要参与湖泊中亚硝酸盐还原过程[21]。
3.2 不同处理沉积物微生物群落比较
原始沉积物与风干和过筛处理后微生物群落比较发现,其中主要优势类群一致,但是其相对丰度发生了一定程度的变化。优势细菌Proteobacteria和Actinobacteria存在显著的丰度差异,而其他优势类群,包括Chloroflexi,Acidobacteria,和Bacteroidetes没有显著的丰度差异。在纲水平上,Δ-Proteobacteria 存在显著差异。Proteobacteria是水体微生物群落的典型细菌类群[22]。沉积物中γ-变形菌和Δ-变形菌在变形菌门中占主导地位,这是因为该类群中有大量与氮、硫元素代谢相关的菌群,与物质循环息息相关[12]。厚壁菌门能促进植物残留物的降解,其中的芽孢杆菌和梭菌适应性和繁殖力强,能产生芽孢耐受风干研磨这类的环境压力[23]。Acidobacteria(酸杆菌门)生态幅较宽,能够适应多种环境条件。
风干和过筛处理后沉积物微生物群落多样性改变,但是其群落多样性指数差异不显著。该结果表明,微生物群落组成上多样性并未发生显著的改变,风干处理和过筛处理,可以被视为一种环境选择因子,改变了细菌群落中各个类群的相对丰度。面对环境胁迫各个菌门的响应有所不同,这与不同类群细菌具有的生理特性相关。另一方面,可能是由于扩增子测序,有许多序列无法注释到目以上的分类水平。其次,风干和风干后过筛处理两者之间差异较小。此外,原始沉积物由于含水量较高,表层沉积物与水体的物质交换频繁,许多水体中的细菌也会出现在表层沉积物中。因此,沉积物含水量是导致沉积物中微生物群落结构变化的主要环境因子。失水成为环境选择压力,筛选出能够适应干旱条件的微生物种类,同时对干旱敏感的细菌类群将被淘汰。细菌的孢子(厚壁菌门的内孢子、放线菌的外生孢子)被认为是细菌脱水耐性的机制[24]。
乌江渡水库不同采样点沉积物细菌群落结构存在差异,各个采样点沉积物不同处理后的差异大小也不同。息烽采样点(XF)位于息烽河口处,附近有一座磷肥厂,加上网箱养鱼投放的饵料等[17,25],造成了息烽河水体营养盐浓度较高,水质受到矿产污染影响较大。此外,息烽河周围村镇居民耕作使用农药化肥等随地表径流进入河流和水库,与该水库水质营养化程度和污染状态的空间异质性有关。
乌江渡水库沉积物中微生物代谢基因主要集中在碳水化合物、氨基酸代谢方面。对不同处理后沉积物微生物群落16S基因功能预测发现,风干和过筛处理并未对微生物群落8类生物代谢通路基因有显著影响。
4 结论
(1)乌江渡沉积物细菌群落存在空间异质性,不同地理位置沉积物群落结构存在差异,这主要是由各处不同的环境条件决定的。
(2)乌江渡沉积物细菌群落在风干和过筛处理后存在显著差异,其中优势类群的相对丰度发生变化,风干和过筛处理的脱水过程对其中的微生物造成胁迫,进而导致群落结构的变化。风干和过筛处理二者之间的差异不显著。
(3)风干和过筛处理并未导致沉积物细菌群落多样性和基因功能发生显著差异。
(4)建议对水体沉积物微生物的研究使用原始沉积物进行DNA提取测序,不推荐进行风干或者过筛处理。
