miR-147b-5p对人髓核细胞退变的影响
2022-07-11张坤勘武生赵胜豪马中希黄梓君李鲲
张坤 勘武生 赵胜豪 马中希 黄梓君 李鲲
(1武汉市第四医院,湖北 武汉 430000;2湖北中医药大学)
腰椎间盘退行性病变常伴随有椎间盘突出症和(或)退行性腰椎滑脱症,该病具有高发病率,且其护理成本较高〔1,2〕。腰椎间盘在骨骼发育成熟时易发生退变的特征解释了约40%人类腰疼痛病例的病因,虽然疼痛可有效抑制,但有必要探索从根本上解决腰椎间盘退行性病变的新疗法〔3〕。miR-147b-5p参与了多种癌症的发生发展过程〔4,5〕,研究显示〔6〕,miR-147b在人正常和退变的腰椎间盘髓核组织间存在表达差异,在退变髓核组织中表达下调。利用靶基因预测网站分析发现,miR-147b-5p与Notch4存在结合位点,而Notch信号通路与退变的髓核细胞关系密切〔7,8〕。推测miR-147b-5p可能参与了髓核细胞的退变过程。炎性细胞因子是椎间盘退变的主要原因之一,通过白介素(IL)-1β和肿瘤坏死因子(TNF)-α可诱导人髓核细胞(HNPCs)构建腰椎间盘退变体外模型〔9〕。本研究通过IL-1β和TNF-α诱导HNPCs退变模型,观察miR-147b-5p对HNPCs退变的影响。
1 材料与方法
1.1细胞、试剂与仪器 细胞:HNPCs购自赛百慷(上海)生物技术股份有限公司。主要试剂:DMEM购自美国Hyclone公司;胎牛血清购自美国Gibco公司;磷酸盐缓冲液(PBS)、胰蛋白酶、甲苯胺蓝染色液(1%)、牛血清白蛋白(BSA)封闭液(5%)、Triton X-100、抗荧光淬灭封片液(含DAPI)、噻唑蓝(MTT)溶液、RIPA裂解液、BCA蛋白浓度测定试剂盒均购自北京索莱宝科技有限公司;重组人IL-1β、TNF-α购自美国Pepro Tech公司;兔抗Ⅱ型胶原蛋白(Col Ⅱ)抗体、兔抗Notch4抗体、兔抗Hes5抗体、兔抗Hey1抗体、兔抗Hey2抗体、兔抗GAPDH抗体及二抗购自武汉贝茵莱生物技术有限公司;Trizol购自美国Ambion公司;SYBR FAST聚合酶链反应(PCR) Master Mix购自美国KAPA Biosystems公司;二甲基亚砜购自美国Sigma公司;膜联蛋白V异硫氰酸荧光素(AnnexinV-FITC)/碘化丙啶(PI)凋亡检测试剂盒购自美国BD公司;PVDF膜、化学发光试剂购自美国Millipore公司;PCR引物由武汉天一辉远生物科技股份有限公司合成。主要仪器:倒置荧光显微镜购自德国徕卡公司;荧光定量PCR仪购自美国Bio-Rad公司;高速冷冻离心机、酶标仪购自杭州奥盛仪器有限公司;流式细胞仪购自艾森生物(杭州)有限公司;全自动化学发光分析仪购自上海天能科技有限公司。
1.2细胞复苏与培养 将HNPCs从液氮罐中取出,37℃水浴至冻存液完全融化,将细胞悬液转移至离心管中,393 r/min离心3 min,弃上清。加入1 ml DMEM重悬细胞,转移至培养瓶中,再加入4 ml含10%胎牛血清的DMEM,放置于恒温培养箱(37℃,5% CO2)中培养。待80%以上的细胞汇合时进行传代,按照1∶2进行传代培养。
1.3髓核细胞退变模型构建〔9〕收集HNPCs,调整细胞密度制作单细胞悬液,并接种于12孔板中,每孔1 ml,约1×105个细胞/孔,培养过夜。将细胞分为对照组和模型组,对照组更换为正常培养基,模型组培养基中加入10 ng/ml IL-1β和25 ng/ml TNF-α,继续培养24、48 h。取出细胞培养板进行模型鉴定实验,根据鉴定结果筛选合适的诱导时间。
1.4甲苯胺蓝染色观察细胞内蛋白聚糖表达水平 采用20%的乙醇溶液稀释获得0.1%甲苯胺蓝染色液。弃细胞孔板中的培养液,PBS清洗后,加入1 ml 95%的乙醇溶液固定30 min。PBS清洗2次,加入1 ml甲苯胺蓝染色液染色10 min,PBS清洗2次后于显微镜下观察并拍照。
1.5免疫荧光染色观察细胞Col Ⅱ表达水平 取出各组细胞孔板,弃培养液,PBS清洗2次,加入1 ml 4%多聚甲醛室温固定30 min。PBS清洗2次,加入1 ml 0.5% Triton X-100室温通透20 min。PBS清洗2次,加入1 ml 5% BSA封闭液,室温封闭1 h。弃封闭液,加入Col Ⅱ抗体(1∶200稀释),4℃孵育过夜。PBS清洗2次,加入二抗(1∶200稀释),37℃孵育1 h。PBS清洗2次,加入300 μl抗荧光淬灭封片液(含DAPI),于荧光显微镜下观察并拍照。
1.6实时荧光定量(qRT)-PCR检测细胞中miR-147b-5p的表达 分别收集对照组和模型组细胞约1×106个,Trizol提取总RNA,然后反转录合成cDNA,以cDNA为模板进行PCR扩增,反应程序:95℃,3 min;95℃,5 s,56℃,10 s,72℃,25 s,共40个循环。引物序列:miR-147b-5p正义链:5′-GGGTGGAAACATTTCTG-3′,反义链:5′-AACTGGTGTCGTGGAGTCGGC-3′;U6正义链:5′-CTCGCTTCGGCAGCACA-3′,反义链:5′-AACGCTTCACGAATTTGCGT-3′。以U6为内参基因,采用2-ΔΔCt法计算细胞中miR-147b-5p的相对表达量。
1.7miR-147b-5p mimic及inhibitor瞬时转染细胞 收集退变的HNPCs,将其分为模型组、miR-147-5p mimic组、miR-147b-5p inhibitor组、mimic-NC组和inhibitor-NC组。转染前24 h,将5×105个细胞接种于2 ml培养基中,分布于6孔板,待细胞融合度达90%时进行转染。取100 pmol miR-147b-5p mimic或inhibitor(或对应的NC)稀释于250 μl Opti-MEM中,轻轻混匀。取5 μl Lipofectamine®RNAiMAX稀释于250 μl Opti-MEM中,轻轻混匀后静置5 min。将上述2种稀释液混合,室温孵育20 min。将混合液滴加于细胞培养板中,轻轻摇晃后置于培养箱中培养。转染4 h后更换新鲜培养基,培养24 h后检测各组细胞miR-147b-5p表达情况,检测实验同1.6。
1.8实验分组及处理 实验分为对照组、模型组、miR-147-5p mimic组、miR-147b-5p inhibitor组、mimic-NC组和inhibitor-NC组。对照组和模型组细胞正常培养,miR-147-5p mimic组、miR-147b-5p inhibitor组、mimic-NC组和inhibitor-NC组分别进行对应的转染实验,24 h后,除对照组继续正常培养外,其他5组均采用10 ng/ml IL-1β和25 ng/ml TNF-α诱导48 h构建髓核细胞退变模型。
1.9MTT法检测细胞活力 收集各组细胞,调整细胞悬液密度,分布于96孔板中,每孔100 μl,3×103个细胞/孔,于培养箱中培养过夜,待细胞贴壁。按照1.8分组处理,转染24 h,诱导48 h。取出培养板,每孔加入10 μl MTT溶液(5 mg/ml),培养4 h。弃上清,每孔加入150 μl二甲基亚砜,低速振荡10 min。酶标仪检测各孔于490 nm处的吸光值。
1.10流式检测细胞凋亡 收集各组约1×106个细胞(分组处理同1.8),400 r/min离心5 min。弃上清,加入1 ml PBS重悬细胞沉淀,400 r/min离心5 min。弃上清,加入200 μl PBS重悬,依次加入10 μl Annexin V-FITC和10 μl PI,轻轻混匀,4℃避光孵育30 min。加入300 μl PBS,于流式细胞仪中检测各组细胞凋亡水平。
1.11髓核细胞退变检测 收集各组细胞(分组处理同1.8),甲苯胺蓝染色观察细胞内蛋白聚糖表达实验操作同1.4,免疫荧光染色观察细胞Col Ⅱ表达实验操作同1.5节。
1.12Western印迹检测Notch4、Hes5、Hey1及Hey2蛋白表达水平 收集各组细胞(分组处理同1.8),按照每1×106个细胞加入200 μl裂解液的比例裂解细胞,提取细胞总蛋白。二喹啉甲酸(BCA)法测定蛋白浓度,以20 μg蛋白上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。采用湿转法将蛋白转移至聚偏氟乙烯(PVDF)膜上,室温封闭2 h。分别进行Notch4、Hes5、Hey1、Hey2及GAPDH抗体(稀释比均为1∶1 000)孵育,4℃过夜。PBS清洗后,进行二抗(1∶20 000稀释)孵育,室温1 h。PBS洗膜,滴加化学发光试剂,于全自动化学发光分析仪中检测,读取蛋白条带灰度值计算相对表达量。
1.13统计学处理 采用SPSS23.0软件进行t检验、单因素方差分析。
2 结 果
2.1髓核细胞退变模型鉴定 甲苯胺蓝染色结果(图1)显示,对照组正常髓核细胞多为类圆形或多角形,排列紧密,呈典型的集落样生长,细胞质内的蛋白聚糖被染成蓝色,细胞核呈圆形且深染;模型组细胞肿胀,细胞形态出现纺锤形,细胞质染色淡且不均匀,细胞核呈不规则形,符合髓核细胞退变时蛋白聚糖减少的特征。免疫荧光染色结果(图2)显示,对照组正常髓核细胞绿色荧光颗粒明显多于模型组,且细胞核染色更深,即退变髓核细胞中Col Ⅱ表达明显减少。由于48 h两组细胞间蛋白聚糖和Col Ⅱ表达差异比24 h的效果更好,因此本研究构建髓核细胞退变模型采用10 ng/ml IL-1β和25 ng/ml TNF-α诱导48 h。

图1 甲苯胺蓝染色观察HNPCs蛋白聚糖表达(×200)

图2 免疫荧光染色观察HNPCs Col Ⅱ表达(×200)
2.2髓核细胞中miR-147b-5p表达水平比较 与对照组(1.001±0.067)比较,模型组细胞中miR-147b-5p表达水平(0.320±0.05)明显降低(P<0.05)。说明髓核细胞退变时miR-147b-5p表达下调。
2.3转染效率检测 与模型组(1.003±0.094)比较,miR-147b-5p mimic组细胞中miR-147b-5p表达水平(3.005±0.106)显著上调,而miR-147b-5p inhibitor组(0.312±0.035)显著下调(均P<0.05);mimic-NC组和inhibitor-NC组(0.943±0.219、0.886±0.064)均无明显差异(P>0.05),证明本研究成功获得miR-147b-5p表达上调(或下调)的退变髓核细胞。
2.4miR-147b-5p对退变髓核细胞活力的影响 MTT检测各组HNPCs活力(OD值),与对照组(0.686±0.011)比较,模型组细胞活力(0.630±0.004)显著减弱(P<0.05);与模型组比较,miR-147b-5p mimic组细胞活力(0.664±0.012)显著增强,而miR-1476-5p inhibitor组细胞活力(0.602±0.008)显著减弱(P<0.05),mimic-NC组、inhibitor-NC组细胞活力(0.625±0.013、0.631±0.018)均无显著差异(P>0.05)。
2.5miR-147b-5p对退变髓核细胞凋亡的影响 流式检测各组HNPCs凋亡率,与对照组〔(5.337±0.577)%〕比较,模型组细胞凋亡率〔(7.423±0.267)%〕显著升高(P<0.05);与模型组比较,miR-147b-5p mimic组细胞凋亡率〔(5.017±0.548)%〕显著降低,miR-1476-5p inhibitor组细胞凋亡率〔(11.223±0.540)%〕显著升高(P<0.05);mimic-NC组及inhibitor-NC组〔(7.697±0.410)%、(8.030±0.046)%〕均无显著差异(均P>0.05)。见图3。

图3 流式检测每组HNPCs凋亡
2.6miR-147b-5p对退变髓核细胞蛋白聚糖及Col Ⅱ表达的影响 甲苯胺蓝染色结果及免疫荧光染色结果显示,模型组HNPCs中蛋白聚糖及Col Ⅱ表达明显少于对照组;与模型组相比,miR-147b-5p mimic组HNPCs中蛋白聚糖及Col Ⅱ表达明显增多,miR-147b-5p inhibitor组及inhibitor-NC组均明显减少。见图4、5。

图4 甲苯胺蓝染色观察各组HNPCs中蛋白聚糖的表达(×200)
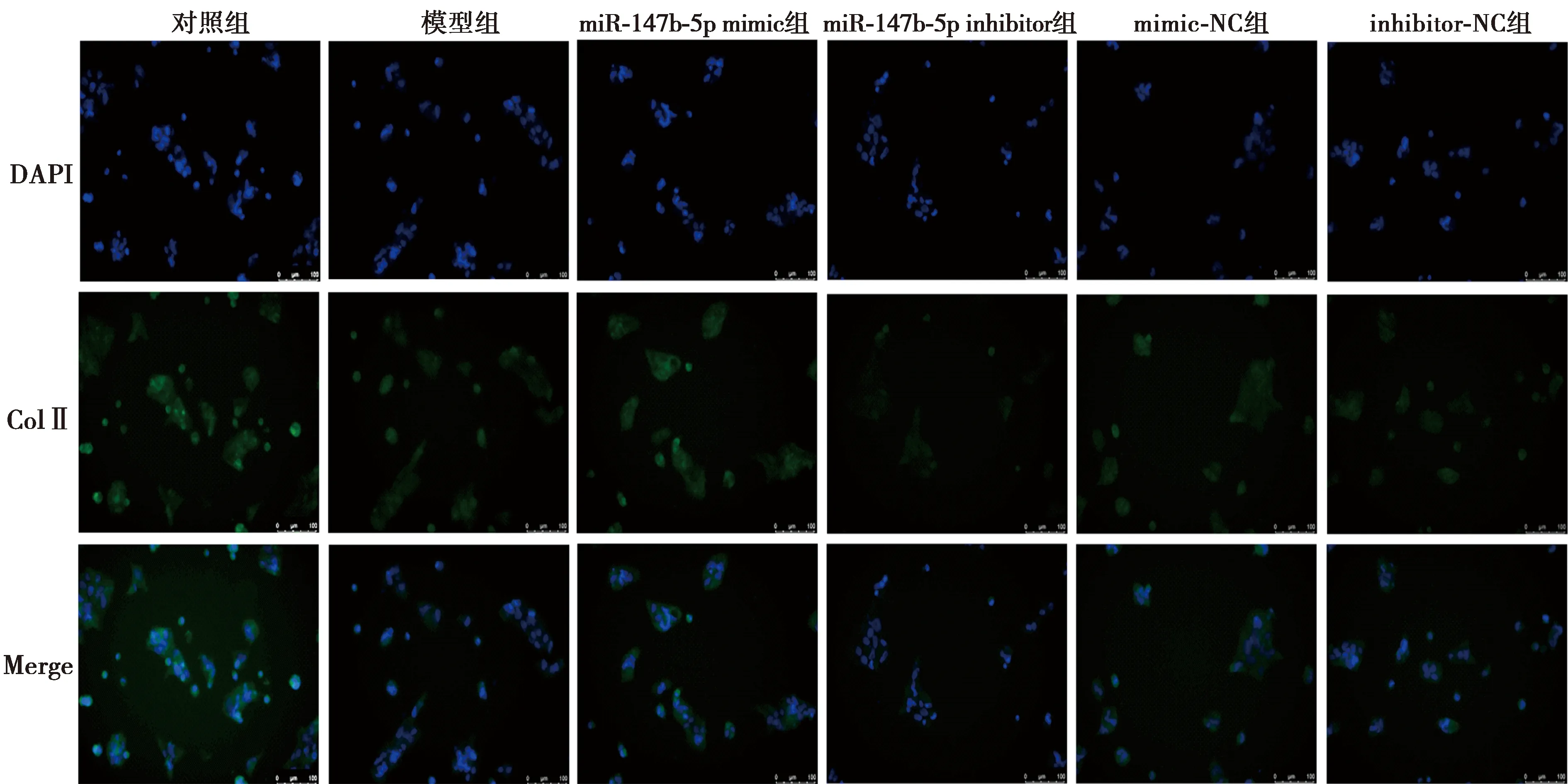
图5 免疫荧光染色观察各组HNPCs Col Ⅱ表达(×200)
2.7miR-147b-5p对退变髓核细胞中Notch信号通路相关蛋白表达的影响 与对照组比较,模型组细胞中Notch4、Hes5、Hey1及Hey2蛋白表达水平均显著升高(均P<0.01);与模型组比较,miR-147b-5p mimic组Notch4、Hes5、Hey1及Hey2蛋白表达显著减少(P<0.01),而miR-147b-5p inhibitor组各蛋白表达水平均显著升高(均P<0.01)。见表1、图6。

表1 HNPCs中Notch4、Hes5、Hey1及Hey2蛋白相对内参GAPDH蛋白的表达
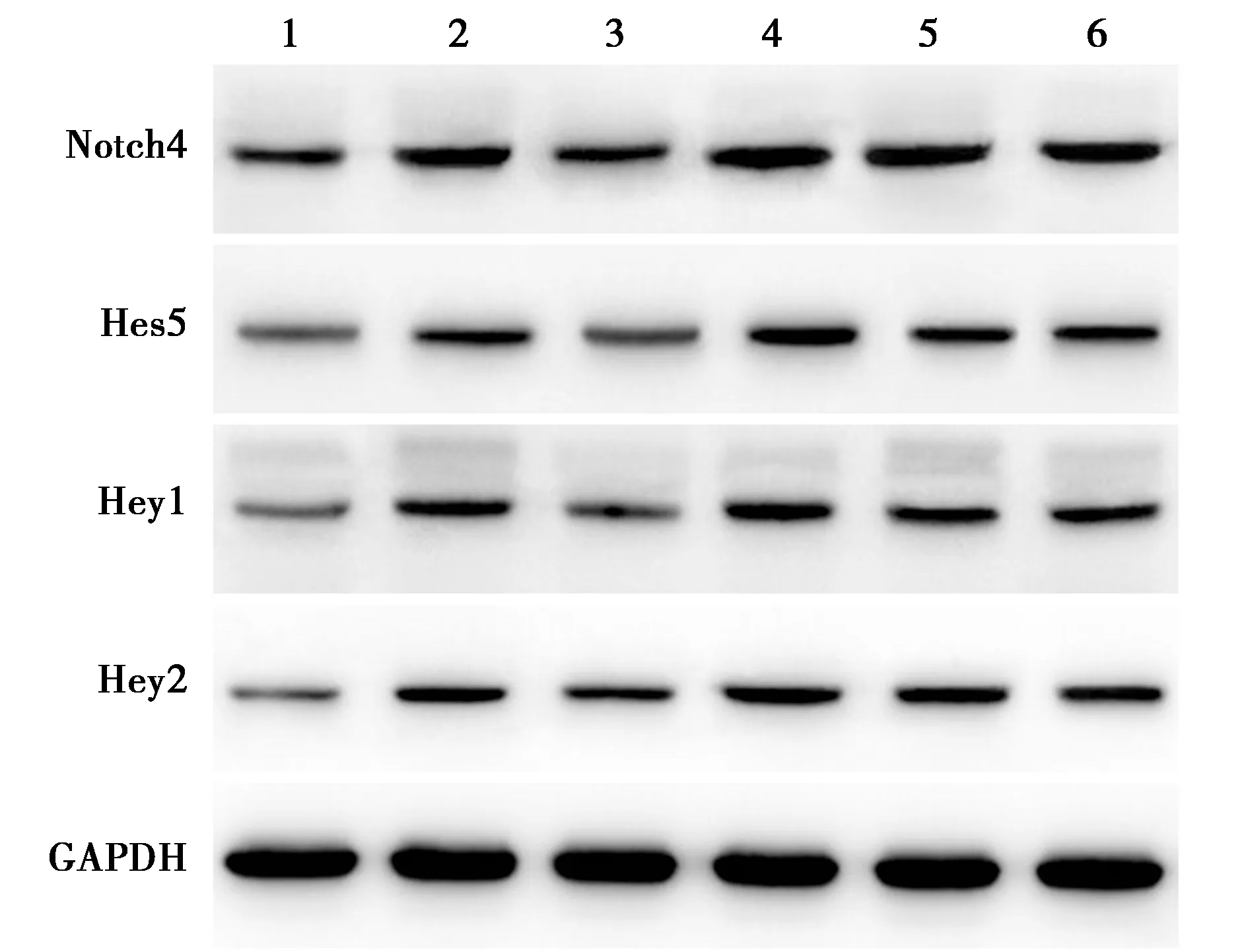
1~6:对照组、模型组、miR-147b-5p mimic组、miR-147b-5p inhibitor组、mimic-NC组、inhibitor-NC组图6 Western印迹检测HNPCs中Notch4、Hes5、Hey1及Hey2蛋白表达
3 讨 论
腰痛是一种常见的骨科疾病,研究证实椎间盘退变是引起腰痛的主要原因之一〔10〕。研究发现,椎间盘退变过程涉及椎间盘结构损伤和细胞数量及组成发生改变等〔11〕。髓核的结构和生化成分发生改变,蛋白聚糖、水分含量的下降致使椎间盘承载能力降低,胶原成分的改变及含量下降导致其弹性逐渐丧失,即为椎间盘髓核退变的过程〔12〕。本研究发现细胞中蛋白聚糖及Col Ⅱ表达均降低,符合髓核细胞退变的病理特征〔13,14〕,即本研究成功诱导了髓核细胞退变模型。目前,针对椎间盘退变的治疗方法仍以保守治疗和手术治疗为主,可缓解症状,然而并未对椎间盘退变进行病因治疗〔12〕。对退变的髓核细胞进行生物学再生修复方案,如基因治疗、细胞治疗、生长因子注射治疗等〔15〕,将为椎间盘退变的治疗提供更多可能。miRNA通过靶向mRNA调节基因的表达,参与了多种病理生理过程,包括退行性肌肉骨骼病理〔16〕。有研究发现〔17〕,miR-202-5p在退行性髓核细胞中低表达,抑制miR-202-5p表达可增加自噬相关蛋白的表达,促进退变髓核细胞的自噬及凋亡。Chen等〔18〕也认为椎间盘退行性病变与miRNA的调节异常有关,并发现miR-24-3p在退行性髓核细胞中表达水平升高,且其表达与椎间盘退变的程度呈正相关,可诱导髓核细胞凋亡。
Notch信号通路是一条高度保守的信号转导途径,包括4个家族成员(Notch1,2,3,4),调节多种致病过程,其调控作用对骨骼发育代谢具有重大的意义,同时,Notch信号通路在退变髓核细胞的修复重建中也扮演着重要角色〔7〕。当促炎细胞因子介导髓核细胞退变时,髓核细胞发生代偿机制,Notch信号通路被激活促进细胞增殖从而补偿退变丧失的细胞数量〔8〕。但也有研究发现抑制Notch1基因的表达可促进间充质干细胞转化为髓核样细胞中蛋白聚糖及Col Ⅱ的表达,认为对Notch1基因表达进行抑制可提高椎间盘髓核细胞的生物活性〔19〕。本研究结果显示,上调退变髓核细胞中miR-147b-5p表达,可抑制Notch4及其靶基因Hes5、Hey1和Hey2〔20〕表达。结合本次研究结果及上述研究,可推测炎性细胞因子引起的Notch信号通路激活在退变髓核细胞中的代偿机制具有一定的限度,也可能是由于miR-147b-5p并不是通过Notch信号通路维持退变髓核细胞的数量及生物活性。
综上,miR-147b-5p在退变髓核细胞中表达降低,增加其表达水平可恢复退变髓核细胞的生物学活性,但其具体作用机制是否与Notch信号通路相关还有待进一步验证。
