钛石膏综合利用及硫钙分离新工艺研究
2022-07-11周骏宏杨钰钧潘春瑛
马 磊,盛 余,周骏宏,杨钰钧,罗 辉,潘春瑛,王 果
(1.黔南民族师范学院,贵州都匀 558000;2.贵州胜威福全化工有限公司)
钛白粉生产过程副产的钛石膏、磷化工副产的磷石膏、含硫尾气副产的脱硫石膏合称“三石膏”[1]。由于“三石膏”中杂质含量较高,加上现有的技术手段不足,导致了工业副产石膏利用率很低而长期堆存成为严重的环境问题。钛石膏因含有Fe等杂质,又被称为红石膏,一般生产1 t 钛白粉就会产生6~10 t钛石膏[2]。随着中国硫酸法钛白粉产量的增加,钛石膏的堆积量也不断增大、加剧恶化。因此,加大科研创新力度,促进钛石膏的资源化、绿色化、减量化和循环化回收利用,实现工业和环境的和谐发展,具有重大意义。
钛石膏由于含有较高的铁(例如贵州胜威公司Fe2O3质量分数为11.3%)而呈现颜色较深的红棕色,比“三石膏”中另外两种石膏颜色更红(一般脱硫石膏较白、磷石膏次之为灰白)而影响钛石膏的利用。目前,钛石膏主要应用渠道有3类:1)不需要特别处理可以直接作添加剂少量使用(如用于水泥缓凝剂、石膏建材、复合胶结材料、路基回填材料、土壤改良剂等)[3-7];2)采用碳作为还原剂高温分解硫酸钙制取硫酸联产水泥[8];3)采用化学净化法脱杂提纯,提高硫酸钙纯度、消除杂质元素后作纯净物使用[9]。
由于钛石膏杂质含量高而品质很差,无法达到建筑石膏质量要求仅能少量添加使用,而采用化学处理方法对钛石膏进行分离提纯,对提高钛石膏的利用率应该更为有效。对此,笔者通过实验研究,提出一种全新的钛石膏化学转化法,反应条件温和、全溶液状态转化、无高温煅烧、无尾气排放、钙元素和铁元素能够分离完全,能获得纯净的碳酸钙和硫酸铵产品。
1 试验部分
1.1 试验原料
钛石膏取自贵州胜威福全化工有限公司生产车间,采用XRF对其主要成分进行检测,结果见表1。

表1 钛石膏化学组成Table 1 Chemical composition of titanium gypsum %
1.2 试验流程
钛石膏转化制取碳酸钙的工艺流程图见图1。
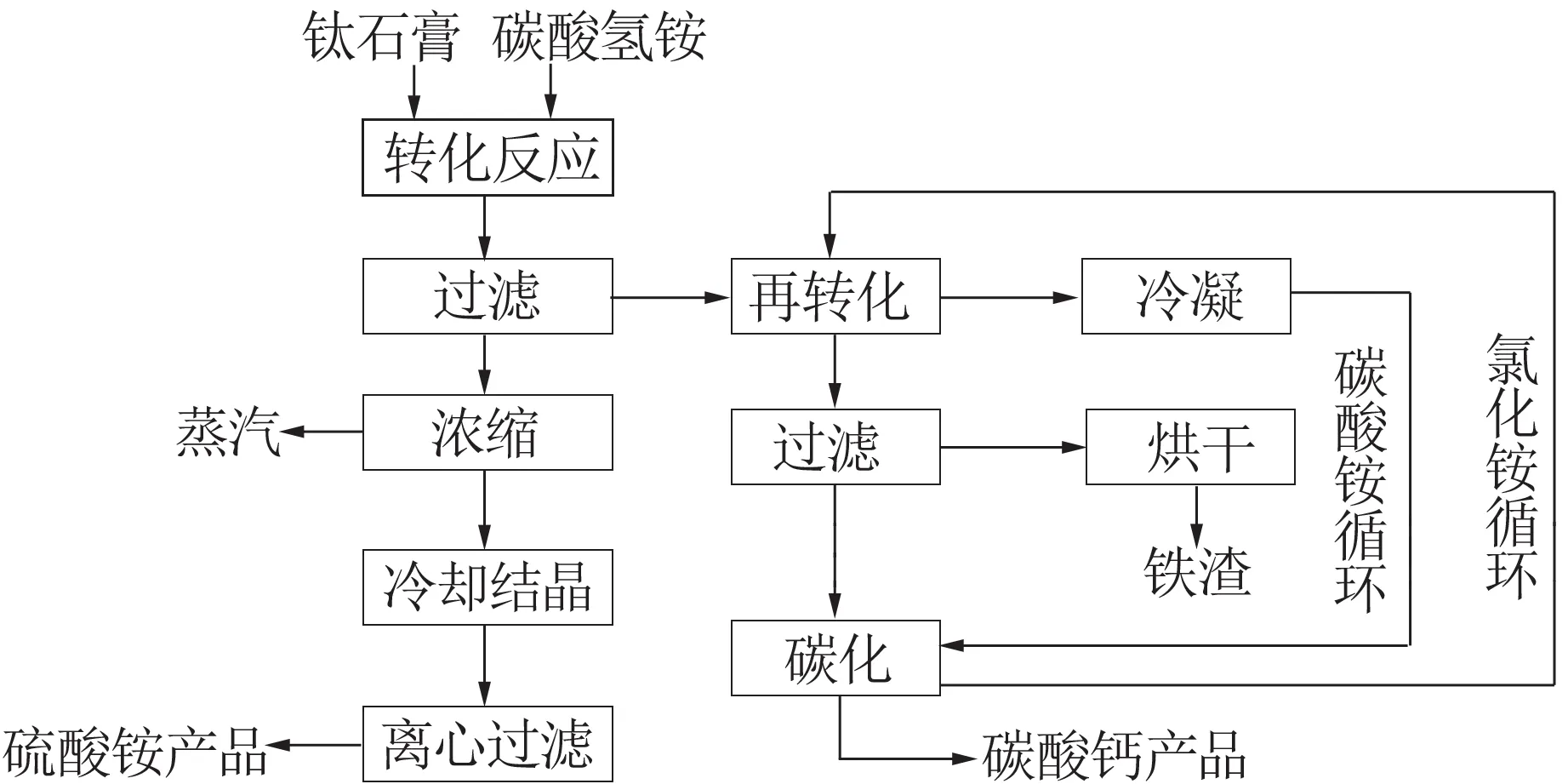
图1 钛石膏制取碳酸钙和硫酸铵、铁渣的工艺流程Fig.1 Process flow of preparation of calcium carbonate,ammonium sulfate and iron slag from titanium gypsum
1.3 仪器药品
仪器:恒温磁力搅拌器、磁力电加热套、电子天平、恒温干燥箱、循环水真空泵、X 射线荧光光谱仪(PANalytical Axios)、X 射线粉末衍射仪(BrukerAXS D8)、扫描电镜(TESCAN MIRA4)、电感耦合等离子体发射光谱仪(安捷伦5110)。
药品:碳酸氢铵(AR)、钛石膏、氯化铵(AR)。
1.4 实验步骤
首先向烧杯中加入计量的碳酸氢铵以及一定量的水,将烧杯置于恒温磁力搅拌器中,当温度达到预设温度后,开启搅拌,逐渐加入钛石膏,反应一定时间后进行抽滤,并洗涤滤饼,滤液浓缩并烘干得到硫酸铵。滤饼烘干后加入圆底烧瓶中,再加入一定量的水和氯化铵,加热沸腾并回收升华逸出的碳酸铵,反应结束后抽滤,往滤液中加入回收的碳酸铵,析出碳酸钙沉淀,再次抽滤并烘干滤渣。
2 试验结果及讨论
2.1 第一步转化反应——硫酸钙转化为碳酸钙
2.1.1 反应时间的影响
钛石膏与碳酸氢铵的反应为多相反应,反应原料为不溶于水的石膏,产物碳酸钙也不溶于水,反应方程式如下:
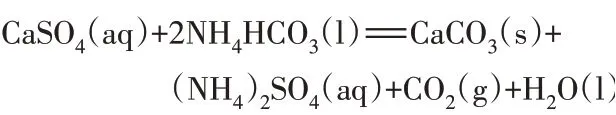
为了研究该多相反应,将碳酸氢铵加入到水中并加热到65 ℃,钛石膏用量固定为16.5 g、碳酸氢铵固定为27.5 g,改变反应时间,即改变钛石膏与碳酸氢铵的反应时间,探究其对转化率的影响,并采用XRF 检测产物组成变化情况(下同),结果如表2 所示。由表2可以看出,固定反应物料配比和温度,随着反应时间达到0.5 h,钛石膏与碳酸氢铵的反应转化率就高达92.02%,继续延长反应时间,转化率略有增长,最高的转化率为95.69%。可见,采用碳酸氢铵还是很容易与硫酸钙发生反应,能轻松转化为碳酸钙,可以省掉先加氨水把碳酸氢铵转化为碳酸铵的步骤。对于本转化反应,碳酸氢铵每100 g可转化为60.8 g 的碳酸铵,也就是说使用碳酸氢铵会比用碳酸铵的消耗增加,但是碳酸氢铵的价格远低于碳酸铵,成本仍然低于使用碳酸铵,所以碳酸氢铵具有较好的优势。

表2 反应时间对钛石膏与碳酸氢铵转化率的影响Table 2 Effect of reaction time on conversion rate of titanigypsum and ammonium bicarbonate
2.1.2 物料配比
钛石膏与碳酸氢铵的物料配比对钛石膏的转化率有着重要的影响,为了解钛石膏的转化率增大与碳酸氢铵过量情况的关系,试验固定钛石膏用量为16.5 g、反应温度为65 ℃、反应时间为1.25 h,改变不同的碳酸氢铵用量进行转化反应。试验结果见表3。由表3可知,在反应时间为1.25 h、反应温度为65 ℃时,碳酸氢铵实际用量比理论用量高出1.85%后,钛石膏转化为碳酸钙的转化率相对较高,转化率达到了93.31%。

表3 碳酸氢铵和钛石膏不同配比对反应的影响Table 3 Effect of different proportions of ammonium bicarbonate and titanium gypsum on the reaction
2.1.3 反应温度
为了解温度对钛石膏与碳酸氢铵的反应速率的影响,试验固定钛石膏用量为16.5 g、碳酸氢铵用量为27.5 g、反应时间为1 h,改变不同的反应温度进行反应,反应结束后抽滤并烘干滤渣,测定产物的硫组分含量[以w(SO3)计],计算转化率,结果见表4。由表4 可知,反应温度为45~65 ℃时,钛石膏的转化率最大,再升高温度后钛石膏转化率反而降低。
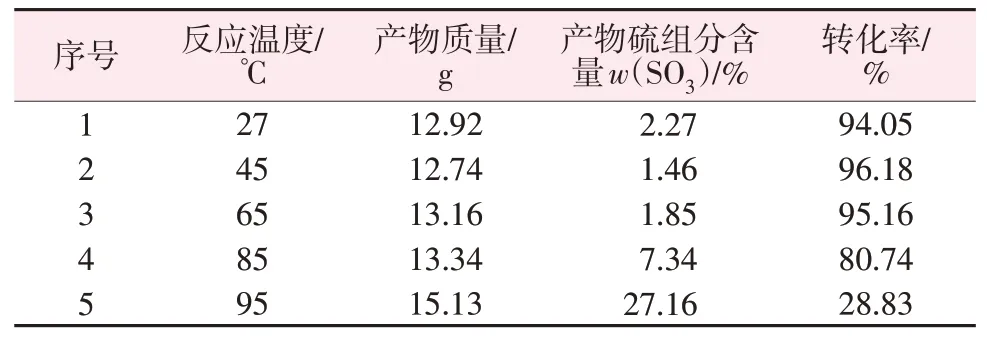
表4 反应温度对钛石膏与碳酸氢铵反应的影响Table 4 Effect of reaction temperature on the reaction of titanium gypsum with ammonium bicarbonate
2.2 第二次转化反应——碳酸钙转化为氯化钙
2.2.1 转化时间的影响
取经过第一次转化反应(反应时间为1 h、反应温度为65 ℃、钛石膏与碳酸氢铵的质量比为16.5∶27.5)的产物14 g,加入15 g氯化铵、150 mL水,固定反应温度为65 ℃,选择不同的反应时间进行第二次转化反应,反应结束后抽滤并烘干滤渣,结果见表5。由表5 可知,在其他条件不变的情况下,由第一步反应生成的碳酸钙与氯化铵进行的第二次转化反应,其转化率受转化反应时间影响较大,当反应时间为1 h时,仅转化35.86%,反应时间增加到5 h,转化率达到95.36%,说明5 h基本转化完全。
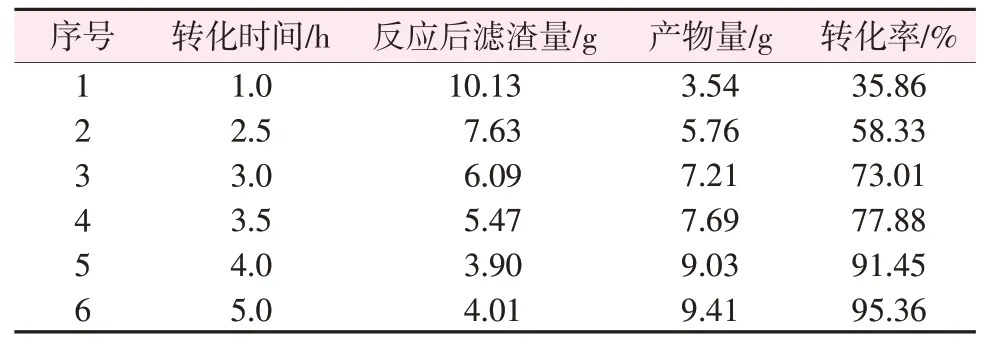
表5 转化时间对碳酸钙转化率的影响Table 5 Effect of transformation time on calcium carbonate transformation
2.2.2 鼓空气的影响
由于碳酸钙转化为氯化钙的反应中必须采取手段使反应产物碳酸铵脱离反应体系,减少液相中碳酸铵的存在,从而推动反应平衡不断向正反应方向移动,提高反应转化率,否则该反应极难发生。实验中采取的手段是加热沸腾,使液体达到沸腾状态,使碳酸铵挥发脱离液相体系。但是长时间的沸腾需要的能耗大,为探究在低于沸点下如何提高反应转化率,实验采用了鼓入空气的方式。取经过第一次转化后的产物每组15 g,加入16 g 氯化铵、250 mL 水,分别加热到55、65、75、85 ℃,在鼓入空气1 h后进行反应,反应完成后抽滤,实验结果见表6。由表6 可知,低于沸点的条件下,如85 ℃时,不鼓空气的转化率很低,仅有6.8%,而鼓入空气这组的转化率上升到46.51%,可见鼓空气的效果明显。

表6 不同温度下鼓入空气对碳酸钙转化率的影响Table 6 Effect of air injection on calcium carbonate transformation at different temperature
同时,在鼓入空气的情况下,随着温度的上升,转化率从55 ℃的13.23%,上升到85 ℃的46.51%,说明温度对该转化反应影响很大。
2.3 产物的检测结果
钛石膏与碳酸氢铵完成第一次转化后获得的中间产物的X 射线衍射谱图如图2 所示。从图2 可以看出,原始钛石膏的XRD 谱图中衍射峰仅见二水硫酸钙的特征峰,2θ为11.696°,衍射峰强度达到57 345 cps;转化后的产物以碳酸钙衍射峰为主,2θ为29.562°,强度为2 169 cps,二水硫酸钙强度大幅降低到520 cps,峰强仅为原来的0.9%。经拟合,可计算出转化后产物的碳酸钙相占94%,二水硫酸钙相占6%。
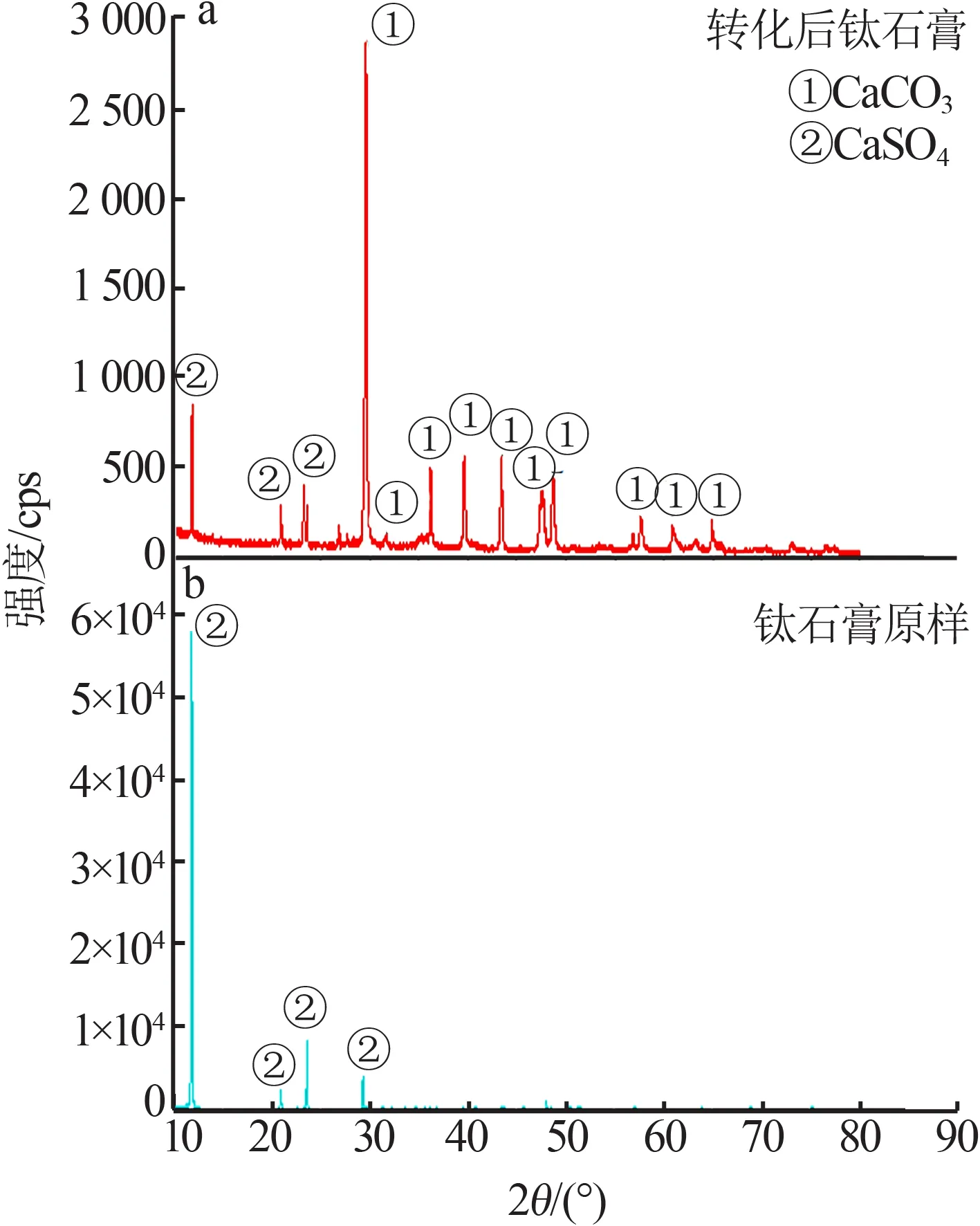
图2 钛石膏与碳酸氢铵反应转化前后XRD谱图Fig.2 XRD patterns of titanium gypsum and ammonium bicarbonate before and after conversion
同时对该第一次转化反应副产的硫酸铵进行测定(硫酸根采用重量法,其他采用ICP 法),结果见表7。

表7 产品硫酸铵组成Table 7 Composition of the ammonium sulfate products %
第一次反应形成的中间产物,以碳酸钙为主要成分,同时混有未反应物以及杂质等;再进行第二次转化,固态钙转化为可溶性的氯化钙溶于水中,过滤后与不溶物铁渣等分离,滤液氯化钙溶液再与碳酸铵反应,形成碳酸钙沉淀,过滤烘干即为最终的碳酸钙产品,白度达96.47%,化学组成采用XRF检测,结果见表8。同时对该产品进行粒度测定,结果见图3。
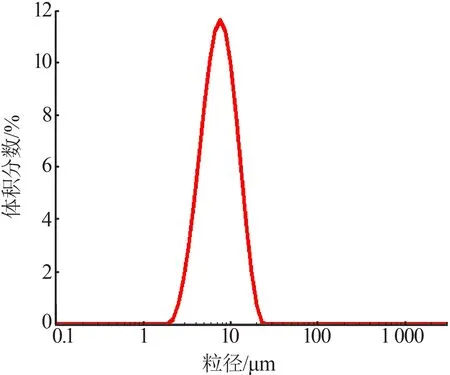
图3 产品碳酸钙粒度分布图Fig.3 Particle size distribution of calcium carbonate products

表8 产品碳酸钙组成Table 8 Composition of the calcium carbonate products %
经过测量产品碳酸钙的粒径,d(10)为3.767µm、d(50)为6.885µm、d(90)为12.107µm。
此外,对产物碳酸钙进行X射线粉末衍射分析,结果见图4。由图4可见,生成的碳酸钙产物可见球形的球霰石物相,2θ为27.29°,强度为632 cps;另外也可见方解石构型的衍射峰,2θ为29.487°,强度为934 cps。通过拟合可算出两相中球霰石相占75.6%,方解石相占24.4%。最终产品SEM照片见图5。说明在本工艺条件下制得的碳酸钙为球霰石和方解石两种物相共存。另外对不参与反应的铁渣也进行XRF检测,结果见表9。

表9 产品铁渣组成Table 9 Composition of the iron slag products %

图4 最终产品碳酸钙XRD谱图Fig.4 XRD pattern of the final product calcium carbonate

图5 最终产品碳酸钙SEM照片Fig.5 SEM images of the final calcium carbonate products
3 结论
1)钛石膏中硫酸钙和碳酸氢铵的反应比较容易进行,0.5 h 即有92.02%的硫酸钙转化为碳酸钙,随着时间的延长,反应转化率还会升高,最高的反应转化率可达95.69%。
2)碳酸氢铵用量对碳酸氢铵与钛石膏的反应转化率也有影响,当碳酸氢铵的实际用量达到理论用量后,转化率即可达到93.31%(略微过量1.85%),增加过量率,转化率也会升高,本实验条件下,转化率最高为95.16%(过量1.04倍)。
3)向钛石膏中硫酸钙和碳酸氢铵的转化反应形成的中间产物中继续加入氯化铵进行第二次转化,使不溶性的钙变为可溶性的氯化钙。第二次转化反应的反应时间对转化率的影响较大,其他条件不变的情况下,经过1 h 的转化,转化率达到35.86%,随着转化反应时间的增加,转化率显著增大,转化时间为5 h时,转化率达到95.36%。
4)实验还探究了低于沸点下鼓入空气实验。固定经过第一次转化的产物用量为15 g、氯化铵用量为16 g、反应时间为1 h,在反应温度为85 ℃情况下,不鼓空气时的转化率仅为6.8%,鼓空气的转化率升高到46.51%;在鼓空气的情况下,分别采用55~85 ℃的反应温度,结果发现,随着反应温度的升高,转化率从55 ℃的13.23%升高到85 ℃的46.51%。
5)经过转化后,获得纯度很好的产品碳酸钙,白度达到96.47%,碳酸钙质量分数达到98.3%,所得碳酸钙产物有方解石和球霰石两种物相共存;同时获得富集铁以后的铁渣,质量分数达到61.5%,并获得副产品硫酸铵。
6)本技术路线先进合理、转化率高、反应条件温和、全溶液状态转化、无高温煅烧、无尾气排放,钙元素和铁元素能够分离完全,获得纯净的碳酸钙和硫酸铵产品。本技术还具有一定的柔性生产能力,当市场变动较大时,如碳酸氢铵/氯化铵价格波动幅度过大,或者碳酸钙/氯化钙价格波动幅度过大,可以调整产品方案,以氯化铵代替碳酸氢铵为原料,制取氯化钙代替碳酸钙为产品。
