结晶法提纯钛白副产硫酸亚铁中杂质去除规律的研究
2022-07-11朱莞烨池荷婷廖祥辉庄荣传王乾坤沈青峰
朱莞烨,唐 定,池荷婷,廖祥辉,庄荣传,王乾坤,沈青峰
(1.低品位难处理黄金资源综合利用国家重点实验室,福建上杭 364200;2.厦门紫金矿冶技术有限公司)
中国是钛白粉生产大国,且大多数企业采用硫酸法生产钛白粉,该生产过程中会产生大量的工业副产物硫酸亚铁(俗称绿矾,FeSO4·7H2O),其中含有一定数量的钛(Ti)、镁(Mg)、锰(Mn)等杂质,因而无法直接被利用[1-2]。目前,钛白副产硫酸亚铁的资源化利用方式包括净水剂、氧化铁颜料、媒染剂、消毒剂等的生产[3-7],同时将其作为铁源用于锂离子电池正极材料磷酸铁锂(LiFePO4)的合成已成为一个热点研发方向[8]。
由于钛白副产硫酸亚铁的纯度较低,杂质含量高,必须首先对其进行提纯处理,否则会对后续LiFePO4正极材料的比容量和循环性能产生非常大的影响[9-12]。目前,钛白副产硫酸亚铁提纯工艺大致包括溶解、除杂、重结晶等步骤[12-14],文献[15]中采用还原剂还原三价铁,经过硫化亚铁除钴、镍、锌、铜、铅、镉等重金属,氟化物除钙、镁等除杂工序得到净化的硫酸亚铁溶液,再进行结晶得到电池级七水硫酸亚铁晶体。该工艺流程较长,同时使用的除杂药剂会引入新的杂质元素(如F),可能会对结晶提纯硫酸亚铁带来新的影响。张克宇等[16]采用直接溶解钛白副产硫酸亚铁后进行结晶提纯,结果表明结晶法可以有效去除杂质,达到提纯硫酸亚铁的目的。但是,该研究以GB/T 664—2011《化学试剂七水合硫酸亚铁》为参照,Mg、Mn 等杂质去除标准相对偏低。此外,该研究对钛白副产硫酸亚铁中主要杂质Ti 没有进行考虑与研究。针对钛白副产硫酸亚铁中主要杂质Ti、Mg和Mn,探究它们在结晶过程中的去除规律,可以为建立高效的结晶提纯工艺提供一定的指导。
本论文采用水解除Ti 再冷冻结晶的工艺进行钛白副产硫酸亚铁提纯,重点研究分析了结晶母液循环利用中Mg、Mn 杂质的累积情况以及它们的去除规律,并对可能引入到体系的Na 杂质对FeSO4·7H2O晶体质量的影响进行了研究。
1 实验部分
1.1 原料、试剂与仪器
原料和试剂:某企业钛白副产硫酸亚铁、还原铁粉(分析纯)、碳酸钠(分析纯)、二次去离子水。
仪器:JJ-1 精密增力电动搅拌器;HH-1恒温水浴锅;Five Easy Plus pH 计;GDH-1006低温恒温槽;TD-5G 台式过滤离心机;DZF-6050 真空干燥箱;SPECTRO GREEN SOP 电感耦合等离子体发射光谱仪(ICP-OES)。
1.2 实验方法
结晶法提纯钛白副产硫酸亚铁的工艺流程如图1所示。首先,按照40 ℃下饱和溶解度(73.3 g)称取钛白副产硫酸亚铁,在50 ℃下溶解于去离子水中。加入铁粉搅拌反应,当溶液pH升至设定值后水解除钛反应1 h,趁热过滤后得到结晶液。将结晶液置于低温恒温槽内进行冷冻结晶,经离心过滤得到一次结晶体和一次结晶母液。一次结晶体又以相同饱和状态溶解于去离子水后进行二次冷冻结晶,得到二次结晶体和二次结晶母液。同样,进行三次冷冻结晶得到FeSO4·7H2O晶体和三次结晶母液。3次冷冻结晶温度均控制为4 ℃,完成上述3次冷冻结晶后即为完成第一次重结晶。为了考察杂质的累积影响,将结晶母液进行循环利用,具体为上述一、二和三次结晶母液分别用于下一次重结晶中钛白副产硫酸亚铁水解除Ti、一次结晶体和二次结晶体的溶解,同上述步骤进行完整的第二次和第三次重结晶循环。
本实验中,溶液试样和固体试样成分分析均采用ICP-OES进行测试。
2 结果与讨论
表1列出了某企业钛白副产硫酸亚铁的成分分析结果以及某企业电池用高纯七水硫酸亚铁晶体产品标准的杂质含量要求。由表1 可以看出,钛白副产硫酸亚铁中的主要杂质元素为Ti、Mg、Mn,而其他杂质元素含量均低于电池用七水硫酸亚铁晶体的要求。因此,本实验将主要研究Ti、Mg、Mn 3种杂质元素的去除。

表1 钛白副产硫酸亚铁的成分分析结果以及电池用七水硫酸亚铁晶体的杂质含量要求Table 1 Composition analysis results of ferrous sulfate of titanium dioxide by-product and requirementsfor impurity content of FeSO4·7H2O crystal for battery %
2.1 水解除Ti
Ti 主要以硫酸氧钛(TiOSO4)形式存在,在热水中易发生水解生成白色难溶物(式1),因而开展结晶实验前需要进行水解除Ti。钛白副产硫酸亚铁溶于水后,溶液pH 在2.3 左右。通过加入Fe 粉,消耗溶液中的氢离子(式2),提高溶液pH从而达到水解除Ti目的。同时,Fe粉还可以还原钛白副产硫酸亚铁中存在的三价铁离子(式3),降低铁的损失率。此外,利用Fe 粉调节pH 除Ti 不会向体系内引入新的杂质元素[13]。
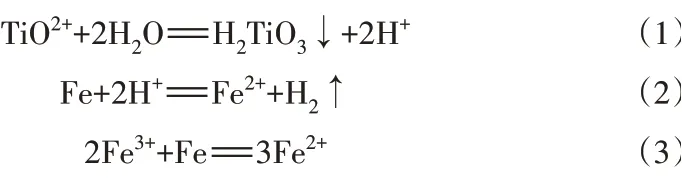
表2为利用Fe 粉调节不同pH 水解除Ti 前、后溶液中元素分析结果。在pH=3.0时,Ti的去除率为85.35%;当pH大于4.0时,Ti的去除率达到99.9%以上。但是,随着pH的升高,Fe损失率明显增高。综合考虑,本实验中水解除Ti时pH调节为4.0。另外,由于Mg、Mn 水解pH 较高,因此该过程中Mg 和Mn不能被除掉。
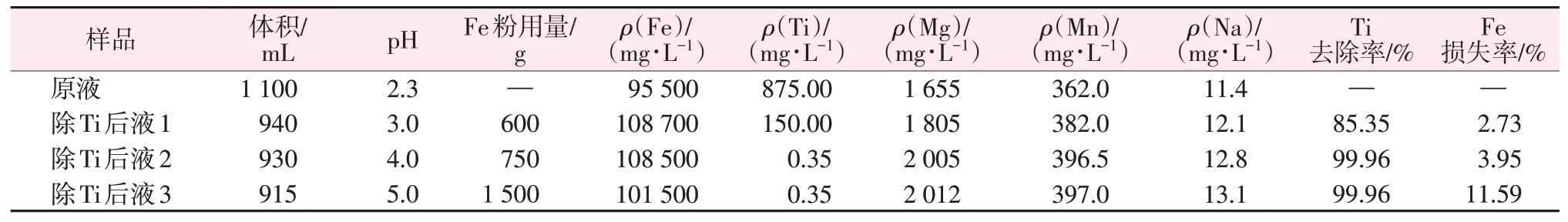
表2 不同pH下水解除Ti前、后溶液中的元素含量分析结果Table 2 Analysis results of element content in solution before and after Ti removal by hydrolysis with different pH
2.2 结晶过程
根据不同温度下硫酸亚铁在水中溶解度情况,结晶液温度控制在0~10 ℃时,可以得到大量的FeSO4·7H2O晶体[17]。本实验中,硫酸亚铁结晶温度设定为4 ℃。
2.2.1 结晶液pH影响
表3对比了不同结晶液pH 条件下FeSO4·7H2O晶体中Mg、Mn 含量情况。由表3 可以看出,降低结晶液的pH,Mg、Mn 杂质的含量略有下降,这与文献报道的结果相一致[13]。另外,实验中发现当结晶液pH=4.0 时,Fe2+很容易被氧化,逐渐生成Fe(OH)3沉淀,致使结晶液变浑浊。因此,本实验中均将结晶液pH用H2SO4调至2.0后再进行冷冻结晶。
表3 不同结晶液pH下FeSO4·7H2O晶体中Mg、Mn杂质含量Table 3 Content of Mg and Mn in FeSO4·7H2O crystal under different pH of solution
2.2.2 Mg、Mn累积规律
由于除Ti后结晶液中主要的杂质为Mg、Mn,掌握冷冻结晶过程中Mg、Mn 杂质的累积情况和去除规律,可以为利用结晶法提纯制备电池级硫酸亚铁晶体提供一定的理论和技术指导。
本实验中通过结晶母液循环,开展了3 次重结晶且每次重结晶中进行3 次结晶,得到总共9 种FeSO4·7H2O晶体,所有晶体均经少量纯水洗涤后风干[18]。图2 给出了FeSO4·7H2O 晶体中Mg、Mn 杂质含量变化情况。每个循环中,通过重结晶可以逐渐降低FeSO4·7H2O 晶体中的Mg、Mn 杂质含量。另外,可以看出一次结晶母液的循环会导致后续循环中对应相同结晶次数得到的FeSO4·7H2O 晶体中Mg、Mn杂质逐渐升高,这是由于溶液中Mg、Mn杂质含量逐渐得到富集引起的。
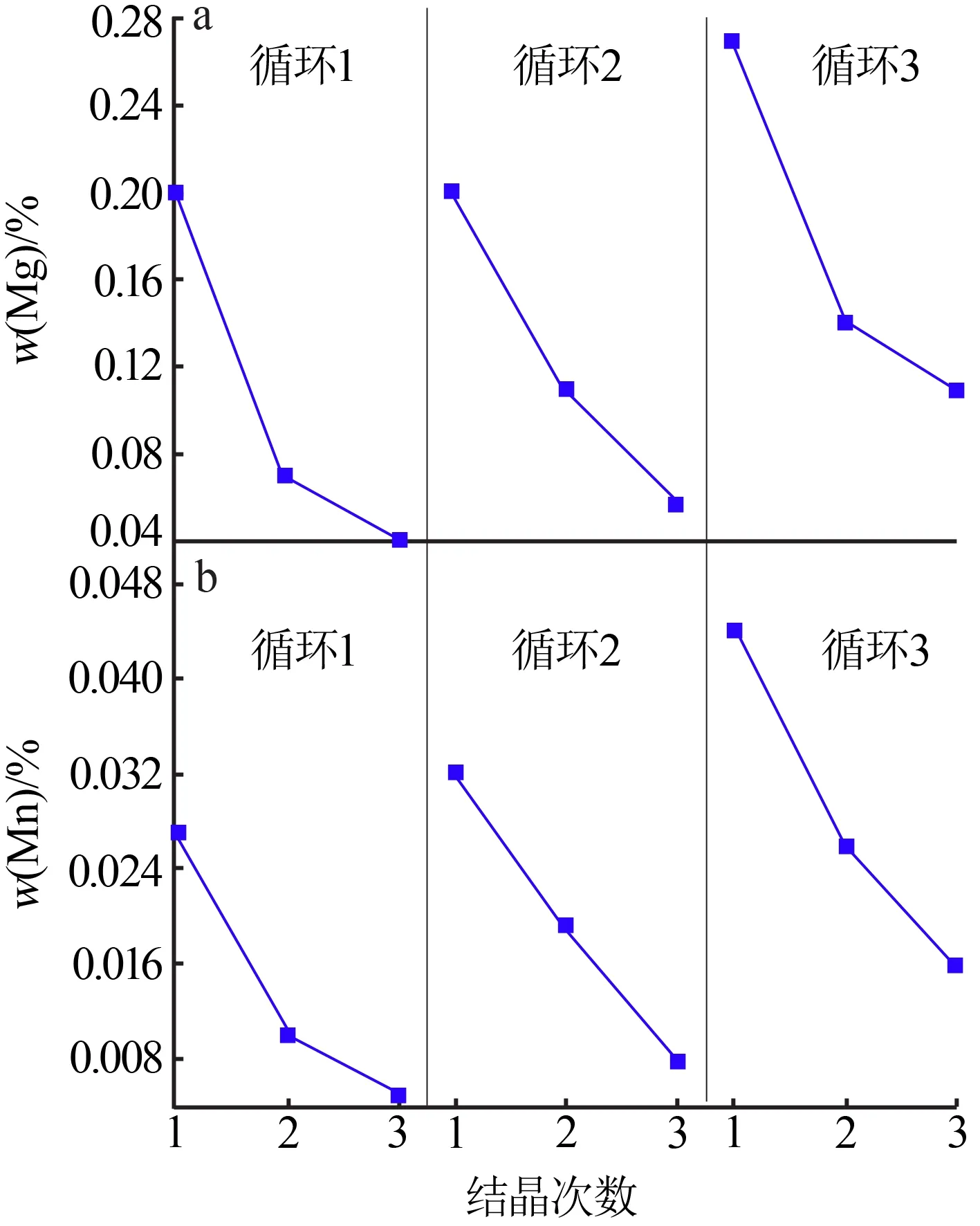
图2 结晶次数和循环次数对FeSO4·7H2O晶体中Mg、Mn杂质含量的影响Fig.2 Effect of crystal crystallization times and cycle times on the content of Mg and Mn impurities in FeSO4·7H2O crystal
与表1中某企业电池用高纯七水硫酸亚铁晶体产品标准对比,第一个循环中的第三次结晶得到的FeSO4·7H2O 晶体中Mg 杂质含量仍然超标,需继续增加结晶次数来进一步降低Mg 含量。也可以从另一个角度说,由于结晶液中初始Mg 含量太高,导致难以通过3 次结晶降低Mg 杂质质量分数至低于0.025%。对于Mn杂质而言,结晶液中初始Mn含量为396.5 mg/L(见表2),经3 次母液循环后累积至675 mg/L,在此条件下得到的FeSO4·7H2O晶体中Mn杂质质量分数仍可低于0.05%。
利用结晶液与结晶体中Mg、Mn 含量的关系曲线,可以推断出得到电池用高纯七水硫酸亚铁时结晶液中Mg、Mn 含量的最大允许值(见图3)。根据拟合公式可以推算得到:当结晶液中Mg 含量低于298 mg/L 时,得到的FeSO4·7H2O 晶体中Mg 质量分数将低于0.025%;当结晶液中Mn含量高于761 mg/L时,得到的FeSO4·7H2O 晶体中Mn 质量分数将高于0.05%。
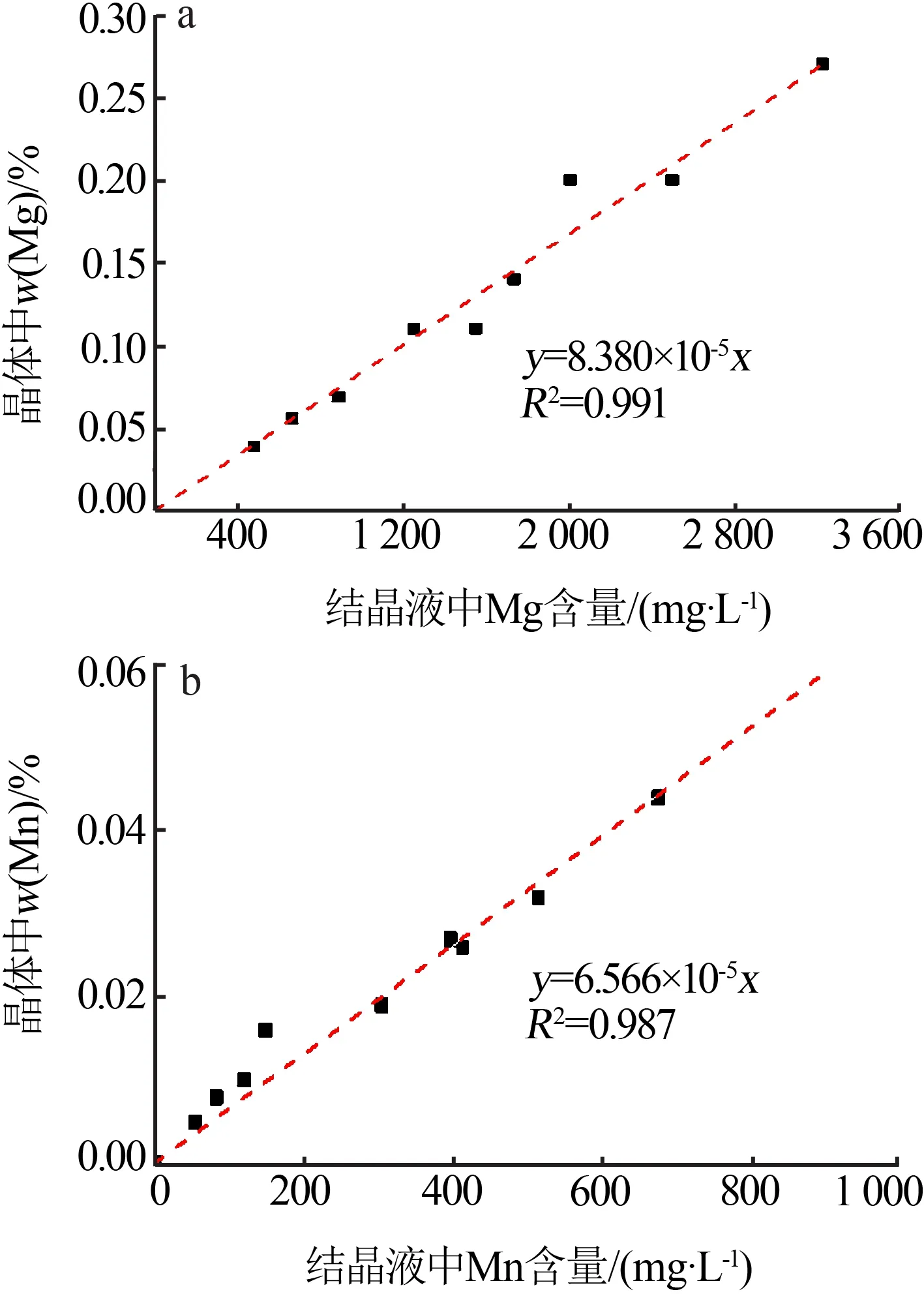
图3 结晶液与结晶体中Mg、Mn含量的趋势关系Fig.3 Trend relationship of Mg and Mn contents between crystal solution and crystal
2.2.3 Na离子影响
Na2SO4溶解度随温度的变化而变化较大,例如40 ℃时Na2SO4溶解度为48.8 g,而0 ℃时Na2SO4溶解度为4.9 g。因而,可以推测若在水解除Ti中通过利用NaOH 或Na2CO3调节溶液pH 而向体系中引入Na离子,导致Na离子的累积,可能会使FeSO4·7H2O晶体中Na杂质含量超标。
利用Na2CO3调节pH进行水解除Ti后进行冷冻结晶得到FeSO4·7H2O 晶体和结晶母液。然后结晶母液用于溶解钛白副产硫酸亚铁,再次利用Na2CO3调节pH水解除Ti后进行冷冻结晶,如此重复3次得到3 次循环结晶液。表4 列出了3 次循环结晶液中Na离子的累积情况。可以看到,一次循环结晶液中Na 离子含量显著升高,达到了4 210 mg/L。通过结晶母液循环,Na离子含量会逐渐进一步升高。经3次循环后,Na离子质量浓度升高至6 650 mg/L。
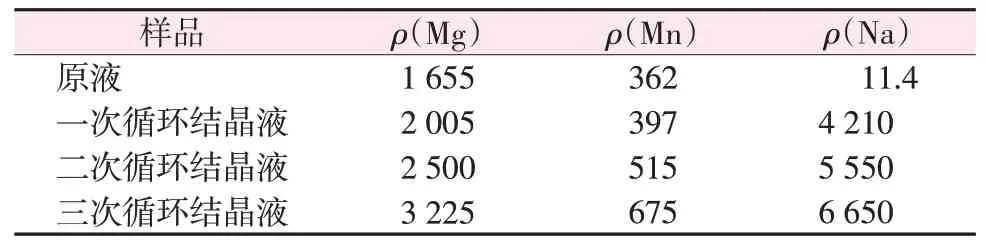
表4 结晶液中Na离子含量分析结果Table 4 Analysis results of Na+content in crystal solution mg/L
表5对应列出了表4 中循环结晶液经冷冻结晶得到的FeSO4·7H2O 晶体成分分析结果。FeSO4·7H2O晶体中的Na杂质质量分数均大于0.03%,远远高于某企业电池用高纯七水硫酸亚铁晶体产品标准最低要求值0.015%(见表1),因此结晶法提纯硫酸亚铁体系中需要严格控制溶液中Na的含量,即应避免利用NaOH或Na2CO3调节溶液pH。
3 结论
本论文利用结晶法提纯钛白副产硫酸亚铁,主要研究了Ti、Mg、Mn、Na杂质的去除规律,得到以下结论:1)利用Fe 粉可以调节溶液pH 到4.0,达到除Ti目的。同时,Fe粉还可以还原三价铁离子减少Fe损失,另外也避免了向溶液中引入其他杂质元素。2)当结晶液pH 为2.0 时,采用多次结晶可以有效降低FeSO4·7H2O 晶体中Mg、Mn 杂质含量。利用结晶液与结晶体中Mg、Mn含量的关系曲线推断得到:当结晶液中Mg 含量低于298 mg/L 时,FeSO4·7H2O 结晶体中Mg 质量分数将低于0.025%;当结晶液中Mn含量高于761 mg/L 时,FeSO4·7H2O 结晶体中Mn 质量分数将高于0.05%。3)结晶法提纯硫酸亚铁时,应避免使用NaOH或Na2CO3向溶液中引入Na离子,否则会出现Na杂质含量超标问题。
