丁基苯酞调控BDNF/ERK1/2-CREB通路对慢性酒精中毒大鼠的神经保护作用
2022-07-08姚本海刘海军郑永素遵义医科大学附属医院神经内科贵州遵义563003
姚本海,刘海军,张 霞,郑永素 (遵义医科大学附属医院神经内科,贵州 遵义 563003)
慢性酒精中毒(CA)是一个由神经生物机制和环境因素共同引起的复杂的多因素疾病,慢性酒精中毒发病率逐年升高,在全球病死和致残的危险因素中,其仅次于高血压和吸烟因素,位列第三[1]。研究表明长期酗酒者使血清BDNF水平明显降低[2]。据研究酒精中毒小鼠中缝核区BDNF mRNA水平和海马区BDNF蛋白水平下降,酒精可下调BDNF的表达[3]。许多研究表明脑源性神经营养因子(BDNF)是神经元可塑性调节的重要因子,具有促进神经元发育、生长和分化、防止神经元凋亡等多种生理功能[4-5]。BDNF-ERK/CREB信号通路在维持中枢和外周神经系统正常生理功能的同时,在神经分化和突触功能中起重要作用,也有助于学习,记忆形成和维护[6-7]。细胞外信号调节蛋白激酶(ERK)/cAMP 反应元件结合蛋白(CREB)信号途径与细胞的增殖生长密切相关,参与调解突触和神经元的可塑性。ERK1和ERK2是ERK的两种亚型。ERK1/2-CREB是介导BDNF细胞活性的重要途径,其主要通过促进BDNF对神经元细胞发挥抗损伤和促生长的作用。ERK1/2和CREB的磷酸化水平是反映信号通路活性的重要指标[8]。研究表明CREB是ERK信号通路的下游靶点,CREB的磷酸化伴随着ERK激活的上调[9]。CREB是BDNF的上游转录因子,CREB磷酸化最终导致BDNF的表达,BDNF在大脑的神经调节中具有活跃的功能[10]。本课题研究设想NBP对慢性酒精中毒大鼠是否通过调控BDNF/ERK1/2-CREB通路起保护作用,以期为慢性酒精中毒治疗寻找新的药物。
1 资料与方法
1.1资料
1.1.1实验动物和分组:清洁级健康SD雄性大鼠28只,由湖南斯莱克景达实验动物有限公司提供,体重300~330 g。所有采购老鼠到达实验室后,先适应性饲养1周以适应环境。实验分为正常对照组(Control,n=6)、慢性酒精中毒大鼠模型组(Model,n=8)、NBP高剂量组(NBP high dose,n=6)、NBP低剂量组(NBP low dose,n=8)。本研究经本院医学伦理委员会同意。
1.1.2主要药物、试剂、仪器:丁苯酞软胶囊(NBP,石药集团恩必普药业有限公司)、无水乙醇(西陇科技股份有限公司)、大鼠脑源性神经营养因子(BDNF)试剂盒(MM-0209R1,酶免)、大鼠白细胞介素12(IL-12/P70)试剂盒(MM-0140R1,酶免)、大鼠γ干扰素(IFN-γ)试剂盒(MM-0198R1,酶免)、Trizon Reagent(CW0580S,CWBIO 康为世纪)、Ultrapure RNA 超纯RNA提取试剂盒(CW0581M,CWBIO 康为世纪)、HiScript II Q RT SuperMix for qPCR(+gDNA wiper)(R223-01,Vazyme 诺唯赞)、2×SYBR Green PCR Master Mix(A4004M,Lifeint 生命互联)、荧光PCR仪(CFX ConnectTM实时,伯乐生命医学产品(上海)有限公司)、RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司)、BCA蛋白定量试剂盒(BCA Protein Assay Kit)(CW0014S,康为世纪)、PVDF膜(IPVH00010,Millipore)、封闭专用脱脂奶粉(P1622,北京普利莱基因技术有限公司)、牛血清白蛋白(BSA)(A8020,索莱宝)、超敏发光液(RJ239676,赛默飞)、超高灵敏度化学发光成像系统[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司]。
1.2方法
1.2.1模型构建:大鼠适应性喂养7 d后,除对照组外,其余各组大鼠连续给予6%(V/V)酒精溶液饮用28 d,酒精溶液每日9∶00配制、置换,构建慢性酒精中毒大鼠模型。28 d后按NBP高剂量(40 mg/kg)和低剂量(10 mg/kg)灌胃给药14 d,对照组灌胃等剂量的玉米油(5 ml/kg)。
1.2.2实时荧光定量PCR(RT-qPCR):取大鼠海马组织经液氮研磨成粉末,加入Trizol裂解液后再次研磨,收集组织匀浆液以提取总RNA。将RNA通过逆转录HiFiScript cDNA 第一链合成试剂盒合成cDNA。利用荧光PCR仪进行荧光定量PCR。反应体系如下:RNase Free dH2O 9.5 μl、cDNA 1 μl、上游引物1 μl、下游引物1 μl、2×SYBR Green PCR Master Mix 12.5 μl。反应步骤如下:预变性 95℃,10 min;变性95℃,10 s;退火58℃,30 s;延伸72℃,30 s;40个循环。引物由通用生物系统(安徽)有限公司合成。β-actin作为内参,BDNF、ERK1、CREB和和IFN-γ的相对表达量根据2-△△Ct法计算。实验所用的引物序列见表1。

表1 引物序列
1.2.3Western印迹检测:取大鼠海马组织经液氮研磨成粉末,加入裂解液后再次研磨,将组织匀浆吸入一EP管中,冰上裂解30 min后,12 000 r/min离心15 min,小心吸取上清,即可获得总蛋白。根据BCA试剂盒测定蛋白浓度。蛋白变性,上样,进行十二烷基苯磺酸钠凝胶电泳(SDS-PAGE)2 h,后用300 mA恒流转膜80 min。一抗溶液孵育,4℃过夜;二抗溶液中室温孵育2 h。在膜上滴加ECL发光液,在凝胶成像系统中曝光。用ImageJ软件分析各抗体条带灰度值。
1.2.4统计学方法:所有数据均用Graphpad Prism7进行统计分析。组间的显著性差异经方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1各组IFN-γ、BDNF、ERK1、CREB mRNA表达比较:与对照组相比,模型组IFN-γ mRNA表达水平明显增高,差异有统计学意义(P<0.01);BDNF、ERK1 mRNA表达水平明显减低,差异有统计学意义(P<0.01);但CREB mRNA表达水平增高,差异无统计学意义(P>0.01)。与模型组相比,使用NBP高剂量和低剂量治疗后明显降低IFN-γ mRNA,差异有统计学意义(P<0.01);而BDNF、ERK1 mRNA升高,差异有统计学意义(P<0.01);但CREB mRNA表达水平未升高,差异无统计学意义(P>0.01)。见表2。
2.2各组IL-12、IFN-γ、BDNF、ERK1/2、p-ERK1/2、CREB、p-CREB蛋白表达比较:与对照组相比,模型组中IL-12、IFN-γ显著上调,差异有统计学意义(P<0.01);BDNF、p-ERK1/2和p-CREB显著下调,差异有统计学意义(P<0.01)。与模型组相比,NBP高剂量和低剂量治疗后降低IL-12和IFN-γ的蛋白表达,差异有统计学意义(P<0.01);上调BDNF、p-ERK1/2和p-CREB的蛋白表达,差异有统计学意义(P<0.01),见表3、图1;其中高剂量的NBP效果更佳。

表2 各组IFN-γ、BDNF、ERK1、CREB mRNA表达比较

表3 各组IL-12、IFN-γ、BDNF、ERK1/2、p-ERK1/2、CREB、p-CREB蛋白表达比较
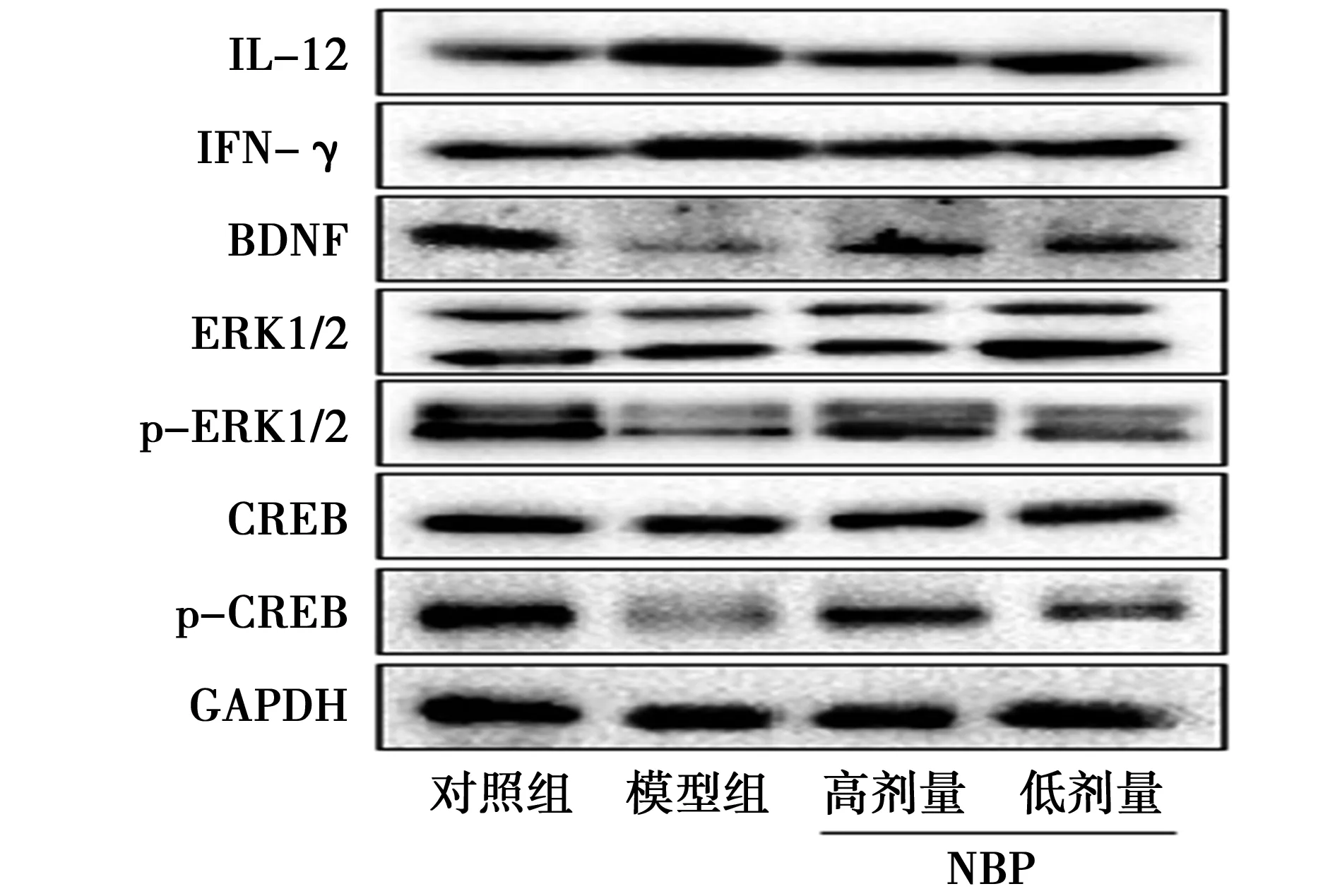
图1 各组IL-12、IFN-γ、BDNF、ERK1/2、p-ERK1/2、CREB、p-CREB的蛋白条带
3 讨论
长期过量饮酒会导致消化系统、心血管系统和神经系统发生严重衰竭[11-15]。持续性饮酒是影响大脑的重要因素,包括情绪和行为的改变以及判断缺陷、学习障碍和记忆障碍。在1984年的一项研究表明,在首次入院治疗时随机选择的住院慢性酗酒者中,68%有认知障碍,74%有周围神经病变,24%有自主神经功能失调的证据,所有这些都被认为与长期饮酒有关[16]。
根据WHO 2014年《全球酒精与健康状况报告》,全球人口中有38.3%饮酒,其中我国在2010~2012年15岁及以上居民34.3%饮酒,一生中酒精依赖和酗酒的患病率分别为12.5%和17.8%;在过去的20年,由于酒精的滥用,全球死亡率增加30%,每天有15人或每96 min有一人死于饮酒;有害使用酒精每年导致300多万人死亡,每20人中有1人死亡,酒精的有害使用造成全球疾病负担增加5%以上[17-18]。
Climent等[19]证实酒精可降低BDNF的表达,从而抑制其受体功能以及与细胞存活相关的细胞外信号调节激酶1/2(ERK1/2)信号通路,影响神经元的生长、分化及生存。长期大量饮酒可以导致炎性反应因子:IL-1b、IL-6、IFN-γ和TNF-α等增加[20]。BDNF基因的缺乏导致了小鼠酒精摄入量的增加[21]。据报道BDNF治疗可降低脑内细菌组诱导的促炎细胞因子TNF-α、IL-1β、IL-6的水平,增加抗炎细胞因子IL-10的表达[22]。NBP的主要药理作用包括重建微循环,保护线粒体功能,抑制氧化应激,抑制炎性反应和抑制神经元凋亡[23]。研究发现NBP能激活ERK1/2介导的EGFR通路,使CREB和ELK1的转录激活,进而促进BDNF的表达;NBP除了促进BDNF的表达外,还促进表皮生长因子(EGF)的表达;这两种神经营养因子可能激活Trk受体,进而激活ERK1/2及其下游效应子;因此,以ERK1/2为中心,可能启动一个正反馈回路,增强NBP的作用;NBP通过激活多种生长因子介导的信号通路,促进OGD/R损伤下的神经生成和神经元存活[24]。
本文对慢性酒精中毒大鼠通过予以NBP高剂量、低剂量灌胃后使IFN-γ mRNA减低,BDNF、ERK1 mRNA增高;减低IL-12、IFN-γ 蛋白,BDNF、p-ERK1/2、p-CREB蛋白升高;但在CREB mRNA变化上无意义,可能与实验条件、温度、操作等有关,望在以后的实验中加大样本量、严格PCR实验流程标准,提高实验结果的准确性。综上分析,NBP可能激活BNDF/ERK1/2-CREB信号通路,对CA大鼠神经保护作用,为临床运用NBP治疗慢性酒精中毒性脑病提供动物实验依据。
