Y-box结合蛋白1调控凋亡相关基因在胃癌发生发展中的作用
2022-07-08马振增蚌埠医学院第一附属医院安徽蚌埠233000
任 志,马振增 (蚌埠医学院第一附属医院,安徽 蚌埠 233000)
由于缺乏典型的临床症状和特异性的早期诊断标志物,大部分胃癌患者发现时已处于中晚期,该时期的胃癌患者缺乏有效的治疗手段,预后极差[1-2]。因此研究胃癌早期诊断的特异性标志物及其治疗靶点,对胃癌的早期诊断、判断预后进而早期治疗具有重要的临床及科研意义。Y-box结合蛋白1(YB-1) 是冷休克蛋白超家族的一员,是从细菌到人类的细胞中均广泛表达的转录因子, 包含一个进化高度保守的冷休克域(CSD),可与DNA及RNA结合[3]。YB-1作为转录和翻译因子,在调节细胞增殖、分化及应激反应等方面具有重要作用[4]。文献报道它是一种与肿瘤的生长、增殖及耐药性密切相关的多功能蛋白,参与基因的转录调节、RNA剪切、mRNA 翻译、DNA损伤修复、 细胞增殖和再生调节等多种过程[5]。大量文献中研究发现YB-1在胰腺癌、淋巴瘤、肺癌、乳腺癌、骨肉瘤等肿瘤中呈高表达[6-8],其表达水平与肿瘤的进展、复发、转移、 化疗耐受及预后不良相关[3]。研究发现YB-1在人体胃癌标本中呈过表达状态[9],但YB-1促进胃癌的侵袭、转移的机制尚不明确以及是否与胃癌患者预后相关的研究较少。
生物信息分析是利用信息技术进行基因生物学分析的有效方法,可以分析各个系统肿瘤特殊临床表现与分子生物学的关系,通过对胃癌及YB-1的相关分析,可以分析两者的相互关系,为研究胃癌及评估胃癌患者预后提供一定的生物基因相关的证据,以提供新的诊治胃癌的技术及方法。因此,本研究将通过生物信息学分析YB-1在胃癌组织表达水平与相关凋亡基因中的关联,同时在胃癌细胞中分析两者间调控关系,揭示YB-1在胃癌发生发展中的作用机制。本次研究经过本院医学伦理委员会同意。
1 材料与方法
1.1材料:MKN-47胃癌细胞购自中国科学院上海生物细胞研究所;Annexin V-APC/7-AAD凋亡试剂盒(AP105)购自上海联科生物;siRNA-YB-1和si-RNA-NC由上海生工设计并合成;LipofectamineTM3000 Transfection Reagent(Invitrogen,USA);DMEM培养基和胎牛血清FBS购自Gibco公司。
1.2方法
1.2.1生物信息学分析YB-1在多个类型肿瘤中的表达水平及与胃癌的预后生存状态:通过Oncomine肿瘤数据库在线分析YB-1在多个类型肿瘤组织中的表达水平,选择肿瘤类型后,在Primary filters输入检索基因YB-1,其判断标准为癌组织/正常组织中的YB-1水平>2倍且P<0.05。除此之外,利用该数据库进行基因表达与生存状态的关联分析。
1.2.2生物信息学分析胃癌中与YB-1共表达的基因:同样通过Oncomine肿瘤数据库在线分析胃癌中与YB-1共表达的基因,其操作如下:在Search栏输入YB-1,在Primary filters里依次选择Analysis Type → Coexpression Analysis,在Cancer Type里选择Gastric Carcinoma,页面刷新后进行Coexpression分析。
1.2.3siRNA靶向抑制MKN-45胃癌细胞中YB-1:siRNA-YB-1和siRNA-NC序列参考文献设计,由上海生工公司进行合成。接种适量的MKN-45胃癌细胞到六孔板中,使第2天细胞融合度为50%~70%时准备转染。按每个孔250 μl Opti-MEM培养基含有2.5 μg siRNA与3.75 μl Lipofectamine 3000充分混匀并静置5 min以上之后加入到六孔板,并补充2 ml无血清培养基,转染6 h后,更换正常培养基继续培养24 h,收集细胞做后续试验。
1.2.4Western印迹分析siRNA抑制YB-1效果:收集转染后细胞,加入IP细胞裂解液提取蛋白并经BCA蛋白定量试剂盒定量。按每孔30 μg 总蛋白的量进行上样,经SDS-PAGE凝胶电泳分离后,转移至PVDF膜并用脱脂牛奶室温封闭2 h后,孵育一抗YB-1(ab76149,1∶1 000稀释),4℃摇床过夜。第2天,TBST洗涤之后,加入二抗室温孵育1 h,然后用TBST洗涤3次,5 min/次,进行显影。
1.2.5流式细胞术检测siRNA靶向抑制YB-1后MKN-45胃癌细胞的凋亡水平:收集经上述验证后的MKN-45细胞,参照试剂盒说明书进行凋亡染色,具体步骤如下:按说明书设计单和双染管进行仪器参数调节。收集1×106~3×106个细胞,用预冷PBS洗涤2次,加入稀释好的1×结合缓冲液进行重悬,往上述没管细胞悬液加入5 μl Annexin V-APC和10 μl 7-AAD,轻微混匀,室温避光孵育15 min,流式细胞仪检测分析。
2 结果
2.1生物信息学分析YB-1在多个类型肿瘤中的表达水平及与胃癌的预后生存状态:如图1所示,经数据库搜索分析发现,YB-1在多个肿瘤类型中均呈过度表达状态,包括胃癌,提示YB-1在肿瘤发生发展中扮演着重要地位。进一步分析发现,YB-1过表达与胃癌患者的不良预后存在关系,即YB-1过表达患者的生存时间更短,见图2。
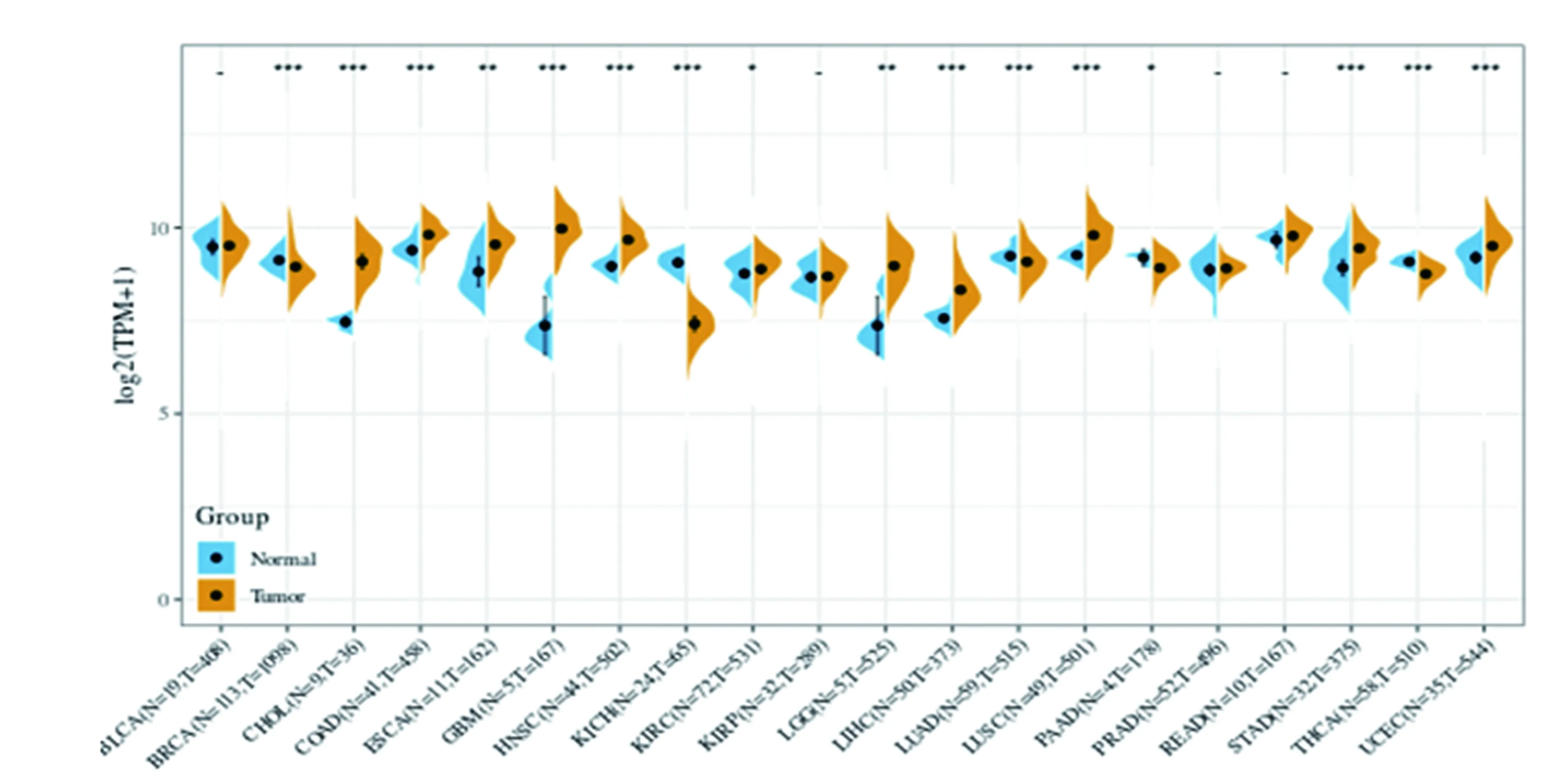
图1 YB-1在多个类型肿瘤中的表达水平
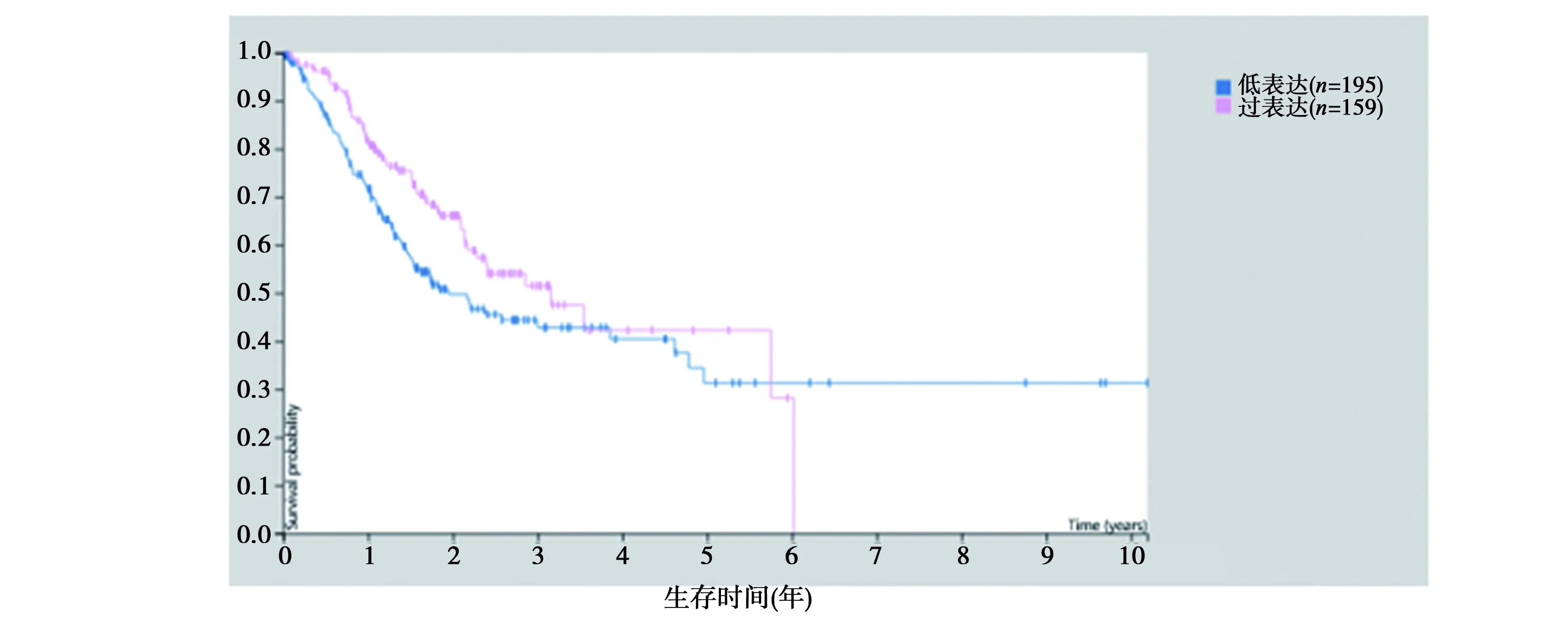
图2 YB-1过表达与胃癌的预后生存状态
2.2生物信息学分析胃癌中与YB-1共表达的基因:如图3A所示,通过CCLE数据库中的胃癌数据对YB-1基因的共表达基因进行分析,结果显示YB-1与YBX1B10、SF3A3、PPIH、NASP、UTP11L、NDUFS5、STK25等多个基因共表达,且与NASP存在正相关关系。如图3B所示,共表达基因YBX1B10、SF3A3、PPIH和NASP与YB-1均存在显著的正相关关系。
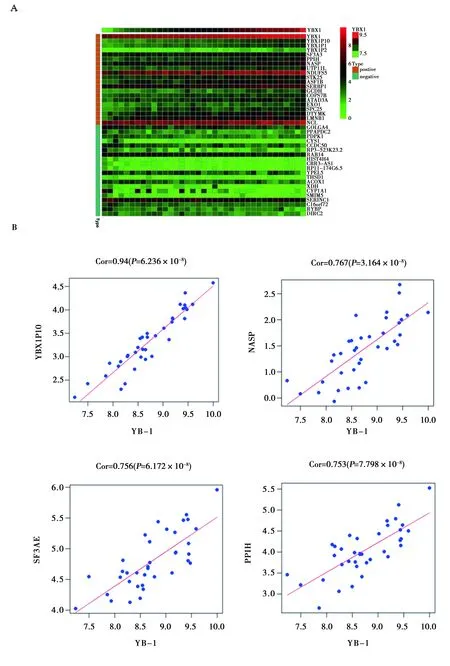
图3 胃癌中与YB-1共表达的基因
2.3siRNA靶向抑制MKN-45胃癌细胞中YB-1:人正常胃黏膜细胞GES-1与胃癌细胞MKN-45中YB-1的表达水平比较,如图4所示,胃癌细胞MKN-45中YB-1的表达水平显著高于GES-1细胞,经siRNA-YB-1转染后可显著降低MKN-45细胞中YB-1的表达水平,其差异均有统计学意义(P<0.01)。

与GES-1细胞比较,①P<0.01;与NC组比较,②P<0.01图4 siRNA靶向抑制MKN-45胃癌细胞中YB-1
2.4siRNA靶向抑制MKN-45胃癌细胞中YB-1后细胞增殖、凋亡水平改变:如图5A所示,经siRNA-YB-1转染抑制YB-1,用CCK-8试验检测细胞增殖水平,在第3天开始,siRNA-YB-1组细胞的增殖速度显著低于对照组,差异有统计学意义(P<0.01)。如图5B所示,经siRNA-YB-1转染抑制YB-1,用流式细胞术检测细胞凋亡水平,结果显示siRNA-YB-1组细胞的凋亡水平显著升高,差异有统计学意义(P<0.01)。

A;细胞增殖试验;B;流式细胞术检测细胞凋亡,与siRNA-YB-1比较,①P<0.01图5 siRNA靶向抑制MKN-45胃癌细胞中YB-1后细胞增殖、凋亡水平改变
3 讨论
胃癌是癌症相关死亡的第二大原因,也是2018年全球第六大最常见的癌症[10]。在上消化道肿瘤中,胃癌在东亚国家尤为常见。因此对胃癌的早期诊断、判断预后进而早期治疗具有重要的临床及科研意义。众多文献报道YB-1可参与肿瘤的生长、增殖及耐药性密切相关的多功能蛋白,参与基因的转录调节、RNA剪切、mRNA 翻译、DNA损伤修复、 细胞增殖和再生调节等多种过程[11-12]。研究表明,YB-1参与胃黏膜上皮内瘤变进展、癌变及转移过程,然而关于利用数据库分析YB-1在多个肿瘤组织的表达水平与预后状态,同时结合分子生物实验阐述YB-1在该过程的发生发展还尚未研究[13]。在本研究中,通过Oncomine肿瘤数据库分析YB-1在多种肿瘤类型中的表达水平,并发现YB-1在胃癌中呈过度表达状态,同时其过度表达与胃癌患者的不良预后存在相关关系,提示YB-1在胃癌的发生发展中起到关键作用。同时本文利用CCLE数据库中的胃癌数据对YBX1基因的共表达基因进行分析,结果显示YBX1与YBX1P10、YBX1P1、YBX1P2、SF3A3、PPIH、NASP、UTP11L、NDUFS5、STK25等多个基因共表达,说明YB-1与多个基因水平有着密切关系。而这里面的基因,如NASP可参与细胞的增殖,调控细胞周期[11]。因此YB-1可能影响这些基因起到促进胃癌的发生发展。
接下来分析了YB-1在人正常胃黏膜细胞GES-1与胃癌细胞MKN-45的表达水平,其结果显示MKN-45细胞YB-1的表达水平显著高于GES-1细胞,与前人报道的一致。除此之外,本文进一步通过siRNA抑制MKN-45细胞YB-1的表达水平后发现,其细胞增殖水平降低和凋亡率增加,提示减少YB-1可抑制胃癌细胞的增殖,促进其凋亡。这暗示着YB-1有望作为一个治疗靶点进行胃癌的治疗。
