颅内胶质肉瘤的诊疗进展
2022-07-08许珏凤
许珏凤,徐 荣
1.复旦大学附属华山医院手术室,上海 200040
2.复旦大学附属华山医院神经外科,上海 200040
胶质母细胞瘤(glioblastoma, GBM)是成人较常见的原发性恶性脑肿瘤,约占脑肿瘤的50%[1]。胶质肉瘤(gliosarcoma, GSM)是GBM的一种变异体,是一种起源于胶质细胞的恶性肿瘤,其以双相成分为特征:胶质瘤性和肉瘤性[2-3]。GSM进一步分为原发性(PGS)和继发性(SGS)2种,一般来说PGS是新生的,而SGS则被认为是GBM的复发或进展,或由放疗引发[4]。在临床实践中,GSM和GBM的治疗是相似的,但研究[5-7]表明,这两者治疗结果是不同的,Han等[8]报道GSM的总生存期(overall survival, OS)为6到14.8个月。由于病例稀少,目前关于GSM的研究仍然很少,将来需要更多的病例研究。本文综述了GSM病例的研究现状、治疗方案和预后等。
1 GSM生物学特征
1.1 病理特征和转移目前已确定2种GSM亚型:以肉瘤成分为主的GSM与脑膜瘤相似,产生网状蛋白,缺乏神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP); 以 胶 质 瘤 为 主的GSM病理检查表现为坏死、网状蛋白缺乏以及GFAP表达阳性[7-9](图1)。研究[7-8]发现,肉瘤亚型的OS更好,可能与该亚型的总体手术切除成功率较高有关。因为肉瘤性GSM在位置和界限上与脑膜瘤相似,根治性手术切除更容易实现。而胶质瘤性GSM发生在脑实质内,手术全切除难度更高。
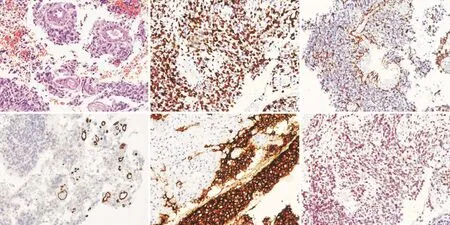
图1 某病例复发GSM的病理特征
无法手术切除时,由于肉瘤性GSM其对烷基化疗药物的耐药性,其与胶质亚型GSM相比预后较差[8,10]。另外,胶质瘤性GSM很少转移到颅外和弥散到脑脊液,而肉瘤性GSM则显示高转移倾向[4]。
1.2 基因突变长期以来GSM被认为是GBM的变异体,因此GSM的治疗策略与GBM相似[11]。然而一些研究[12-14]指出,GSM和GBM的治疗反应各不相同,提示这2种疾病之间存在潜在差异的可能性。因此,科学家们一直在研究GSM和GBM的基因差异[11],以解释治疗结果的差别。目前在GSM和GBM中发现了一些主要的基因突变和扩增,但它们的意义尚不清楚。与GBM相比,GSM普遍缺乏EGFR扩增[15]。
替莫唑胺(TMZ)化疗对GBM患者有效果,是因为GBM中存在较多的O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)甲基化改变;而在GSM病例中,MGMT甲基化较少。Lee等[11]研究26例GSM患者发现MGMT甲基化较少。但是,Kang等[16]研究则显示GSM患者MGMT甲基化的比例更高。
研 究[17]发 现GSM中 含 有BRAF、EGFR、CDKN2A、NF1和PTEN突变。还有研究[11]表明GSM发生IDH1突变,但放疗诱导的GSM中无IDH1突变。同样,与野生型相比,IDH1突变GBM患者中,IDH1和IDH2突变与预后相关[18-19]。然而在GSM患者中未发现预后意义。Li等[20]发现GSM中含有NF1和TP53突变。
2 影像学特征
在影像学上,CT和MRI显示胶质肉瘤为不规则肿块,外壁光滑,与周围脑实质界限清楚,周围水肿明显。此外,胶质肉瘤更常发生于颞叶,在大体形态上与脑膜瘤相似(图2)[21]。Han等[8]发现,GSM一般为较大病变,在T1加权图像上呈低信号,在T2加权图像上呈高信号,表现为坏死和中央钙化区(以不均一增强为特征),周围或不规则强化和中线结构移位。MRS则显示胆碱(Cho)波峰,正常的肌酐(Cr)和低的乙酰天冬氨酸(NAA)[22]。
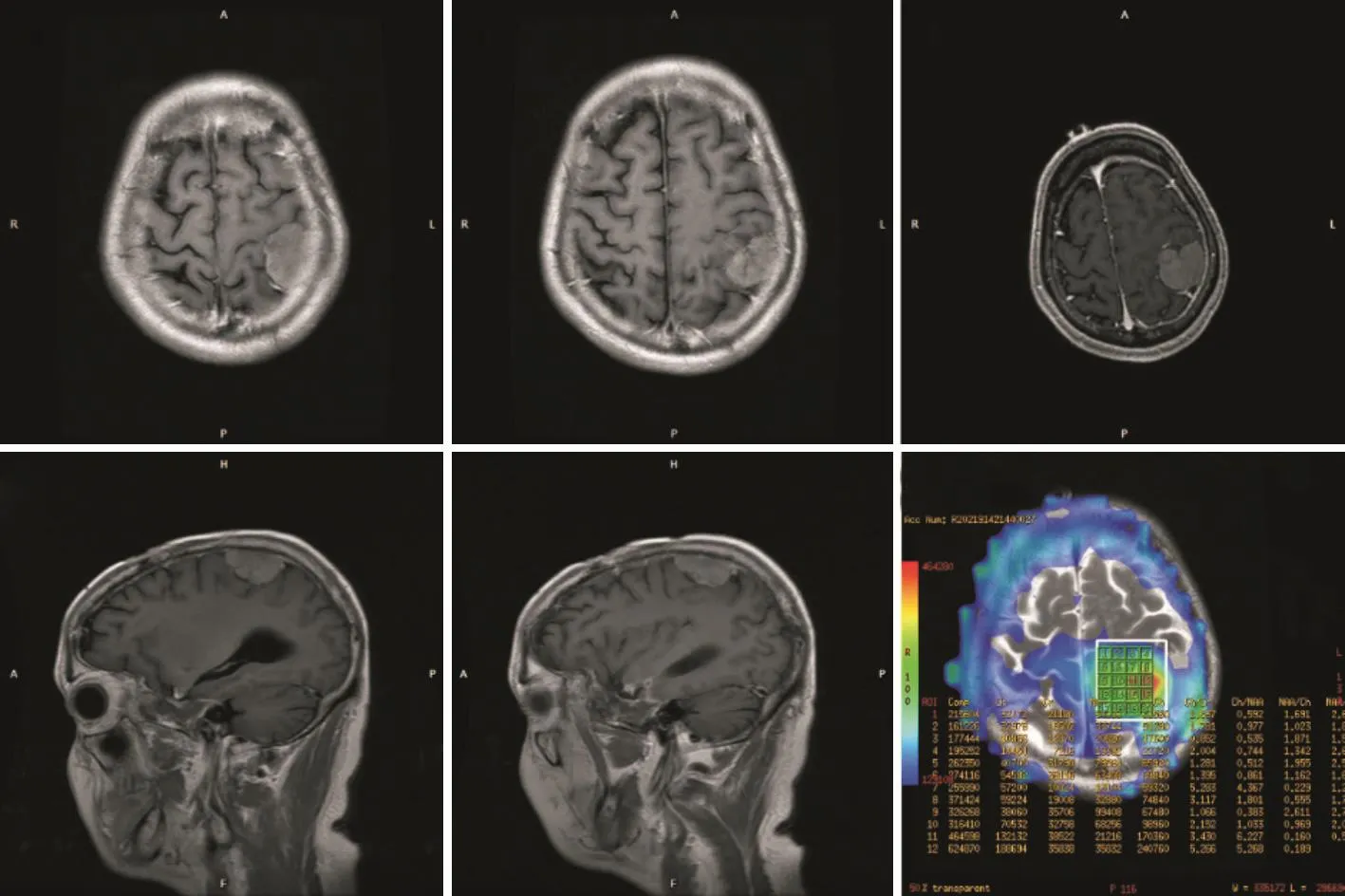
图2 复发GSM典型病例的影像学表现
3 治疗方法
3.1 手术切除随着GSM切除范围的扩大,OS大大提高[23]。同样,多因素分析显示,在GSM中手术全切除是一个独立的预后因素[11]。其他研究[24-25]也证实,根治性切除联合放疗对GSM患者有良好的预后。
由于GSM病例数少,限制了研究,使得手术切除率和OS之间的相关性不显著。Cachia等[4]报道,接受全切除术的患者比接受次全切除术的患者有更高的OS;然而,由于样本量小,结果无统计学意义。同样,在Castelli等[6]进行的研究中发现,与单纯活检组相比,尽管手术切除组改善了预后,但由于样本量较小,2组差异亦无统计学意义。
3.2 放射疗法有研究[13]探讨放疗治疗GSM患者的疗效。与仅接受手术的患者相比,25例接受辅助放疗的患者OS显著提高。同样,一项研究[6]发现,术后放射治疗比单纯手术治疗效果更好。
3.3 TMZ化疗有些研究表明TMZ作为治疗方案的一部分是有益的,而另一些研究[26]发现OS没有显著改善。在放疗后加入TMZ化疗并不能延长GSM患者的OS;然而,GBM患者的生存明显获益[6]。由于GSM的MGMT甲基化率较低,因此TMZ化疗对GSM患者的益处不大[5]。
在仅限于GSM患者的研究中,关于TMZ治疗效果报道不一。在Han等[8]研究中,给GSM患者(特别是原发性GSM)服用TMZ没有显示出任何益处。尽管有研究[27]显示,使用TMZ的患者2年OS从10.2%改善到20%,但结果无统计学意义。同样,虽然与单纯放疗相比,接受放疗和TMZ治疗的患者中位OS增加,但是结果没有统计学意义[7]。Salvati等[7]报道,尽管样本量小,但使用TMZ治疗患者的中位生存率高于此前报道。
有研究[11]认为,MGMT甲基化率低是TMZ治疗在GSM中无效的原因。Adeberg等[28]发现,排除MGMT甲基化因素,与单独接受放疗的患者相比,在放疗后添加TMZ治疗显著提高了GSM患者的OS。Kang等[16]发现MGMT甲基化高的GSM患者在使用TMZ治疗时OS更长,但因样本量小,结果无统计学意义。然而,其他研究[28]表明,即使TMZ治疗MGMT甲基化高的GSM病例,也未能显示出与无进展生存(PFS)或OS显著相关性。
3.4 贝伐珠单抗治疗贝伐珠单抗是一种重组IgG1单克隆抗体,选择性结合内皮细胞上的VEGF受体并具有高亲和力。这种相互作用抑制了内皮细胞的增殖和新血管形成[28]。GBM是一种高血管化肿瘤,会产生许多促血管生成因子,因此被认为是贝伐珠单抗治疗的良好靶点[29]。据推测,贝伐珠单抗在阻止GBM和GSM进展方面发挥了重要作用。为了验证这一假设,贝伐珠单抗被用于原发性和继发性GSM患者。Cachia等[4]推测,在研究的患者中观察到的结果改善可能是由于贝伐珠单抗的使用,特别是复发的GSM住院患者。
3.5 联合治疗除了单一方式的治疗,目前指南[30]建议GSM治疗采用最大限度的安全手术切除、放疗和同步/辅助TMZ化疗。在Castelli等研究[6]中,75例GSM患者接受了手术、TMZ化疗和放疗联合治疗,12%的患者达到了2年的OS,中位OS为13个月。
GSM的预后一般较差,但联合治疗似乎延长了生存期[7]。在Salvati等[7]的一项研究中,治疗方法为全脑放疗+TMZ化疗,尽管治疗结果不显著,但TMZ化疗似乎增加了放疗对OS的改善,仍提示辅助TMZ化疗的患者可能比单纯手术和放疗治疗的患者有更长的OS。然而,由于样本量较小,OS与治疗方案之间的相关性无统计学意义。
有研究认为肿瘤切除和辅助放疗与OS的增加相关,但是Romero-rojas等[31]的研究未显示OS改善,采用联合方案(手术切除+术后放疗+每周长春新碱基础化疗),结果没有患者获得完全缓解,研究人员将其归因于研究人群中肿瘤固有的侵袭性特征。
4 讨 论
GSM的预后与多种因素有关。年龄、手术切除范围和辅助放疗被证明是OS的重要预测因子。与GSM相比,GBM患者的OS更长[32]。GSM亚型中OS也有差异。
至于治疗方式,辅助放疗似乎是改善OS的关键。在一些病例中,肿瘤切除范围与OS的改善相关,但并非所有病例都如此[33]。贝伐珠单抗有可能是一种较好的辅助治疗方式。TMZ化疗也可以作为GSM的辅助治疗方案[34]。然而,由于样本量少,阻碍了对这些治疗方法的合理结论。
目前对于GSM患者的最佳治疗方案倾向于联合治疗[35],近来在影像组学、基因组学方面的进展[36],以及将来可以开展的多中心研究可以提供足够数据来识别特定的GSM及其亚型的基因改变,并通过不同的基本靶向治疗方式,必将为患者带来更大的福音。
利益冲突:所有作者声明不存在利益冲突。
