打破野生藏沙蒿种子休眠方法的筛选与评价
2022-07-08罗建民王敬龙刘云飞王绮玉
罗建民, 刘 欢*, 王敬龙, 刘云飞, 王绮玉, 黄 颖
(1. 甘肃农业大学草业学院,草业生态系统教育部重点实验室, 甘肃 兰州 730070; 2. 西藏自治区农牧科学院草业科学研究所, 西藏 拉萨 850000)
藏沙蒿(Artemisiawellbyi),隶属于菊科(Compositae)蒿属(Artemisia)植物,是一种多年生半灌木草本植物[1-2],主要分布在西藏气候寒冷、紫外线辐射强度大、空气稀薄和降水量少的高山草原、草甸以及荒漠地区[3]。因自然选择和物种的适应性,藏沙蒿种质在防风固沙、草原退化修复和草原生态功能维持等方面具有重要作用[4]。藏沙蒿植株粗脂肪、粗蛋白含量高,分别为4.50%,13.19%,常被用作牧区饲用牧草[5]。因此,其作为西藏特有物种,在当地植被组成中占有非常重要的地位[6]。然而,青藏高原独特的地理环境、气候条件和脆弱的生态系统对藏沙蒿种子的萌发和生长繁殖起到一定的限制作用[7]。种子萌发是植物生长的重要过程之一,但其休眠机制在很大程度上阻碍了种子的萌发。菊科植物种子大多属于非深度生理休眠[8],且多数荒漠蒿属植物种子表面附有一层粘液,可能含有抑制种子萌发的物质,造成种子发芽率不高、出苗不规律等情况[9-11]。野生藏沙蒿种子也存在同样问题,进而影响其成为生态草在科研及人工草地建植中的应用。研究表明,使用GA3,IAA等外源激素KNO3,H2O2,KMnO4、浓H2SO4等化学试剂、微量元素和温水等方法浸种能够软化种子种皮,激发种子内部代谢活动和生理效应,促进种子对水分的吸收能力,抑制或破坏阻碍植物种子萌发的相关物质,打破种子的休眠,从而达到促进种子萌发的作用[12-17]。此外,PEG-6000是一种高分子渗透调节剂,其本身作为高分子化合物不能进入种子细胞中,但能够参与种子细胞中的生理代谢过程,有报道缩短藜麦(Chenopodiumquinoa)[18]、紫花苜蓿(Medicagosativa)[19]种子的发芽时间,提高种子的活力的作用。
目前,对于藏沙蒿种质的研究多集中在分布区域调查、营养成分以及药用价值等方面[20],在藏沙蒿种子休眠机制和打破休眠方法的研究上未见报道。鉴于此,本试验以西藏野生藏沙蒿种子为试验材料,研究不同浓度激素、化学试剂、不同温度温水浸种以及不同浓度PEG-6000,H2O2溶液浸泡滤纸等7种方法处理对藏沙蒿种子萌发的影响,通过对萌发指标的测定,运用隶属函数综合评价筛选出打破休眠的最佳处理方法,明晰不同处理对藏沙蒿种子萌发的影响,为提高藏沙蒿种子的萌发率以及培育优异种质提供一定理论依据。
1 材料与方法
1.1 试验材料
藏沙蒿种子与2020年10月采自西藏拉孜县彭措林乡(29°12′N,88°18′E)海拔3 577 m地区,采集后室内自然风干,去除杂质,保存于纸质种子袋中,常温(20℃~25℃)避光储藏。藏沙蒿种子呈长椭圆、倒卵形,种子颜色为灰褐色至黑色,长约0.868 mm,宽约0.700 mm,长宽比约1.243,千粒重在0.201 g左右,其表层具有黏液。
1.2 试验方法
选取籽粒饱满、大小均一的藏沙蒿种子,10%的NaClO溶液浸泡3 min,蒸馏水冲洗3~4次,晾干。将消毒后的种子放置于装有KNO3,GA3,IAA、微量元素水溶肥料(P2O5≥266 g·L-1,Mn=25 g·L-1,Zn=50 g·L-1,Cd≤10 mg·kg-1,Pb≤50 mg·kg-1,Hg≤5 mg·kg-1,Cr≤50 mg·kg-1,S≤30 g·L-1,Cl≤30 g·L-1等)各浓度溶液和不同温度温水的试管中浸泡12 h(温水浸种采用水浴锅恒温加热法),再次风干,浸种时以溶液浸没种子为标准。H2O2,PEG-6000处理使用浸泡滤纸法,以溶液浸透滤纸为标准。以蒸馏水为对照。每个方法各设置3个处理,每一处理4次重复,共22个处理(见表1)。

表1 试验处理和编号Table 1 Test treatment and number
浸种结束后,每一重复对应选取处理的50粒藏沙蒿种子放置于直径10 cm、铺有2层滤纸的发芽盒中,后加入7 mL蒸馏水,并称重,记为原始质量M。将发芽盒放置于25℃恒温光照培养箱(光暗周期为12 h/12 h)培养。培养期间每天称取发芽盒质量以补充失去的水分。H2O2,PEG-6000溶液处理定期更换发芽盒中浸泡的滤纸。从培养第2 d开始,每隔1 d统计种子发芽数,并观察种子的萌发情况,若种子连续3 d不再发芽视为萌发结束,并测定各项萌发指标。
1.3 测定指标
参照《青蒿种子检验规程研究》[21]进行以下种子萌发指标的计算:
发芽率=发芽结束时发芽的种子数/供试种子总数(50)×100%;
相对发芽率=各方法处理下种子的发芽率/对照组发芽率×100%;
发芽势=发芽高峰期发芽的种子数/供试种子总数×100%;
相对发芽势=各方法处理下种子的发芽势/对照组发芽势×100%;
发芽指数(GI)=∑(Gt/Dt);
活力指数(VI)=GI×S;
式中,Gt为第t日的发芽数,Dt为相应发芽天数;S为平均幼苗长度;
根长:每个发芽盒中选出10株幼苗利用直尺测定从根基部到根尖测定的长度;
相对根长=各方法处理下幼苗根长/对照组幼苗根长×100%;
芽长:每个发芽盒中选出10株幼苗利用直尺测定幼苗从根基部到幼苗最高部位的长度;
相对芽长=各方法处理下幼苗芽长/对照组幼苗芽长×100%;
1.4 综合评价方法
运用隶属函数法进行综合评价筛选,隶属函数计算公式为:
X(a)=(X-Xmin)/(Xmax-Xmin)
X(b)=1-(X-Xmin)/(Xmax-Xmin)
其中,X为试验不同处理下藏沙蒿种子某一指标的测定值,Xmax,Xmin分别为测定指标的最大值和最小值。如果某一指标与促进萌发指标呈现负相关,则可以通过反隶属函数计算隶属函数值。
将各方法处理下藏沙蒿测定萌发指标的隶属函数值累加求其平均值,根据平均隶属函数值的大小来确定促进种子萌发的强弱,平均隶属函数值越大,说明促进种子萌发作用越强,反之越弱[22]。
1.5 数据分析
试验数据用SPSS 25.0软件进行统计分析,采用单因素方差分析检验不同处理对藏沙蒿萌发指标的影响,用Duncan法对不同处理的平均值进行多重比较,显著性水平α为0.05;采用Microsoft Excel 2019进行数据整理和绘图。
2 结果与分析
2.1 不同方法对藏沙蒿种子相对发芽率、相对发芽势、相对根长、相对芽长的影响
由表2可知,不同浸种处理方法对打破藏沙蒿种子休眠有一定差异。A1~A3,随KNO3浸种浓度的升高,对藏沙蒿种子的相对发芽率呈先抑制后促进的变化趋势。A1,A2浓度浸种下抑制藏沙蒿种子萌发,仅A3浓度的KNO3浸种对藏沙蒿种子萌发起到促进作用,相对发芽率、相对根长分别提高7.14%,40.98%,此浓度下相对发芽势与对照差异不显著,且对相对芽长起到抑制效果,说明高浓度的KNO3浸种对藏沙蒿萌发中根的伸长有重要作用。
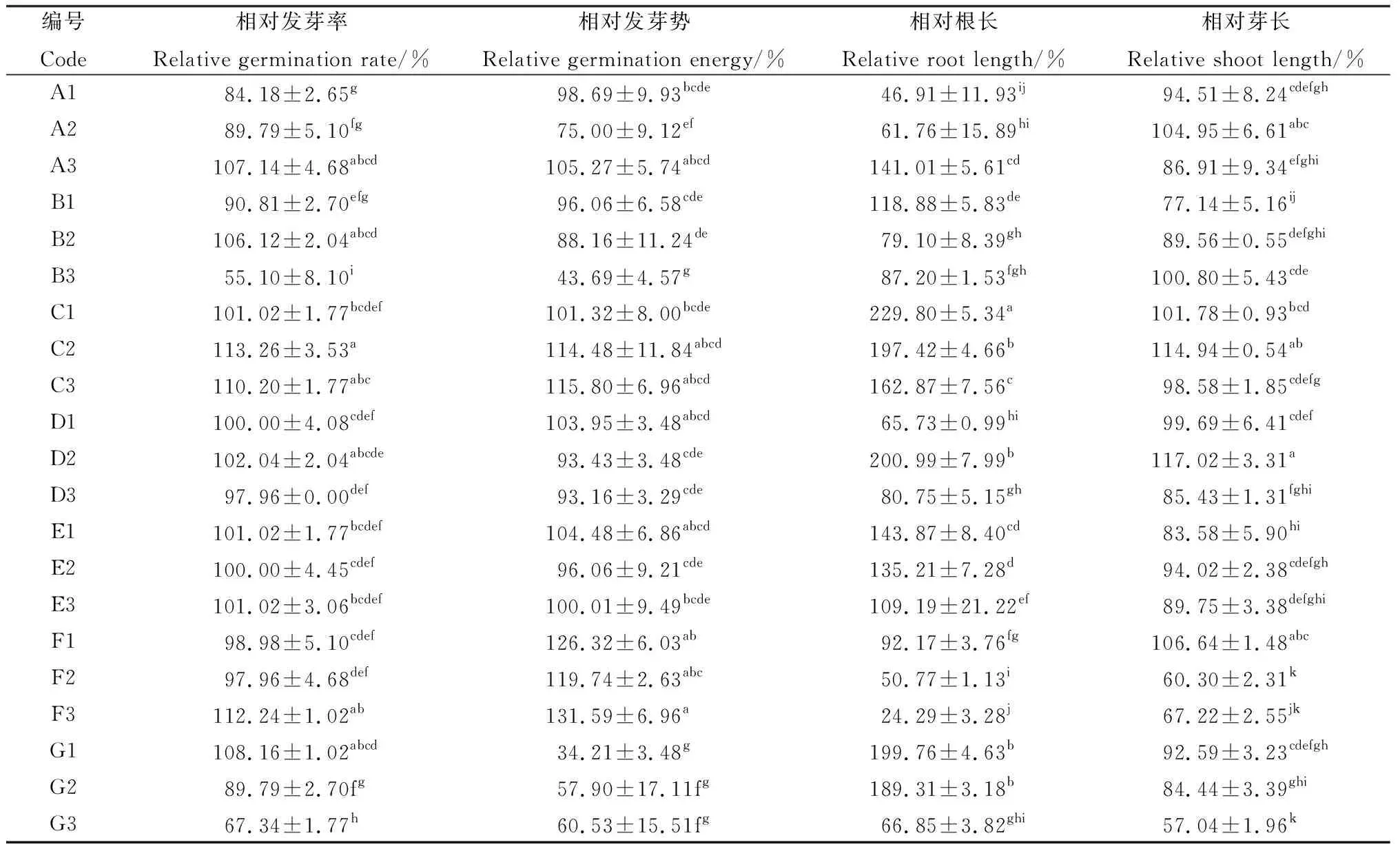
表2 不同处理下藏沙蒿种子的相对发芽率、相对发芽势、相对根长、相对芽长变化Table 2 Changes of relative germination rate,relative germination potential,relative root length and relative bud length of Artemisia wellbyi seeds under different treatments
一般来说,温水浸种处理能够软化种子种皮,但不同温度的温水浸种下对种子萌发影响不同。本研究结果表明,温度过高或过低对藏沙蒿种子的萌发具有一定程度的抑制,B1浸种能够促进藏沙蒿幼苗根的生长,但却抑制芽的生长;仅B2浸种对藏沙蒿种子相对发芽率提高6.12%,是促进藏沙蒿种子萌发的最佳浸种温度,但此温度下其相对发芽势较低,说明温水软化种皮需要一定时间。
GA3和IAA是两种常见的促进种子萌发的激素,比较而言,GA3对于藏沙蒿种子的萌发促进作用较显著。C1~C3,GA3浓度在30~90 mg·L-1范围内,藏沙蒿种子相对发芽率整体呈现上升趋势,其中C2,C3浓度的GA3浸种处理对其相对发芽率促进效果较对照更加显著(P<0.05),其相对发芽率为113.26%,110.20%,分别较对照提高了13.26%,10.20%。尤其是C2浓度GA3浸种处理下藏沙蒿的出苗率整齐、根芽较长,幼苗生长强壮。C3浓度处理下藏沙蒿幼苗相对芽长的变化规律较对照不明显,其他指标与C2浓度的变化规律相一致;D1~D3,IAA浸种对藏沙蒿相对发芽率、相对发芽势的促进作用较对照不明显,且高浓度(≥D2)下有抑制效果。但D2浓度IAA浸种能够显著促进藏沙蒿幼苗相对根芽的伸长(P<0.05)。
不同浓度微量元素E1~E3浸种对藏沙蒿种子相对发芽率、相对发芽势的影响差异不显著。E1微量元素浓度浸种处理,对藏沙蒿幼苗的相对根长促进效果较为显著(P<0.05),相比对照提高43.72%。随微量元素浸种浓度的升高,对其促进作用呈现下降趋势。
藏沙蒿种子的相对发芽率在低浓度(≤F2)的H2O2(F1~F3)处理下降低,高浓度(≥F3)下升高,但不同浓度H2O2处理对藏沙蒿种子发芽势的促进作用均有明显提高。F3处理对藏沙蒿种子相对发芽率、相对发芽势分别提高12.24%,31.58%(P<0.05),说明高浓度H2O2能够促进藏沙蒿种子出苗的整齐度,但对藏沙蒿植株相对根长和相对芽长的伸长较对照具有显著的抑制作用,随H2O2浓度升高,抑制效果越明显(P<0.05)。
随PEG-6000 浓度G1~G3的升高,对藏沙蒿种子相对发芽率的影响呈现低浓度(≤G1)促进,高浓度(≥G2)抑制的变化趋势。相比对照,G1浓度浸泡滤纸下藏沙蒿种子的发芽率提高了8.16%,根长提高了2倍,而发芽势降低了65.78%。这表明G1浓度PEG-6000溶液处理能够提高藏沙蒿种子的发芽率的同时却抑制发芽势,导致藏沙蒿出苗整齐度不高。

图1 各方法处理下藏沙蒿种子萌发状态Fig.1 Germination of Artemisia wellbyi seeds treated by each method

图2 GA3,KNO3,H2O2处理下藏沙蒿种子萌发幼根、幼芽状态Fig.2 Germination of young roots and buds of Artemisia wellbyi seeds treated with GA3,KNO3 and H2O2
2.2 不同处理在不同浓度下对藏沙蒿种子各萌发指标的影响
从表3双因素方差分析结果可以看出,不同处理方法对藏沙蒿的发芽率、发芽势、发芽指数、平均发芽时间、根长以及芽长等指标的影响均达到极显著(P<0.01);不同处理方法的不同浓度对藏沙蒿种子发芽势的影响不显著,对其他指标的影响显著;且不同处理方法和不同浓度的交互作用对藏沙蒿种子各萌发指标的影响均表现为显著(P<0.05)。从F值大小可以看出,不同处理方法对藏沙蒿种子各

表3 不同处理方法和不同浓度对藏沙蒿种子各指标影响的双因素方差分析Table 3 Two factor analysis of variance on the effects of different treatment types and concentrations on the germination indexes of Artemisia wellbyi seeds
萌发指标的影响比浓度最为重要。
2.3 不同方法对藏沙蒿种子发芽指数的影响
由图3可知,A1~A3,随着KNO3浓度的升高,藏沙蒿种子发芽指数呈先降低后升高的变化趋势。B1~B3,随浸种水温的升高,对藏沙蒿种子发芽指数整体表现为抑制作用,B3温度下的发芽指数较对照降低了63.04%,抑制效果显著(P<0.05)。C1~C3,D1~D3,随GA3和IAA浸种浓度的升高,对藏沙蒿种子发芽指数的影响整体呈现上升趋势。E1~E3,不同浓度的微量元素浸种对藏沙蒿种子发芽指数影响不规律,E1微量元素浸种对藏沙蒿种子发芽指数起到促进效果,较对照提高18.78%。F1~F3,H2O2浸泡滤纸对藏沙蒿种子发芽指数较其他处理相比促进作用最为显著(P<0.05),较高浓度H2O2处理对藏沙蒿种子发芽指数较对照有所升高,F2,F3浓度的H2O2浸泡滤纸对藏沙蒿种子的发芽指数较对照相比分别增加了43.97%,41.44%,且差异显著(P<0.05)。G1~G3,G1对藏沙蒿种子发芽指数较对照有一定促进作用,提高了34.36%,而随PEG-6000溶液浓度的升高,藏沙蒿种子发芽指数明显受到抑制。
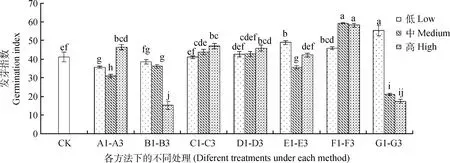
图3 不同方法处理下的藏沙蒿种子发芽指数Fig.3 Germination index of Artemisia wellbyi seeds treated with different methods注:不同小写字母表示不同处理间差异性显著(P<0.05)Note:Different small letters indicate significant differences among different treatments at the 0.05 level
2.4 不同方法对藏沙蒿种子活力指数的影响
由图4可知,对藏沙蒿种子活力指数起到明显促进作用的为C1~C3的GA3各浓度,且激素浸种处理对藏沙蒿种子活力指数的影响具有统计学差异。C1,C2,C3浓度的GA3和D2浓度的IAA浸种显著提高藏沙蒿种子的活力指数(P<0.05),较对照分别提高了125.77%,113.46%,90.21%,112.96%,且随GA3浓度的升高,对藏沙蒿种子活力指数的促进效果逐渐降低。A1,A2浓度的KNO3浸种对藏沙蒿种子活力指数较对照相比起到明显的抑制作用,但A3浓度KNO3浸种对藏沙蒿种子活力指数相比于对照提高了62.48%,起到明显促进作用(P<0.05)。温水浸种对藏沙蒿种子活力指数促进效果不显著,且B3温度的温水浸种对藏沙蒿种子活力指数起到显著抑制作用(P<0.05)。随E1~E3,F1~F3,G1~G3处理浓度的升高,藏沙蒿种子的活力指数呈现逐渐下降趋势,其中,E1微量元素浸种对藏沙蒿种子活力指数起到显著促进作用,较对照增加73.73%。
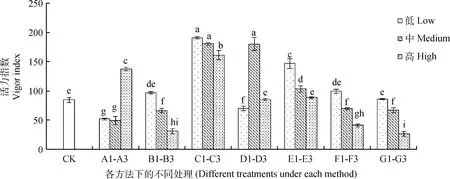
图4 不同方法处理下藏沙蒿种子活力指数Fig.4 Seed vigor index of Artemisia wellbyi treated with different methods
2.5 不同方法对藏沙蒿种子平均发芽时间的影响
由图5可知,与对照相比,A1,A2,A3,B3,C3,D1,F1,F2,F3,G1处理下能够显著降低藏沙蒿种子的平均发芽时间(P<0.05),F处理对藏沙蒿种子平均发芽时间的降低最为显著(P<0.05)。G2,G3处理下平均发芽时间高于对照,说明对藏沙蒿种子的发芽能力有降低趋势。其余处理下藏沙蒿种子的平均发芽时间较对照相比差异不显著。

图5 不同方法处理下藏沙蒿种子平均发芽时间Fig.5 The average germination days of Artemisia wellbyi seeds treated with different methods
2.6 不同方法下藏沙蒿种子萌发的综合评价
利用多个指标来综合性评价打破藏沙蒿种子休眠方法的筛选可以降低单一指标的片面性[23]。本研究以各方法处理下测定的发芽率、发芽势、活力指数、发芽指数、平均发芽时间、芽长、根长等作为打破藏沙蒿种子休眠方法综合评价的指标,通过计算不同方法处理下各指标的隶属函数值并计算平均值进行排序。由表4得出,(C2) 60 mg·L-1GA3,(C3)90 mg·L-1GA3处理下的综合隶属函数值高达0.822,0.763,是打破藏沙蒿种子休眠的较为适宜的方法。

表4 各处理对藏沙蒿种子萌发指标隶属函数值和综合评价Table 4 Subjection function values and comprehensive evaluation of each germination index of Artemisia wellbyi seeds under each treatment
3 讨论
3.1 激素浸种处理对藏沙蒿种子萌发的影响
GA3和IAA是两种常用的促进种子萌发的外源生长调节物质,利用GA3和IAA浸种能够有效打破种子休眠[24]。本研究结果发现,GA3浸种12 h能够有效提高藏沙蒿种子发芽力,提高其活力指数、发芽指数和萌发速度,促进根芽的生长。随GA3浓度的增大,对藏沙蒿种子相对发芽率的促进作用呈现先升高后降低的变化趋势。总体来看,60 mg·L-1GA3浸种(C2)打破休眠的效果最佳。杜芳等[25]研究发现80 mg·L-1GA3对黑心菊种子萌发效果较好。分析原因可知,GA3浸种能够提高种子内a-淀粉酶等多种相关水解酶的活性,这些水解酶将种子胚乳中的贮藏物质分解为非结构性碳水化合物,为种子萌发提供能量和其他养分[26];而高浓度GA3浸种反而会使淀粉酶活性降低,减慢分解淀粉的速度,也会损伤种子的渗透调节系统,从而降低种子萌发[27]。激素IAA浸种对打破藏沙蒿种子的休眠有一定的促进效果,但相比GA3促进效果较弱。向亮等[28]研究发现,1.5 mg·L-1IAA溶液浸种处理翅碱蓬(Suaedasalsa)种子12 h,其发芽率和萌发速率分别提高了17.65%和136.84%,这与本研究中10 mg·L-1IAA浸种12 h(D2)提高藏沙蒿种子的效果类似,但不同植物对于激素的适应浓度有差异。IAA浸种可以诱导和促进植物细胞的分化,参与植物同化物的运输,打破休眠,促进种子萌发[29]。然而,激素对种子的萌发和细胞的生长具有两重性,低浓度促进植物细胞生长,高浓度会抑制植物细胞生长[30]。
3.2 几种试剂处理对藏沙蒿种子萌发的影响
试验采用不同浓度KNO3、微量元素、PEG-6000,H2O2处理藏沙蒿种子对其萌发指标表现出不同程度的差异。低浓度(≤4 mg·L-1)KNO3浸种对藏沙蒿种子的萌发起到抑制作用,可能是KNO3浓度过低对种子的代谢过程和渗透调节物质的影响较小,不足以打破休眠。8 mg·L-1KNO3浸种(A3)对藏沙蒿种子相对发芽率、活力指数以及相对根的伸长较对照具有不同程度的促进效果,主要在于KNO3作为强氧化剂,能够提供氧气加速细胞代谢,同时KNO3也作为营养物质被种子吸收,为种子萌发提供充足养分[31],KNO3中K+是植物体内多种酶的激活剂,可以提高种子内部脱氢酶的活性,促进植株体内有机化合物的合成及运输[32-33],从而打破植物种子休眠,促进萌发。3种不同浓度微量元素浸种对藏沙蒿种子萌发率的影响较对照差异不显著,但却能提高种子的活力指数,促进根的生长,说明低浓度微量元素能够增加种子的新陈代谢,磷、硫、锰、锌、铜、钼等多种功能元素能够迅速进入种子内部,为种子萌发提供充足的营养元素,提高种子活力[34],促进胚芽、胚根的生长。本研究中10%PEG-6000溶液浸泡滤纸能够显著提高藏沙蒿种子的发芽率,但随PEG-6000浓度的升高,对藏沙蒿种子的萌发指标以及萌发速度均表现出不同程度的抑制作用,这可能由于低浓度PEG-6000溶液能够开启种子的自我保护机制,减少种子吸胀过程中膜系统的损伤,提高种子发芽率[35]。而当PEG-6000浓度超过一定值时,对种子的萌发能力起到一定程度的限制作用,细胞内自由基过度积累,对膜系统完整性造成损伤,使渗透调节功能紊乱,抑制了种子的萌发能力[36-37];冯潇[38]研究发现10 mmol·L-1的H2O2浸泡会抑制白沙蒿种子的萌发,50 mmol·L-1的H2O2可以促进其萌发。本研究中30 mmol·L-1H2O2处理能够显著提高藏沙蒿种子的相对发芽率和相对发芽势,但严重抑制根的伸长。说明H2O2作为一种信号分子来参与植物的多种生理过程,对于维持植物细胞内氧化还原平衡具有重要作用[39]。此外,H2O2溶液偏酸性,一定浓度下可以软化种子种皮,有利于营养物质进入种子内部[40];其次,H2O2能够对种子表面起到杀菌消毒的作用,抑制表面细菌的生长,从而打破种子休眠[41]。
3.3 温水浸种处理对藏沙蒿种子萌发的影响
温水浸种是最为简便和节约成本的促进种子萌发的方法。本研究中,30℃温水浸种12 h对藏沙蒿种子相对发芽率较对照有一定促进作用,随浸种温度的升高,对藏沙蒿种子的萌发起到明显抑制效果。说明30℃温水是藏沙蒿种质较为适宜的浸种温度,能够打破种子休眠,提高发芽质量[42]。浸种温度越高,对种子种皮软化程度和透性增强,使得高温度的水分进入种子内部,对种胚造成伤害,降低种子的萌发率[43]。且温度过低或过高会影响种子酶的活性,从而抑制种子萌发[44]。有研究表明,金光菊(Rudbeckialaciniata)[45]、沙生针茅(Stipaglareosa)[46]种子分别在50℃,60℃温水浸种下发芽率最好,说明不同材料的种子对温水浸种的温度适应具有差异性。
3.4 打破藏沙蒿种子休眠的生态学意义
本研究得出60 mg·L-1GA3浓度浸种藏沙蒿种子其发芽率较对照提高13.26%,这在西藏以藏沙蒿为先锋植物的生态环境治理和恢复中具有很高的实用价值,对于改善沙化引起的青藏高寒草地持续退化和生产力不断下降的问题,以及青藏高原高寒草甸地区群落丰富度构建、西藏荒漠地区生态恢复具有生态意义。
4 结论
本研究采用不同温度的温水,不同浓度硝酸钾、赤霉素、吲哚乙酸、微量元素浸种以及不同浓度过氧化氢、聚乙二醇溶液浸泡滤纸等7种方法处理藏沙蒿种子,初步明晰了不同方法处理对藏沙蒿种子萌发及打破休眠的影响规律,并通过模糊隶属函数法综合评价得出30 mg·L-1,60 mg·L-1,90 mg·L-1赤霉素,10 mg·L-1吲哚乙酸浸种处理藏沙蒿种子12 h能够明显提高藏沙蒿种子各萌发指标,打破藏沙蒿种子休眠,有效促进藏沙蒿种子萌发,为后期培育优质藏沙蒿幼苗提供理论基础和研究依据。
