真核重组荧光质粒pEGFP-N1-Et HP的构建及高效转染细胞的筛选
2022-07-07郭许情王黎霞张榕珍张天宇石梦云王诗琪赵小涵张建军
郭许情 , 王黎霞 , 张榕珍 , 张 健 , 张天宇 , 石梦云 , 王诗琪 , 赵小涵 , 张建军 , 安 健
(1. 北京农学院动物科学技术学院 , 北京 昌平 102206 ; 2. 北京农业职业学院畜牧兽医系 , 北京 房山 102442)
鸡球虫病是由一种或多种顶复门艾美尔球虫寄生于鸡肠道上皮细胞导致的寄生性原虫病,对我国的禽养殖业造成了大量直接或间接的经济损失[1]。在公认的几种球虫中,柔嫩艾美尔球虫(Eimeriatenella)在鸡球虫病中最常见,致病性也最强,且基于柔嫩艾美尔球虫的研究也较为广泛。
顶复门原生寄生虫依赖宿主细胞而存活,它们在入侵过程中通过改变细胞的生命活动促使其能在细胞内存活并发育[2]。而鸡球虫在入侵过程中分泌的相关蛋白成为了阻断鸡球虫发育的研究重点,通过各种技术干预这些蛋白的分泌可达到预防鸡球虫病的效果。柔嫩艾美尔球虫假定蛋白(Eimeriatenellahypothetical protein,EtHP)是一种分泌性蛋白,本课题组推测其在柔嫩艾美尔球虫入侵过程中存在重要作用[3],但具体功能尚未深入研究。本试验构建了真核荧光重组表达质粒pEGFP-N1-EtHP,筛选出高效转染的细胞,并检验其在不同种细胞中的表达情况,为进一步探索EtHP蛋白在柔嫩艾美尔球虫入侵寄生过程中对细胞生命活动的影响提供有效的试验工具。
1 材料与方法
1.1 材料 柔嫩艾美尔球虫第2代裂殖子cDNA,真核荧光表达载体pEGFP-N1,Vero、DF-1、BHK、HD-11细胞,均由北京农学院兽医学实验室保存提供;DNA Marker,购自北京天根生化科技有限公司;限制性内切酶SacI/SacII、T4连接酶,均购自美国NEB公司;无内毒素质粒大量提取试剂盒,购自北京索莱宝生物技术公司;LipofectamineTM2000 Transfection Reagent,购自美国赛默飞科技公司;本试验所使用的抗体,均购自北京康为世纪生物科技有限公司。
1.2 方法
1.2.1EtHP基因的克隆 设计引物扩增EtHP基因(JN987269.1)CDS区,长度为450 bp。EtHP-F序列为:5′-cgagctcatggcggatcagcttaccgag-3′,含有SacI酶切位点;EtHP-R序列为:5′-tccccgcggcttcgcaagcatcattcccacgaactcctca-3′,含有SacII酶切位点。PCR反应结束后进行1.5%琼脂糖凝胶电泳鉴定并胶回收。
1.2.2 真核重组荧光质粒pEGFP-N1-EtHP的构建 同时用SacI和SacII对空质粒与胶回收产物进行双酶切,回收的pEGFP-N1和EtHP基因酶切片段按比例混合后加入T4连接酶,16 ℃放置过夜后转化Trans-T1感受态细胞。选取4个单菌落进行PCR鉴定,提取其中鉴定为阳性的质粒送至生工生物工程(上海)股份有限公司测序。使用无内毒素质粒大量提取试剂盒提取pEGFP-N1-EtHP和pEGFP-N1,-20 ℃保存备用。
1.2.3 细胞培养 将冻存的Vero细胞、DF-1细胞、BHK细胞、HD-11细胞复苏,分别用含5%、15%、10%、15% FBS和均含有1%双抗的DMEM培养液进行培养。传2~3代,用于后续试验。
1.2.4 pEGFP-N1-EtHP的转染 选取上述4种生长状态良好的细胞进行铺板。24孔板中加入每种对应的完全培养液500 μL/孔,再以细胞密度1×105个/孔铺被24孔板,每种细胞铺27个孔。确保24孔板内的细胞均匀分布后轻放于37 ℃、5% CO2培养箱中继续培养至密度达80%~90%且状态良好,按照Lipofectamine 2000转染方法进行梯度转染。每种细胞为1个单独的试验,分为3个组:空白组、空质粒组和重组质粒转染组,空质粒组和重组质粒转染组分别设定4个浓度梯度,DNA(μg)∶Lipofectamine 2000(μL)分别为1∶0.5、1∶1.0、1∶1.5和1∶2.0。每个单独的试验设定3个重复。
1.2.5 荧光蛋白表达情况的检测及转染效率的评价 细胞转染48 h后观察并拍摄24孔板中的各组细胞在荧光显微镜100倍视野下的图像;转换为200倍视野,记录每孔随机5个视野中细胞总数和带有绿色荧光的细胞数,参照文献[4]计算转染效率。转染效率/%=(带有绿色荧光的细胞数/细胞总数)×100%。
1.2.6 Western blot检测目的蛋白的表达 收取4种细胞空质粒组和重组质粒转染组中以DNA(μg)∶Lipofectamine 2000(μL)为1∶2.0的比例转染48 h的细胞蛋白,以4∶1的比例加入5×蛋白上样缓冲液,100 ℃金属浴煮10 min,冰浴冷却后,进行SDS-PAGE和转膜。以抗GFP的鼠单克隆抗体(1∶1 000稀释)为一抗,以HRP标记的山羊抗小鼠IgG为二抗,进行Western blot检测。
1.2.7 统计分析 试验结果以“平均值±标准差”的方式表示。采用GraphPad Prism 7软件对数据进行统计学分析,P<0.05表示差异显著。
2 结果
2.1 真核重组荧光质粒pEGFP-N1-EtHP的构建 以E.tenella第2代裂殖子cDNA为模板,用含有SacI和SacⅡ酶切位点的特异性引物扩增后经凝胶电泳分析,发现有与预期大小一致的目的条带,约为450 bp(图1A)。菌液PCR鉴定结果显示,选取的4个单菌落均为阳性(图1B)。测序结果分析显示,EtHP基因插入到pEGFP-N1中,无移码和突变。
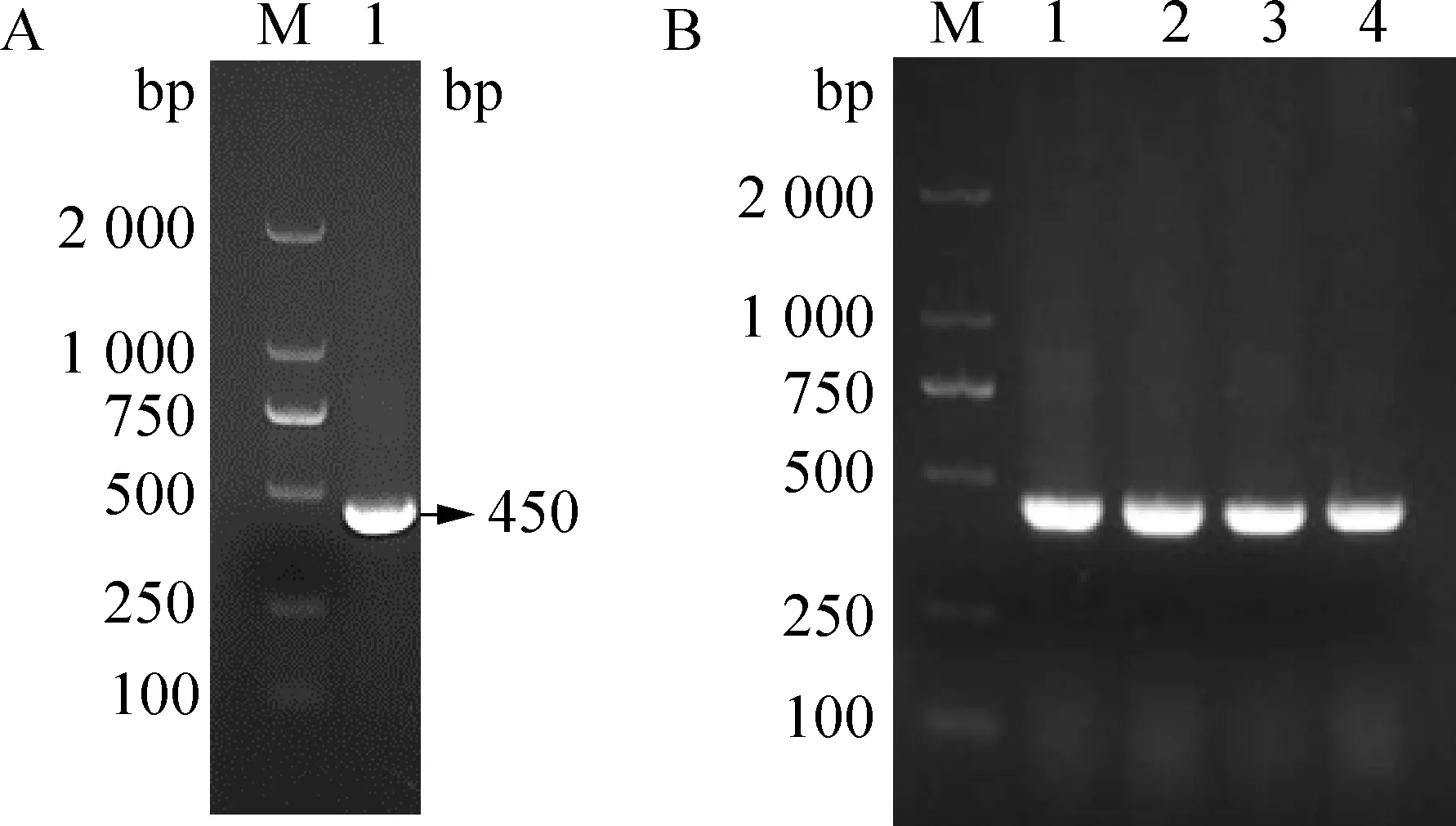
图1 Et HP基因和菌液的PCR扩增
2.2 荧光蛋白表达情况的检测 去内毒素提取的pEGFP-N1-EtHP转染至DF-1细胞、Vero细胞、BHK细胞和HD-11细胞,其中质粒与Lipofectamine 2000的比例分为4个梯度:1∶0.5、1∶1.0、1∶1.5和1∶2.0。转染48 h后在荧光显微镜下观察到,重组质粒转染组均出现绿色荧光(图2F~2I),空白组未出现绿色荧光(图2E),表明真核重组荧光质粒均转染至4种细胞内并成功表达。
2.3 转染率的评价 在同一种细胞中,随着Lipofectamine 2000脂质体浓度增加,绿色荧光明显增多,即转染效率升高(图2,表1)。在DNA(μg)与Lipofectamine 2000(μL)比例相同的情况下,真核重组荧光质粒在DF-1细胞中的转染效率均显著高于其他3种细胞(P<0.05);在 DNA(μg)与Lipofectamine 2000(μL)比例为1∶2.0时,真核重组质粒在DF-1细胞中转染效率最高(表1)。
2.4 Western blot检测目的蛋白的表达 4种细胞蛋白Western blot检测结果如图3所示,重组质粒转染组均在43.5 kDa处均有清晰的特异条带,证明EtHP蛋白在4种细胞中均得到表达。
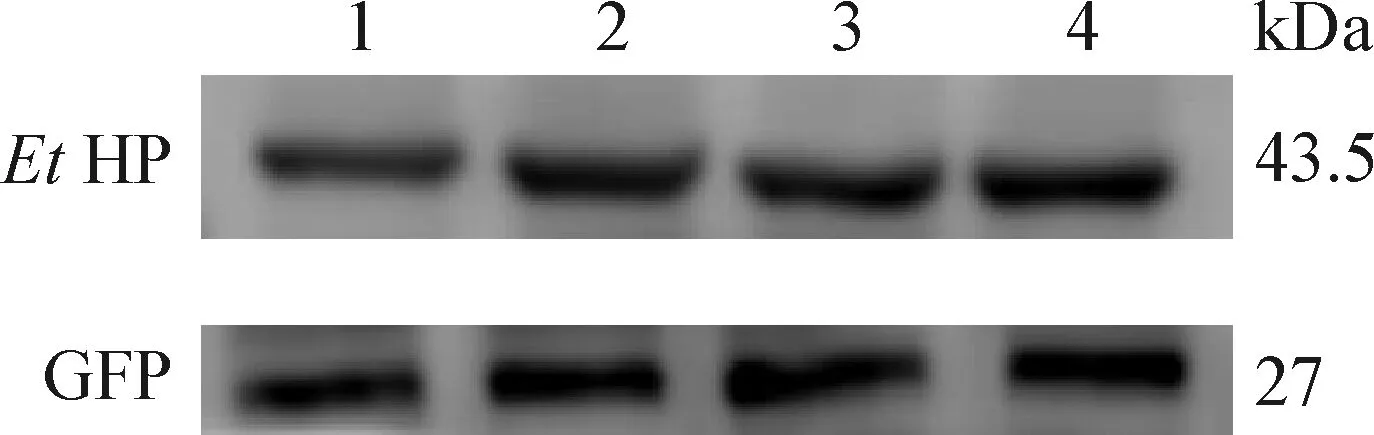
图3 Western blot检测
3 讨论
本试验采用DNA重组技术将EtHP基因插入pEGFP-N1载体后在不同细胞内进行表达,通过直观地观察表达绿色荧光蛋白细胞数的多少来计算转染效率,简易地筛选出目的基因高效表达的细胞。
pEGFP-N1作为表达载体的优点即可以通过倒置荧光显微镜观察绿色荧光蛋白的表达量来计算转染效率,简便、高效和可靠地检测其转染效果和表达情况[5-6]。细胞转染技术作为分析基因产物或外源基因的功能的一个最重要工具[7],被广泛应用。本试验采用目前常用的Lipofectamine 2000脂质体转染的方式,操作较为简便。在转染过程中,化学试剂对细胞产生的毒性往往可以影响转染效率[8]。Dass[9]研究表明,试剂与质粒的比例和细胞的类型不同均可产生不同的细胞毒性。因此,本试验不仅将DNA(μg)与Lipofectamine 2000(μL)的比例分为4个梯度:1∶0.5、1∶1.0、1∶1.5和1∶2.0,而且选择了4种不同的细胞:DF-1细胞、Vero细胞、BHK细胞和HD-11细胞。DF-1细胞[10-12]和HD-11细胞[13]是鸡球虫研究中最普遍使用的宿主细胞,BHK细胞[14]和Vero细胞[15]常被选为真核重组质粒蛋白表达细胞。本试验结果表明,在一定程度上,脂质体浓度的增加可以提高转染效率;脂质体浓度较低时,细胞毒性虽然较小但转染效率极低;BHK细胞和HD-11细胞即使增加脂质体的浓度,转染效率也未见很大幅度的提升,这与其他学者的研究结论不一致[16-17],可能是由于细胞培养状态、质粒的大小、培养基与血清的质量以及转染混合液与细胞的接触时间长短不同,因此转染效率也有所不同。无论DNA(μg)与Lipofectamine 2000(μL)的比例为多少,DF-1细胞的转染效率都较其他细胞高,Vero细胞其次;当DNA(μg)与Lipofectamine 2000(μL)的比例为1∶2.0时,DF-1细胞转染效率显著升高(P<0.05,表1)。同时绿色荧光的多少也更直观的反映了转染效率的高低(图2)。因此,DF-1细胞可作为真核荧光重组质粒pEGFP-N1-EtHP的高效转染细胞。
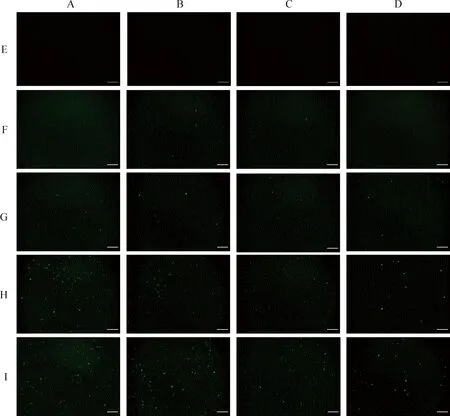
图2 转染后48 h绿色荧光蛋白表达情况(100×,标尺=10 μm)
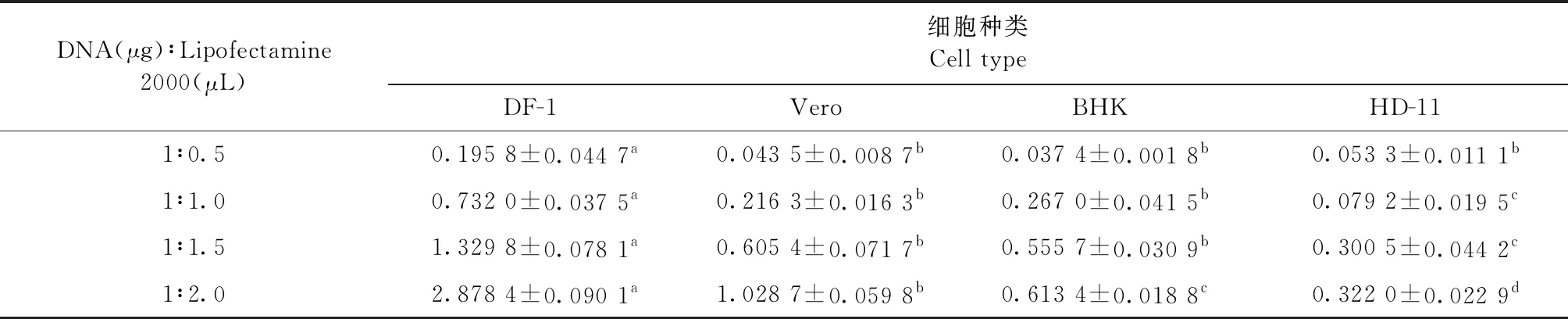
表1 重组荧光质粒在不同细胞中的转染效率
国内有关同一外源基因转入不同细胞转染效率的研究报道尚少。本试验通过简单的转染效率评价,筛选出了pEGFP-N1-Et HP的高效转染细胞即DF-1细胞,为下一步Et HP蛋白在柔嫩艾美尔球虫入侵细胞过程中作用的研究提供了试验基础。
