乳酸菌及其产生的细菌素
2022-07-07唐俊妮
唐俊妮
(西南民族大学食品科学与技术学院,四川成都 610041)
1 乳酸菌的概述
乳酸菌(LAB)是一类异源的非产孢、革兰氏阳性、微需氧、非移动和过氧化氢酶阴性的微生物,包括乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)、酒酒球菌属(Oenococcus)、肠球菌属(Enterococcus)、链球菌属(Streptococcus)、片球菌属(Pediococcus)、四联球菌属(Tetragenococcus)、漫游球菌属(Vagococcus)、明串珠菌属(Leuconostoc)、肉食杆菌属(Carnobacterium)、芽孢乳杆菌属(Sporolactobacillus)和魏斯氏菌属(Weissella)的各种类别[1].这些LAB 广泛用于食品发酵,自古以来就为人类提供了很多益处. 其中的大多数被认为是安全的,并获得美国食品和药物管理局(FDA)的GRAS(Generally Recognized as Safe)认证.LAB 作为食品工业的发酵剂,益生菌和食品补充剂,被认为对人体健康有益[2],其主要特征是能够发酵碳水化合物产生乳酸,这些细菌根据其发酵的最终产物差异分为同型发酵或异型发酵,同型发酵中葡萄糖转化的主要产物是乳酸,而异型发酵中除乳酸外,还产生了其他物质,如二氧化碳、乙酸和乙醇[3].LAB 对低pH 值具有很高的耐受性,作为一种天然的防御机制,乳酸菌自身能够产生多种具有抗菌活性的物质,包括有机酸、过氧化氢和细菌素等. 在食品工业中具有广泛的用途[4].
2 乳酸菌的分子鉴别技术
由于LAB 的异质性,传统的识别与分类主要是基于表型、生化和生理检测,例如,乳杆菌属最早是由Beijerinck 于1901 年提出,其定义为革兰氏阳性、发酵性、兼性厌氧和不形成芽孢的微生物,这种定义很模糊[5].由于传统分类的程序复杂,乳酸菌的营养和生长需求不同,鉴别力较低,有些菌株很难识别,仅限于表型特征对一些新型菌株进行分类会造成模糊不清,因此,需要分子工具进行确认[6-7]. 目前已经应用的分子工具,包括核糖体基因分型(Ribotyping),扩增核糖体DNA 限制性分析(Amplified ribosomal DNA restriction analysis,ARDRA),随机扩增多态性 DNA(Random amplified polymorphic DNA,RAPD),扩增片段长度多态性(Amplified fragment length polymorphism,AFLP),脉冲场凝胶电泳(Pulse field gel electrophoresis,PFGE),重复序列 PCR(Repetitive extragenic palindromic PCR,Rep-PCR),变性/温度梯度凝胶电泳(Denaturing(D)/temperature(T) gradient gel electrophoresis,DGGE/TGGE),末端限制性片段长度多态性(Terminal (T)-restriction fragment length polymorphism,T-RFLP),细菌多位点序列分型(Multilocus sequence typing,MLST),实时-PCR(Real-time PCR),微阵列(Microarrays),质谱(Mass spectrometry,MS),全基因组测序(Whole-genome sequencing,WGS)等[1].这些分子方法的具体特点见表1.
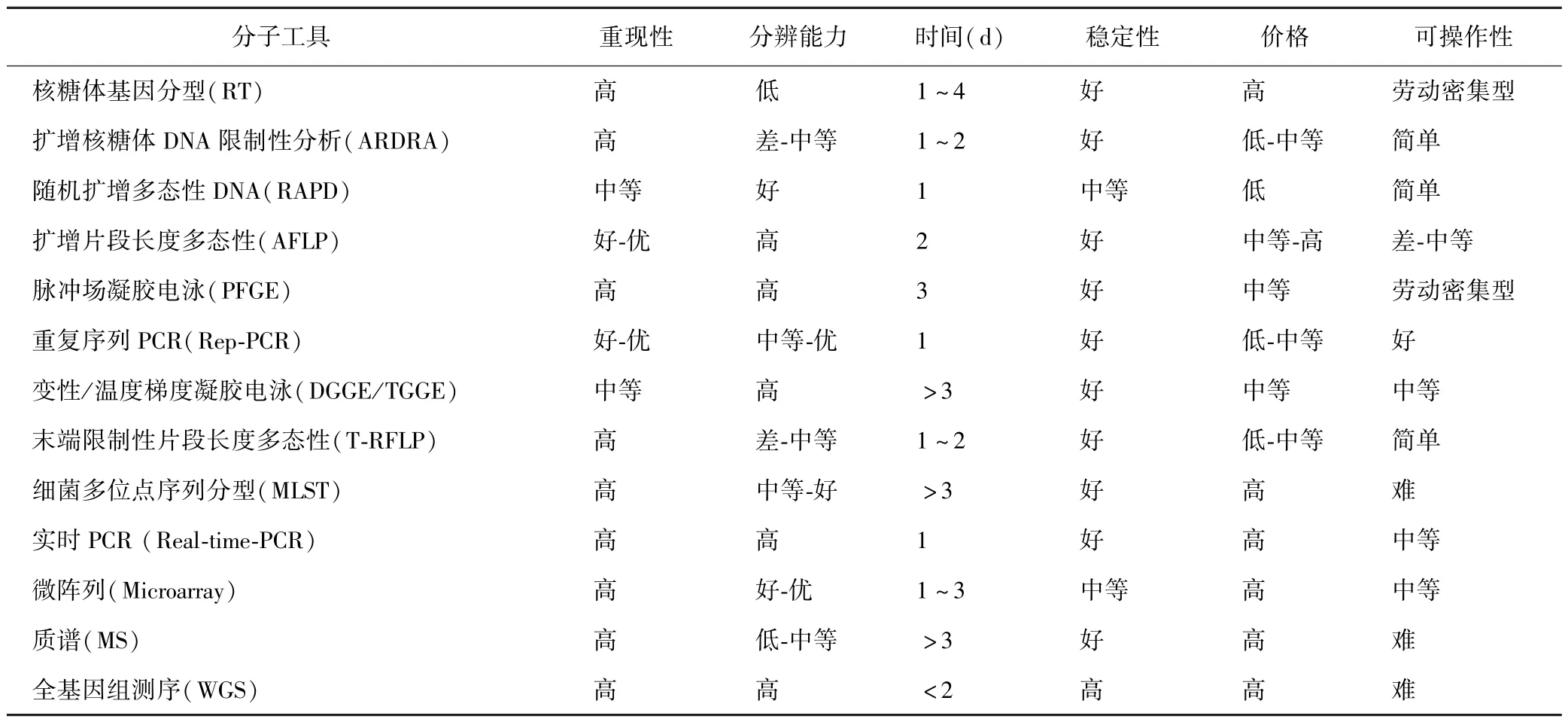
表1 乳酸菌的分子鉴别方法及其特性[1]Table 1 Molecular typing tools of LAB and their characteristics
新的分子工具对于乳酸菌的鉴定起到了非常重要的作用,如最近Zheng 等[5]基于全基因组序列重新评估了乳杆菌的分类学.他们建议将乳杆菌属重新分为25 个类别,包括德氏乳杆菌(Lactobacillus delbrueckii)、副乳杆菌(Paralactobacillus)、霍尔扎普菲儿氏菌(Holzapfelia),淀粉乳杆菌(Amylolactobacillus),蜂乳杆菌(Bombilactobacillus),伴生乳杆菌(Compa-nilactobacillus),石墙乳杆菌(Lapidilactobacillus),农田乳杆菌(Agrilactobacillus),施莱弗乳杆菌(Schleiferilactobacillus),腐败乳杆菌(Loigolactobacilus),乳酪杆菌(Lacticaseibacillus),广泛乳杆菌(Latilactobacillus),德拉格里奥氏菌(Dellaglioa),液体乳杆菌(Liquorilactobacillus),联合乳杆菌(Ligilactobacillus),乳植物杆菌(Lactiplantibacillus),糠乳杆菌(Furfurilactobacil-lus),寡食乳杆菌(Paucilactobacillus),粘液乳杆菌(Limosilactobacillus),果实乳杆菌(Fructilactobacillus),醋乳杆菌(Acetilactobacillus),蜜蜂乳杆菌(Apilactobacillus),促生乳杆菌(Levilactobacillus),次乳杆菌(Secundilactobacillus),迟缓乳杆菌(Lentilactobacillus). 通过重新分类可以反映不同乳酸杆菌在系统发育中的位置.
另外,有学者采用riboprinter(一种自动化工具)在属水平上表征和区分了91 种嗜酸乳杆菌(Lactobacillus acidophilus)和干酪乳杆菌(Lactobacillus casei),riboprinter 工具具有快速、精确且可重复的特征[8].ARDRA 技术也被用于鉴定源自人类胃肠道的14 种参考乳杆菌属(Lactobacillus spp. )[9]. Stenico 等[10]通过RFLP 在种和亚种水平上通过分析热休克蛋白(hsp60)的部分保守基因序列,鉴定了13 种双歧杆菌,这种技术具有快速、简单且具有成本效益的优点,但条带轮廓的复杂性是这种方法的主要限制,需要单独或组合使用多种限制性内切酶来获得所需的分辨率.Weiss 等[11]使用RAPD 技术鉴定了罗伊氏乳杆菌(Lactobacillus reuteri). 目前,RAPD 技术已被广泛用于表征不同的乳酸杆菌菌株,包括植物乳杆菌(L.plantarum)[12],短乳杆菌(L.brevis)[13],嗜酸乳杆菌(L.acidophilus)和发酵乳杆菌(L.fermentum)[14].Sharma 等[1]发现RAPD 也可用作识别酸奶接种和商业益生菌粉中的肠膜明串珠菌(Leuconostocmesenteroides), 短 乳 杆 菌 (L.brevis) 和 植 物 乳 杆 菌(L.plantarum). Plessas 等[15]使用基于 RAPD 分析的多重PCR 技术从奶酪中鉴定出L.paracaseiK5.
随着NGS 和第三代测序技术(包括WGS 和高通量测序)的引入使得基于测序的数据量空前增加. 目前,通过对不同LAB 菌株的完整基因组序列进行测序,可以准确表征菌株,并在基因组水平解释LAB 的功能,此外,WGS 还可以提供有LAB 菌株的耐药性等信息[16].第一个LAB 基因组测序是Bolotin 等[17]对Lactococcuslactis ssp.lactisIL1403 菌株的基因组进行测序,该基因组包含2,365,589 bp,编码2 310 个蛋白质.随后,其他许多LAB 的全基因组序列已经很容易获得.目前,使用广泛的分子技术促进了LAB 菌株的鉴定与分型,可以预见,在不久的将来,这些技术将逐渐取代传统方法. 但也存在一些制约性,由于基于测序的技术只能在设备齐全的实验室中完成,并且需要高素质的人员.对于有限数量的菌株的分析,仍需使用传统方法,未来还需开发具有高判别力、简单、快速且具有成本效益的新技术[1].
3 乳酸菌细菌素的概述与分类
细菌素是细菌产生的蛋白质性质的物质,是一组由20 ~60 个氨基酸组成的不同抗菌阳离子疏水肽,细菌素的编码基因一般位于染色体、质粒或其他可移动遗传元件中的操纵子上[18]. 这些操纵子是可诱导的,细菌素在细胞外释放,具有较窄的抑菌谱,可对与生产菌株密切相关的物种产生杀菌或抑菌作用,但也可影响其他属、门甚至域[19].细菌素作为细菌的次级代谢产物,在细菌生长周期的稳定期产生,环境因素的影响,包括细菌细胞密度、营养的可用性、乙酸的存在和信号肽等会促进细菌素的分泌[20].据报道,细菌素的抑菌活性是其他各种抗菌剂(包括传统抗生素)的103~106倍.因此,产生细菌素的细菌能够合成自身免疫蛋白,通过清除细菌素或受体细菌素的拮抗剂竞争来保护它们自己免受细菌素的侵害[21]. 尽管已知革兰氏阳性菌和革兰氏阴性菌都会产生这些抗菌肽,但LAB 是细菌素的主要生产者,从LAB 分离出的细菌素在食品工业中作为生物防腐剂和对抗人类食品病原菌占有有用的地位,LAB 产生的细菌素的应用也越来越广泛[22].
随着细菌素的多样性和复杂性,细菌素的分类也在不断发展变化[23]. 细菌素的分类主要是基于其本身的物理化学性质、分子量大小、结构中包含的特定氨基酸、热稳定性、涉及的环状分子遗传学特征,以及含有其他化合物如脂质或碳水化合物等[4].革兰氏阴性菌的细菌素主要来自肠杆菌科家族(Enterobacteriaceae),根据其分子量分为两类:包括较高分子量的大肠菌素(Colicins)和较低分子量的小菌素(Microcins).而由革兰氏阳性菌产生的细菌素可进一步分为四个不同的类别[22],这四类细菌的特征详见图1.
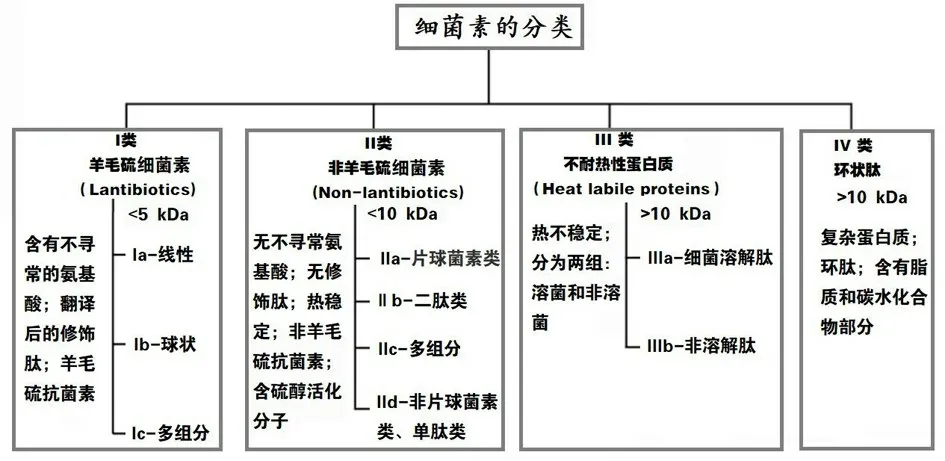
图1 乳酸菌细菌素的分类与特征[22]Fig.1 Classification and characteristics of LAB bacteriocins
I 类细菌素被称为羊毛硫细菌素(Lantibiotics),是由不寻常的肽、羊毛硫氨酸和β-甲基羊毛硫氨酸组成,如图2 所示. 最常见的I 类细菌素是乳酸链球菌素(Nisin)、肠球菌素(Enterocin)和枯草菌素(Subtilin),它们含有多环硫醚氨基酸、脱氢丙氨酸和氨基丁酸等不饱和氨基酸[24]. 虽然这类细菌素的分子量小于5 kDa,但它们热稳定性好,根据形状和电荷可进一步分为3 个亚型:Ia、Ib 和Ic.II 类细菌素称为非羊毛硫细菌素,是由常见氨基酸组成的未经修饰的肽类,该类细菌素由4 个亚类组成,也是一种热稳定肽,Ⅱ类细菌素相比于Ⅰ类、Ⅲ类和Ⅳ类细菌素具有更强的稳定性和抑菌活性以及更广的抑菌谱[25],它们的分子量小于10 kDa,片球菌素(Pediocin)和乳杆菌素(Lactacin)是该类中研究广泛的细菌素.III 类细菌素的分子量大于10 kDa,它们对热不稳定,包括细菌溶解肽和非溶解肽,其中,溶葡萄球菌素(Lysostaphin)是一种研究较为充分的溶菌素,另外,肠溶素A(Enterolysin A)也得到了一定的研究. 第IV 类细菌素是由复杂的环肽组成,其中包括脂质和碳水化合物,目前对这一类细菌素仍知之甚少[22].
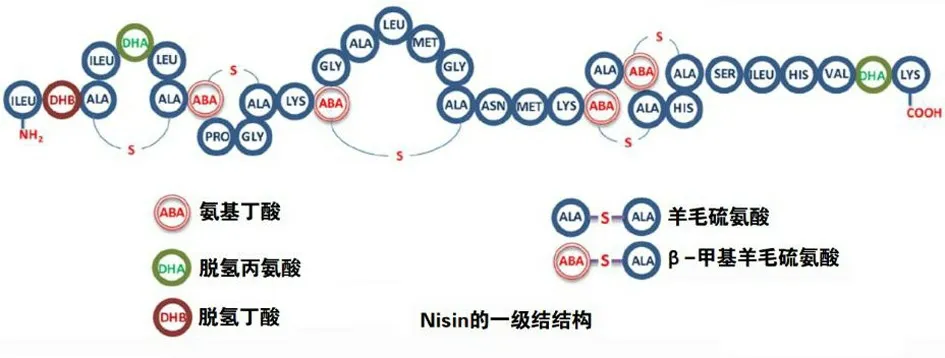
图2 Nisin 的一级结构[24]Fig.2 Primary structure of nisin
4 乳酸菌细菌素的生物合成
乳酸菌细菌素是由核糖体合成的多肽、蛋白质或蛋白质类复合物,在生物学上最初是无活性的,经过修饰成为具有生物活性的物质.新合成的细菌素含有一个N 末端前导,在它们被输出到细胞外之前,会被细菌素基因簇编码的蛋白质或氨基酸修饰,如通过丝氨酸和苏氨酸残基脱水形成的硫醚交联,随后将半胱氨酸立体选择性地添加到不饱和氨基酸上[26]. 具有生物学意义的细菌素必须从细胞中分泌出来[27]. 针对I 类细菌素的合成,以Nisin 为例进行说明,如图3,Nisin 由包含nisA、nisB、nisC、nisP 和nisT 等基因簇编码,nisA 基因转化为 NisA 前体肽,然后通过nisB 和nisC 基因产物转化为 NisA,NisA 通过nisT 和nisP 的帮助下输出到细胞外,这个过程进一步伴随着前导肽的切割,最终产生成熟的Nisin[28].

图3 Nisin 生物合成示意图[28]Fig.3 Schematic representation of nisin biosynthesis
Ⅱ类细菌素的分泌机制一般采用双甘氨酸引导序列转运系统,也有一些是信号依赖性,由分泌途径转移膜蛋白系统进行加工和转运. 此外,大多数I 型和II 型细菌素通过特定的ABC 转运系统转移到细胞外[29].II 类细菌素还可产生激活调控基因转录的诱导因子,这种诱导因子构成负责II 类细菌素生物合成信号转导系统的一部分[30].对于环状细菌素,尽管目前也观察到前导肽的切割、环化和转运到细胞外空间等步骤的独立发生,但还很难理解其生物合成的具体过程,大多数乳酸菌细菌素的生物合成仍是个谜[22].
对于细菌素的表达,受外部诱导因子的调节,如温度和pH 等培养条件以及培养基的性质和组成会影响细菌素的产量[31]. Goh 和Philip[32]使用MRS 培养基从融合魏斯氏菌(Weisellaconfusa)产生一种称为Weisellicin 的细菌素,细菌素在培养8 h 后开始形成,并在18 h 内达到最佳产量. 细菌素的抗菌活性在生长18 至24 h 之间持续,但在28 h 后开始下降. Elayaraja 等[33]发现 35 °C 和 pH 6.0 是从海洋沉积物中分离的鼠乳杆菌AU06(Lactobacillus murinusAU06)生产细菌素的理想条件. Malheiros 等[34]从发酵肉中分离一株Lactobacillus sakeisubsp.Sakei2a,通过使用响应面法,发现在MRS 肉汤中添加5.5 g/L 葡萄糖和1.05% Tween 20,在 pH 6.28 和 25 °C 孵育是该菌产细菌素的最佳优化条件. 肖珊等[35]研究了乳酸菌产细菌素的生物学特性并优化其培养条件,认为最佳培养条件为初始pH 为6.5、接种量4%,发酵温度35 ℃时,细菌素抑菌活性比优化前提高了1.36 倍. 可见,细菌素的产生须针对培养基、温度和pH 等条件进行优化.
5 细菌素的作用机制
细菌素的作用机制取决于它们的一级结构,大多数细菌素直接作用于细胞膜或靶细胞上的特定受体,通过在细菌细胞膜上形成孔,导致细胞死亡. 有些细菌素也可进入细胞质,并影响基因表达和蛋白质合成[36].I 类细菌素(羊毛硫细菌素)作用机制主要通过静电相互作用(楔状孔)或通过与脂质II 结合在靶膜中形成孔,如图4 所示,脂质II 的形成分为两个步骤:(1)UDP-N-乙酰胞壁酰五肽通过酶MraY 与磷酸十一碳二烯酯连接获得脂质I;(2)脂质I 通过MurG 酶将一个N-乙酰氨基葡糖与N-乙酰胞壁酰基连接,得到脂质II,脂质II 跨膜转移到外侧并寡聚化形成细胞壁[37].I 类细菌素(羊毛硫细菌素)通过与脂质II(肽聚糖单体的疏水载体)结合抑制细菌细胞壁的生物合成,从而损害细胞活力.I 类细菌素通常是具有阳离子性质的肽,这些阳离子肽与细胞质膜的阴离子表面相互作用,含有大部分带正电残基的C 末端区域通过静电相互作用与细胞质膜中阴离子磷脂的头部基团结合.羊毛硫细菌素插入细胞质膜通常是由其N 末端区域的疏水残基介导.
学者们提出了两种不同的羊毛硫细菌素孔形成模型:“桶形”和“楔形”模型[38]. 在桶形模型中,羊毛硫细菌素单体通过静电相互作用,随着膜的疏水脂质核心与细菌素的非极性侧链相互作用,形成类似充满水的孔(图4),桶形孔的大小和稳定性取决于肽的数量多少.在楔形模型中,由于阳离子细菌素与阴离子磷脂的头部基团之间的相互作用,观察到膜的局部变形,从而允许细菌素的疏水残基插入内部膜. 细胞质膜孔的形成会伴随着自由能的增加,细菌细胞在代谢阶段产生跨膜电势(Δψ)被认为是主要的驱动力. 孔的形成也会受pH 值影响,在高pH 条件下,Nisin 单体在膜外聚集,显著降低其活性. 羊毛硫细菌素与聚异戊二烯连接的细胞壁前体脂质II 的结合可以促进孔的形成[39].体外实验表明,脂质II 的存在能够显著增加Nisin 的活性,对Nisin 和脂质II 相互作用的核磁共振分析表明,Nisin 骨架和焦磷酸结构域之间存在五个分子间氢键网络,其他研究也揭示了在N 末端区域存在一个保守的 Motif,该Motif 参与脂质II 结合,并且该Motif 也存在于其他Ia 型羊毛硫细菌素中,如Subtilin、Epidermin、Gallidermin 和 Mutacin 等. 除了形成高度特异性的孔外,Nisin 还可以通过与脂质II 的结合来抑制细胞壁合成.Ib 型羊毛硫细菌素的结构与Nisin 完全不同,它们通过与脂质II 形成复合物来阻碍肽聚糖生物合成过程中的转糖基化反应.这两种羊毛硫细菌素中高度保守的环状结构可能与抗菌活性有关[37].

图4 I 类细菌素(羊毛硫细菌素)作用机制示意图[37]Fig.4 The schematic diagram of class I bacteriocins (lantibiotics) action mechanism
II 类细菌素(非羊毛硫细菌素),如类片球菌素和单肽类非片球菌素(IIa 类和IId 类),可与甘露糖磷酸转移酶-通透酶(Man-PTS)的 MptC 和 MptD 亚基结合.这些细菌素插入靶细胞膜,会导致膜通道的不可逆打开,离子通过膜扩散,从而导致靶细胞死亡. IIb类,是未经修饰的二肽类细菌素,可渗透敏感细菌的膜形成孔,这些孔对单价阳离子(Na + 、K +、Li +、Cs+和Rb +)具有特异性.多组分细菌素(IIc 类)具有正净电荷,这些肽直接与带负电荷的细菌膜相互作用,不需要任何受体分子,在细胞膜中形成孔,使得离子流出和膜电位消散,导致细胞死亡.
III 类细菌素是作用于细菌细胞壁的内肽酶,如细菌溶解肽(IIIa 类细菌素)可催化细胞壁水解,导致细胞裂解.非溶菌性细菌素(IIIb 类)是通过扰乱细胞对葡萄糖的摄取,使它们挨饿和扰乱膜电位发挥作用[21].有些细菌素还可以通过跨膜作用进入细胞,干扰细胞的正常生命活动,抑制目标细菌的DNA 和蛋白质的生物合成[40].
6 不同乳酸菌产生的细菌素
乳酸菌可作为发酵剂、生物防腐剂甚至益生菌,在许多不同类型食物生产中发挥着重要作用. 应用LAB 被认为是食品保存的最古老方法之一.乳酸菌细菌素通常根据生产菌株的属或种进行命名,例如,Lacticin 和Nisin 由乳球菌属产生,Enterocin 由肠球菌属产生,Pediocin 由片球菌属产生,Leucocin 由明串珠菌属产生,等. 如Todorov 等[41]描述了不同种类的细菌素 Nisin(I 类)、Pediocins(IIa 类)、Plantaricins(IIb类)、部分Enterocins(一些属于IIc 类)和Durancin(IV类)对梭菌属具有拮抗活性.随着科学的发展,学者对细菌素的鉴定有了很大的进步,BAGEL 等数据库为鉴定细菌素编码基因提供了平台,通过BAGEL 数据库分析乳酸菌的基因组,目前一共产生了785 个细菌素基因簇[42].在这里,只讨论几个主要的乳酸菌属及其合成的细菌素.
(1)乳球菌及其产生的细菌素
乳球菌是一类中温乳酸菌,是乳制品行业使用最广泛的发酵剂,用于生产各种发酵食品,如奶酪、酸奶和奶油酪乳等.它们可以在牛奶和发酵蔬菜中很好地生长,并且不需要额外的化合物或其他促进细菌,此外,它们可以利用多种底物,在微需氧或厌氧条件下存活,产生酸(乳酸、乙酸、丙酸等),并降低pH 值和氧化还原电位.
乳球菌产生的细菌素和抗真菌化合物对许多食品腐败和产毒微生物具有活性,并能够赋予发酵食品多种特性[43].乳球菌属的成员主要分为五种:乳酸乳球菌(Lactococcuslactis)、加氏乳球菌(Lactococcusgarviea)、鱼乳球菌(Lactococcuspiscium)、植物乳球菌(Lactococcusplantarum)和乳球菌棉籽糖亚种(Lactococcusraffinolactis).在这五种乳球菌属中,以乳酸乳球菌(Lactococcuslactis)特征最为明确,在奶酪生产中具有重要经济价值,易于生长和操作,是工程研究的模式生物.乳酸乳球菌在遗传上又被细分为四个亚种:L.lactis subsp.lactis,L.lactis subsp.hordniae,L.lactissubsp.cremoris, 和L.lactis subsp.tructae.L.lactis subsp.lactis通常与乳制品和蔬菜发酵有关,其主要风味形成酶是转氨酶和谷氨酸脱氢酶,转氨酶在发酵乳制品时催化氨基酸向对应的α-酮酸(α-酮戊二酸)转化,谷氨酸脱氢酶在发酵非乳制品时将谷氨酸转化为α-酮戊二酸.该菌株的一个重要特征是无法在人体胃肠道(GIT)中定殖,但可抵抗胃酸和胆汁,能够通过GIT.乳酸乳球菌是第一个完成基因组测序的LAB,通过测序能够更好地了解其遗传和生理机制[3].
乳球菌通常产生1 类细菌素,I 类羊毛硫细菌素也是迄今为止探索最多的细菌素,如Nisin 是最具特色的细菌素.迄今为止,已发现了8 种Nisin 变体(称为 A、Z、F、Q、U、U2、P 和 H),分别由Lactococcus spp.(A、 Z、 F、 Q),Streptococcus uberis( U、 U2 )),S.hyointestinalis( H),S.suis和S.gallolyticus subsp.pasteurianus(P)产生.在实验室条件下以及在商业食品中,Nisin 对一系列病原菌具有活性.Nisin 在许多国家被许可作为食品添加剂,并已成功应用于控制不同的食源性病原菌,包括金黄色葡萄球菌、单增李斯特菌等.如Leriche 等[44]通过竞争和排除实验确定了乳酸乳球菌L.lactisCNRZ 150(NisinZ 的生产者)对单增李斯特菌生物膜形成的影响. Nisin A 和NisinZ 具有34 个氨基酸,仅在第27 位处有一个氨基酸不同,它们的活性非常相似,但溶解度存在差异.众所周知,与Nisin Z 相比,Nisin A 更易溶于酸性pH 溶液[45].Rodrigues 等[46]的研究发现乳球菌属也可能成为临床乳腺炎的新兴病原体,乳球菌属作为致病菌出现可能与促进它们生长和进入乳房的环境变化有关,或者与改进的生化和先进的分子技术有关,尽管链球菌属经常被认为是临床乳腺炎样本中最常见的分离病原体之一,但新的技术(如MALDI-TOF)能够准确鉴定乳球菌属,而不再是错误分类为链球菌属[47]. 因此,未来在乳球菌应用上,一定要对具体的菌株进行安全性评价.
(2)乳杆菌及其产生的细菌素
乳杆菌属是传统发酵乳饮料和传统发酵食品中常见的发酵剂,有着广泛的健康益处,如抗菌活性;胆固醇代谢;免疫调节;抗氧化作用;抗糖尿病作用;抗过敏和抑制肿瘤作用等,这些益处和机制与特定乳酸杆菌种属或菌株有关[48]. 如植物乳杆菌至少可以产生六种不同的细菌素,其中,plantaricin 也是已知最重要的细菌素之一.Zhang 等[49]从中国传统发酵乳制品中分离出来的植物乳杆菌(Lactobacillus plantarumJ23),产生的细菌素 J23 在 100 ℃,30 min 表现出热稳定性,pH 稳定性范围在2.0 ~12.0 之间,对单增李斯特菌的抗菌活性强,认为细菌素J23 在食品工业中具有潜在的应用前景. Ben Omar 等[50]从刚果发酵玉米产品poto 中分离出产细菌素的L.plantarumC11 对肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌、产气大肠杆菌、蜡状芽孢杆菌、粪肠球菌和单增李斯特菌具有抑菌活性,并可用于提高发酵玉米产品poto 的安全性和贮藏稳定性. Zhao 等[51]从中国传统发酵酸菜中分离出植物乳杆菌JLA-9,并纯化得到一种新的细菌素plantaricin JLA-9,该细菌素对革兰阳性菌和革兰阴性菌以及芽孢杆菌属表现出广谱抗菌活性,具有热稳定性(20 min,121 °C),认为 plantaricin JLA-9 在控制芽孢杆菌属具有潜在的应用价值. Song 等[52]从发酵芥末中分离 plantaricin ZJ5,具有极高的pH 和热稳定性,对金黄色葡萄球菌有很强的活性,使用基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS)发现plantaricin ZJ5 的分子量为2572.9 Da.使用氨基酸测序和DNA 测序确定该肽的一级结构,为44 个残基的前体,其中含有22 个氨基酸的N 端延伸,属于双甘氨酸类型.与数据库中可用的细菌素序列相比,细菌素序列与已知细菌素没有同源性,表明是一种新的IId类细菌素[42].可见,新型细菌素的开发将具有广泛的应用前景.
(3)肠球菌及其产生的细菌素
肠球菌是继乳杆菌属和乳球菌属之后的第三大乳酸菌,它也是人类和动物胃肠道中普遍存在的细菌,广泛存在于蔬菜、肉类、牛奶和奶酪中. 杨珍珠等[53]从鲜羊奶中筛选获得2 株粪肠球菌(DH9003 和DH9012)和1 株乳酸乳球菌(DH9011).3 株乳酸菌的抑菌产物具有细菌素的特征(耐高温和蛋白酶处理后失活),且在低质量浓度条件下(MIC50 和4MIC50)可阻止单增李斯特菌生长,具有益生菌特质及应用价值.尽管人们担心肠球菌作为重要的机会病原体存在可能会导致多种感染,但它们表现出多种功能,大多数从肠球菌中鉴定的细菌素属于II 类.目前已经报道了肠球菌细菌素的纯化和遗传特征,其中大部分来自粪肠球菌(E.faecalis)和屎肠球菌(E.faecium)[42,54].由于这些细菌素中的一些不能根据传统分类与典型LAB 细菌素归为一类,Franz 等[55]提出将 Enterocins分为四个新类别,该分类方案主要基于结构差异和氨基酸序列.尽管肠球菌细菌素通常对许多食源性致病菌具有抑制作用,但使用肠球菌作为起始培养物的缺点是它们不具有GRAS(通常被认为是安全的)认证.因此,在使用时必须对发酵剂培养物或产细菌素的肠球菌进行潜在毒力因子以及抗生素抗性基因的筛选与评价.
7 结语与展望
本文概述了乳酸菌及其产生的细菌素,特别是细菌素的特性、来源与分类、生物合成与潜在应用,以及影响因素等. 强调了正确选择适用于食品工业LAB菌株的重要性.LAB 作为细菌素的主要生产菌株,其产生的细菌素是一种多功能的抗菌剂,具有明显的效力,可用作生物防腐剂、抗生素替代品、促进肠道健康的调节剂和动物生长促进剂.未来要充分利用细菌素作为抗菌肽的潜力,通过对LAB 的基因组广泛挖掘,为细菌素的应用开辟更广泛的可能性.
