樱桃中溴形态分析方法及其在熏蒸过程追溯中的应用
2022-07-07吴池莹张润何邓晓军盛永刚蔡文瑄陈仲兵杨晓君赵超敏
吴池莹,张润何,邓晓军,盛永刚,蔡文瑄,谢 敏,陈仲兵,杨晓君,赵超敏,樊 祥
(上海海关,上海 200135)
樱桃是国内最受欢迎的进口水果之一,在国内占有极大的市场份额。樱桃在种植过程中易受到实蝇、蛾类、真菌等病虫害的影响,为防止地中海实蝇、欧洲樱桃实蝇等检疫性有害生物的危害,我国与土耳其、澳大利亚、阿根廷等多个国家签订的输华植物检疫要求议定书均规定,输华樱桃须在出口前或运输途中经过冷处理、熏蒸处理等预防性检疫处理后方可入境。冷处理耗时较长,并需要先进的制冷设备,处理后易造成冻伤,樱桃由于货值高、时效性强,一般采用空运运输的方式进口,检疫处理方式会选择耗时更短的熏蒸处理。目前熏蒸普遍使用的药剂为溴甲烷,它有广谱、高效等特点,熏蒸后残留气体迅速挥发,具有极高的经济性。由于对环境与人体的危害性,欧盟从2010年3月18日起在其成员国内部禁止所有用途溴甲烷的使用,我国农业部2552号公告也禁止了溴甲烷在农业用途使用,国内外现已有不少新型熏蒸剂的研究,但溴甲烷仍无法彻底被替代。溴甲烷易挥发,在熏蒸过程追溯上有一定困难,溴离子是溴甲烷的代谢产物,国际上参考联合国粮农组织和世界卫生组织给出的人体每日溴摄入量1 mg/kg制定了溴离子限量。我国GB 2763—2019《食品中农药最大残留限量》中现暂无樱桃中溴甲烷和溴离子限量要求,欧盟、日本和美国樱桃中溴离子都设有限量为20 mg/kg,随着溴甲烷熏蒸的使用,溴残留的研究将会起到重要的作用。
目前,对溴元素的研究大多集中在水质和面粉制品上,对果蔬中溴形态的分析技术研究相对较少。食品中溴化合物的检测方法主要有液相色谱法、离子色谱法、电感耦合等离子体质谱法、高效液相色谱-串联质谱法等,前处理方法主要有微波萃取法、超声提取法、碱法消解等。近年来随着仪器联用技术的快速发展,高效液相色谱-电感耦合等离子体质谱(high performance liquid chromatography-inductively coupled plasma mass spectrometry,HPLC-ICP-MS)法以仪器普及率高、灵敏度高、抗干扰能力强等优点,广泛应用于砷、汞、铬、硒及卤素等元素的形态分析中。
本研究参考各类检测方法,通过优化条件参数,建立一种HPLC-ICP-MS法分析熏蒸后樱桃中溴残留的形态,并使用ICP-MS测定樱桃中总溴含量,顶空进样-气相色谱-电子捕获检测器(gas chromatography-electron capture detector,GC-ECD)法测定樱桃中溴甲烷残留量,用于对比和确证。本方法前处理操作简便、分析迅速、灵敏度高,适用于樱桃中溴形态的分析,以及溴甲烷和总溴含量的快速检测。通过研究熏蒸前后樱桃中溴甲烷残留量和无机溴含量的变化情况,验证溴甲烷熏蒸与溴残留的关系,对樱桃的熏蒸过程进行追溯,旨在为水果的进出口风险监控和质量控制提供方法和依据。
1 材料与方法
1.1 材料与试剂
进口新鲜樱桃共6 批次各3 kg。
溴酸根标准溶液(1 000 mg/L) 美国Inorganic Ventures公司;溴离子标准溶液(1 000 mg/L)、溴甲烷标准品(2 000 mg/L) 美国O2si公司;铑标准溶液(1 000 mg/L) 国家标准物质中心;硝酸(优级纯)、氨水(分析纯)、氯化钠(分析纯) 上海国药集团化学试剂有限公司;25%四甲基氢氧化铵溶液上海安谱实验科技股份有限公司。
1.2 仪器与设备
8800 ICP-MS仪、1260 HPLC仪、7890 GC-ECD仪安捷伦科技有限公司。
1.3 方法
1.3.1 样品制备
获取6 批次进口樱桃各3 kg,选择中等大小、较为饱满的果实,各分为2 份,一份作为未熏蒸比对,一份按照土耳其樱桃3 h熏蒸法再次进行熏蒸。熏蒸条件:20~22 ℃,溴甲烷投药量145 g/m,常压处理3 h。熏蒸完毕后,放置于0 ℃左右冷藏保存。制样时,每次取100 g左右樱桃,去核匀浆,现制现用。
1.3.2 溴形态的分析
1.3.2.1 样品前处理
称取试样1.0 g(精确至0.001 g)于50 mL离心管中,加入25 mL去离子水,振荡2 min,超声提取30 min,每隔5 min振摇一次,8 000 r/min离心5 min,吸取上层清液,经0.45 μm滤膜过滤后,用HPLC-ICP-MS测定。
1.3.2.2 ICP-MS仪器条件
射频功率1 550 W;等离子气流速16.0 L/min;雾化气流速1.05 L/min;雾化室温度2 ℃;蠕动泵转速0.3 r/s;检测模式:氧反应模式;检测质量数79。
1.3.2.3 HPLC条件
色谱柱:Hamilton PRP-X100(250 mm×4.1 mm,10 μm);流动相:36 mmol/L硝酸+67 mmol/L氨水,pH 9.0;流速1.0 mL/min;进样量50 μL。
1.3.2.4 测定步骤
用去离子水配制2.0、10.0、20.0、50.0、100.0 μg/L溴离子和溴酸根混合标准工作液,进行HPLC分析,以保留时间定性,色谱峰面积定量,绘制标准曲线,对样品溶液进行分析,根据回归方程获得试样中溴形态的质量浓度。
1.3.3 总溴含量的测定
1.3.3.1 样品前处理
称取试样1.0 g(精确至0.001 g)于50 mL离心管中,加入0.5%四甲基氢氧化铵溶液25 mL,振荡2 min,超声提取20 min,放入烘箱中(90±5)℃恒温消解30 min,待冷却至室温,经塞脱脂棉的漏斗过滤后,用ICP-MS测定。
1.3.3.2 ICP-MS仪器条件
射频功率1 600 W;等离子气流速16.0 L/min;雾化气流速1.0 L/min;雾化室温度2 ℃;扫描次数30 次;重复次数3 次;积分时间1 s;蠕动泵转速0.3 r/s;扫描方式:跳峰;检测模式:氧反应模式。
1.3.3.3 测定步骤
用0.5%四甲基氢氧化铵溶液配制0、2.0、10.0、20.0、50.0、100.0 μg/L溴标准工作溶液。用0.3 mol/L的硝酸溶液配制铑内标溶液20.0 μg/L。选择溴Br为待测元素,铑Rh为内标元素,在线加入内标,测定标准工作溶液和样品溶液,根据回归方程获得试样中总溴的质量浓度。
1.3.4 溴甲烷残留量的测定
1.3.4.1 样品前处理
称取试样10.0 g(精确至0.001 g)于20 mL顶空进样瓶中,加入5 mL饱和氯化钠溶液,密封,40 ℃恒温30 min,用GC-ECD测定。
1.3.4.2 GC条件
色谱柱:Agilent DB-5(30 m×0.25 mm,0.25 μm);载气流速1.0 mL/min;进样量200 μL;分流比20∶1;柱温70 ℃;进样口温度100 ℃;检测器温度300 ℃。
1.3.4.3 测定步骤
根据试样中溴甲烷含量,吸取一定量的标准储备液,用饱和氯化钠溶液配制成适当质量浓度的标准工作溶液,现用现配。将标准工作溶液与试样同时进行GC分析,计算试样中溴甲烷的残留量。
2 结果与分析
2.1 质谱条件的选择
溴元素电离能较高,在ICP-MS上响应较低,选择较高的射频功率增强仪器灵敏度。溴有79和81两种同位素,选择79作为检测质量数,避免ArAr H对Br的干扰。由于水果中含有较高的钾元素,标准模式下KAr对Br会产生影响,选择氧反应模式消除多原子离子干扰。实验发现,氧气流量较高时,仪器响应值会大幅度降低。兼顾仪器灵敏度和去干扰效果,最终控制氧气流量在5%,并通过调谐将仪器调整到最佳状态。
2.2 HPLC条件的选择
对溴形态分析方法的HPLC条件进行优化,提高形态分析效率。参考文献[16]方法配制硝酸铵缓冲溶液作为流动相,配制方便,分离效果较好。酸性条件下溴离子易被氧化,形态易发生改变,影响正常离子计数。实验发现,相同浓度的流动相pH值低于7时,溴信号强度较低,色谱峰高较低,峰宽较大;pH值高于7时,溴元素以离子形态存在,较为稳定,溴信号较强,色谱峰形尖锐。兼顾色谱峰的分离效果和色谱柱耐受程度,最终流动相pH 9。

图1 18 mmol/L硝酸+34 mmol/L氨水(A)和56 mmol/L硝酸+67 mmol/L氨水(B)下溴形态标准溶液色谱图Fig. 1 Chromatograms of 18 mmol/L HNO3 + 34 mmol/L NH4OH (A) and 56 mmol/L HNO3 + 67 mmol/L NH4OH (B)
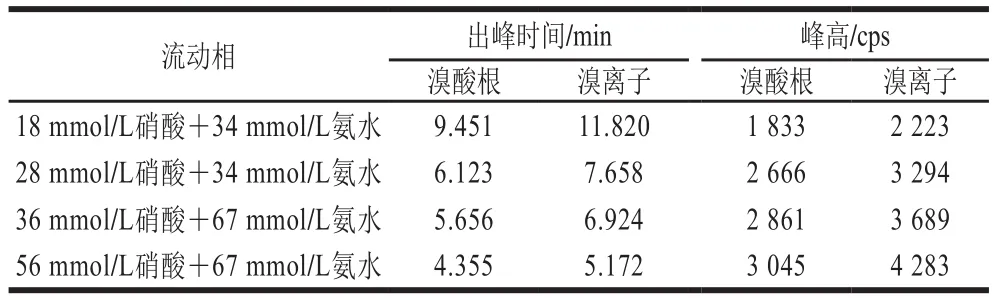
表1 不同流动相下的色谱峰出峰情况Table 1 Chromatographic peaks with different mobile phases
从图1可见,溴酸根出峰时间早,溴离子出峰时间晚,流动相体积分数越高,待测物出峰越快,出峰间隔时间越短,信号越强。选择4种硝酸和氨水配比作为流动相,调节pH 9,对相同质量浓度的溴形态标准溶液进行对比,结果见表1。18 mmol/L硝酸+34 mmol/L氨水的流动相分离效果最佳,但分析时间较长;56 mmol/L硝酸+67 mmol/L氨水的流动相,分析用时最少,信号最强,但两峰的出峰间隔时间过短,分离效果不佳。兼顾分析时间和分离效果,最终选择36 mmol/L硝酸+67 mmol/L氨水作为流动相、pH 9,8 min可以出峰完毕,在效率和效果上都满足快速精准分析的需求。
2.3 熏蒸后樱桃中溴形态的分析
采用超声提取结合HPLC-ICP-MS法对标准溶液和6 批次溴甲烷熏蒸后樱桃中的溴形态进行液相色谱分析,获得色谱图,见图2。同时采用ICP-MS法检测樱桃中的总溴含量进行对比,结果见表2。

图2 溴形态标准溶液(A)和溴甲烷熏蒸后樱桃中溴形态(B)色谱图Fig. 2 Chromatograms of bromine standard solution (A) and bromine in cherries fumigated with methyl bromide (B)
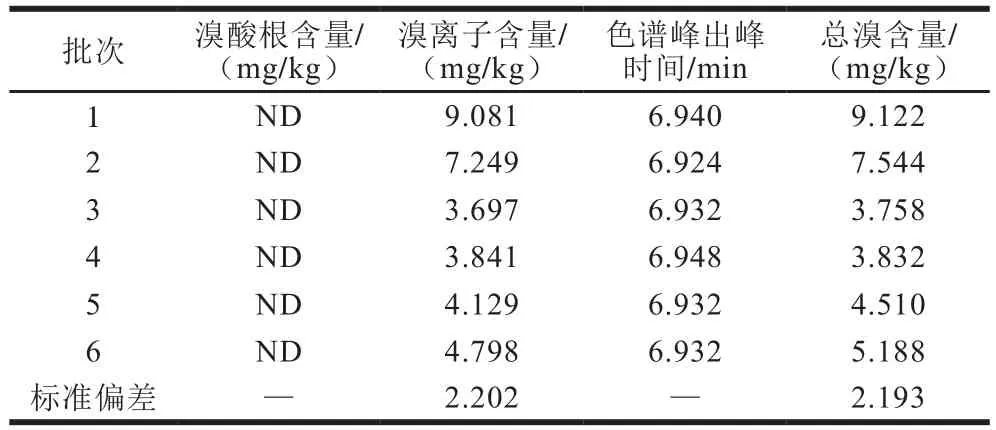
表2 溴甲烷熏蒸后樱桃中溴酸根、溴离子与总溴的含量与色谱峰出峰时间(n=2)Table 2 Contents of bromate, bromide ion and total bromine and time of chromatographic peaks in cherries fumigated with methyl bromide (n = 2)
实验表明,溴酸根标准溶液出峰时间为5.656 min,溴离子标准溶液出峰时间为6.924 min,熏蒸后樱桃中溴形态色谱图为单峰,出峰时间如表2所示,以出峰时间定性,判断为溴离子色谱峰,说明溴甲烷熏蒸后樱桃中的溴元素皆为溴离子,没有溴酸根及其他溴化物存在。水果的基质较为简单,经过溴甲烷熏蒸后残留的溴离子基本停留在水果表面,用水超声即可提取,测得的溴离子含量与总溴含量相符,可认为熏蒸后樱桃中的总溴残留即为溴离子残留。各批次之间溴离子和总溴含量的标准偏差可见,不同批次樱桃溴残留差异较大,这与樱桃熏蒸位置、品质差异等因素有关。
据报道,臭氧也可用于果蔬的杀菌和储存,臭氧的处理会促使溴酸根形成,但此方法一般用于消除农药残留和保鲜消毒,并未在进出口果蔬的虫害防治上使用。其他文献调查也表明,溴酸根多残留在水样和米面制品中,没有在果蔬中发现。溴形态分析方法在溴残留研究中的应用,为水果进出口的快速通关和熏蒸过程追溯提供了便利。
2.4 方法的回收率和精密度实验结果
在本实验方法下,溴酸根、溴离子以及总溴含量在2.0~100.0 μg/L质量浓度范围中皆呈良好的线性关系,获得溴酸根回归方程=1 651.4,=0.999 8,溴离子回归方程=2 376.6,=0.999 8,总溴回归方程=0.009 1+0.010 4,=0.999 9。
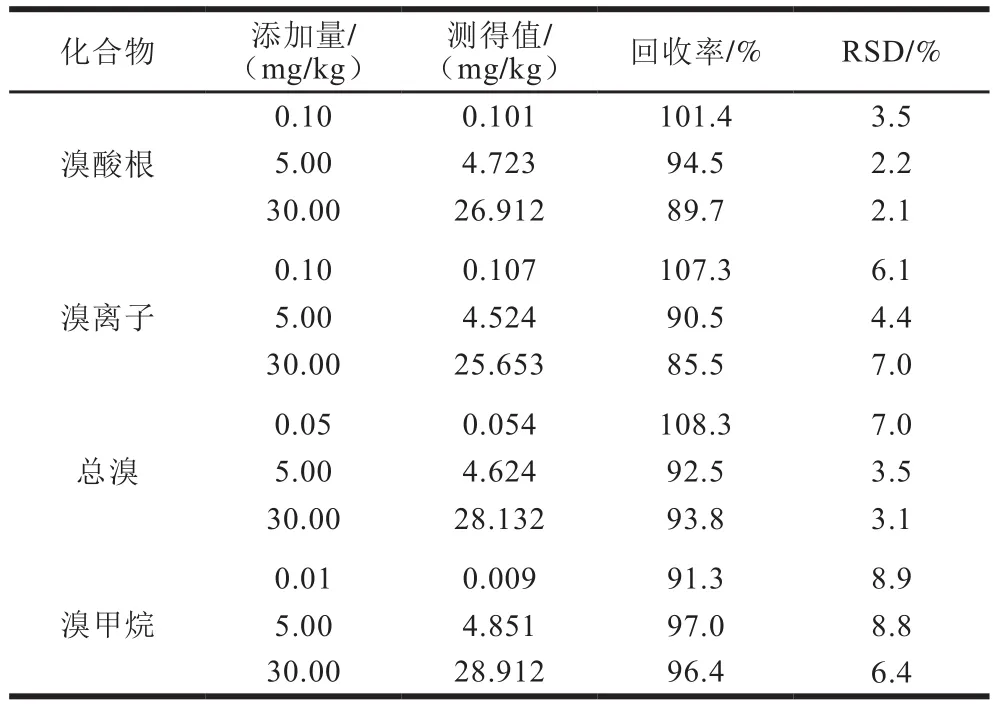
表3 樱桃中溴酸根、溴离子、总溴和溴甲烷的添加回收和精密度(n=6)Table 3 Recoveries and precision of bromate, bromide ion, total bromine and methyl bromide spiked in cherries (n = 6)
将空白本底的樱桃样品作为基质,参考果蔬中常见限量范围,做添加回收实验,验证方法的可靠性,结果见表3。在0.10、5.00、30.00 mg/kg三水平进行添加,HPLC-ICP-MS法测定溴酸根和溴离子含量,获得溴酸根回收率为89.7%~101.4%,相对标准偏差(relative standard deviation,RSD)为2.1%~3.5%,溴离子回收率为85.5%~107.3%,RSD为4.4%~7.0%,定量限为0.10 mg/kg。在0.05、5.00、30.00 mg/kg三水平进行添加,ICP-MS法测定总溴含量,获得回收率为92.5%~108.3%,RSD为3.1%~7.0%,定量限为0.05 mg/kg。在0.01、5.00、30.00 mg/kg三水平进行添加,GC-ECD法测定溴甲烷含量,获得回收率为91.3%~97.0%,RSD为6.4%~8.9%,定量限为0.01 mg/kg。这3种方法回收率好、精密度高,适用于果蔬中溴残留含量的测定,以满足水果进出口风险监测要求及在熏蒸过程追溯中的应用。
2.5 溴甲烷熏蒸前后樱桃中溴残留的对比
将同批次未熏蒸和熏蒸后的樱桃同时进行检测,根据樱桃采摘熏蒸到运输入境,以及樱桃货架期时长,分别在熏蒸后3、5、7、10、14、21、28 d进行测定,观察溴甲烷残留量和溴离子含量的变化,结果见表4和表5。
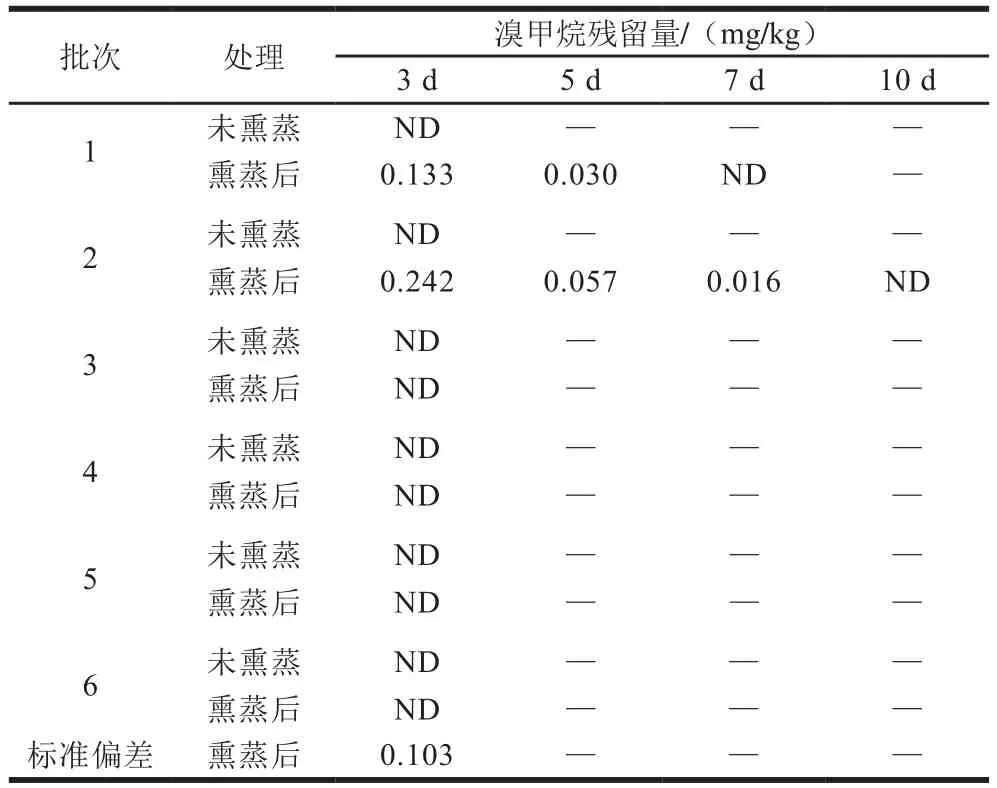
表4 樱桃中溴甲烷残留量(n=2)Table 4 Contents of methyl bromide in cherries (n = 2)
从表4可见,未熏蒸的6 批次樱桃皆未检出溴甲烷,熏蒸后有2 批次樱桃检出了少量溴甲烷。经查询,水果的溴甲烷熏蒸投药量通常为32~64 g/m,土耳其樱桃熏蒸法的投药量高达145 g/m,如保存良好,溴甲烷熏蒸后3 d能测得少量溴甲烷,1 周后即挥发完毕无法检出,表现了溴甲烷极强的挥发性。由此可见,以樱桃在当地熏蒸后入境的时长,无法仅凭借溴甲烷残留量判断熏蒸情况,为熏蒸过程追溯带来了极大的困难。
从表5可见,未熏蒸的6 批次樱桃中溴离子含量较低,为0~0.177 mg/kg,熏蒸后樱桃中溴离子含量明显高于未熏蒸,为3.545~9.190 mg/kg,且未受时间影响呈明显降低趋势。此结果与国外研究报道相符,果蔬经溴甲烷熏蒸会残留大量溴离子,其含量会由于熏蒸位置、包装方式、个体差异等因素有所不同,但是否经过了有效熏蒸能直观体现。溴甲烷熏蒸要求的投药量较大,这6 批次熏蒸后的樱桃溴离子含量皆未超过国际上溴离子限量20 mg/kg,说明145 g/m依然是较为安全的熏蒸剂量。
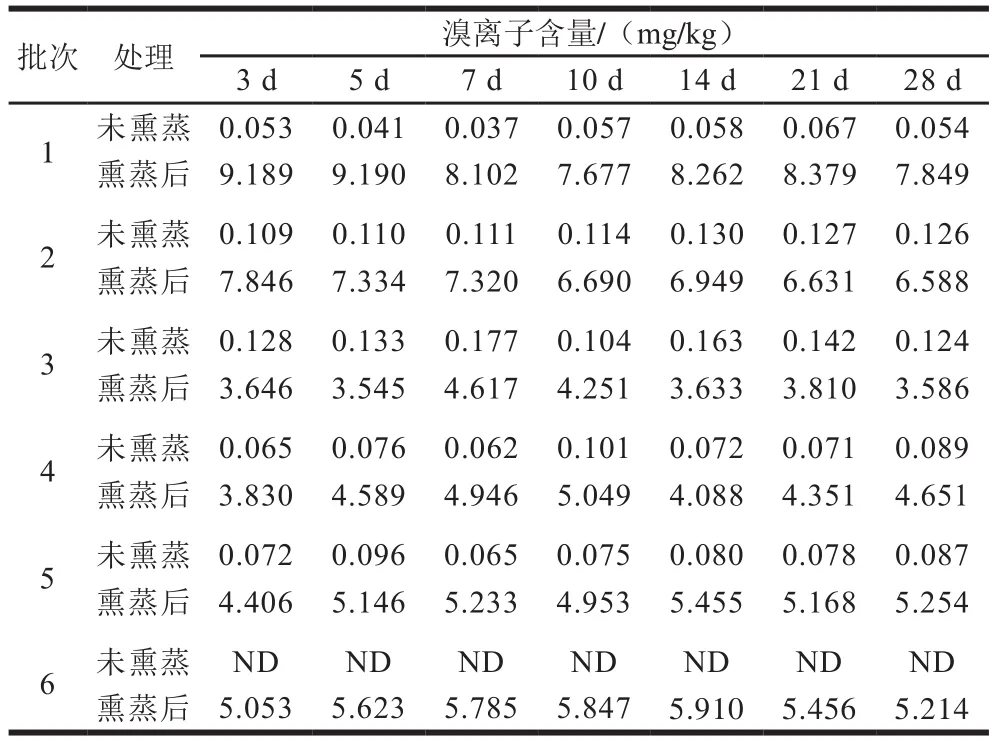
表5 樱桃中溴离子含量(n=2)Table 5 Contents of bromide ion in cherries (n = 2)
此次获得的6 批次进口樱桃品质参差不齐,个别批次发现害虫,测得樱桃中溴离子含量较低。作为对照,另外获得了4 批次国内确定未经过溴甲烷熏蒸的新鲜樱桃样品,对其溴离子含量进行检测,测得含量为0~0.082 mg/kg,与6 批次进口樱桃测得结果接近。因此,可以判断这6 批次樱桃入境前未经过充分的溴甲烷熏蒸。
2.6 樱桃样品保存条件的对比结果
选取3 批次熏蒸后的樱桃,在制样后分别进行冷藏保存和常温保存,保存3 d和7 d后测定溴离子含量,与当天制样进行对比,观察樱桃中溴离子含量是否会由于制样时间和保存条件不同而有所变化,结果见表6。

表6 不同保存条件下樱桃中溴离子含量(n=2)Table 6 Contents of bromide ions in cherries under different storage conditions (n = 2)
由表6可见,樱桃制样后保存条件和保存时间对溴离子含量影响较小,溴离子含量没有因保存温度升高而明显降低。将樱桃样品在-18 ℃冰箱内冷冻,数月后取出再次检测,熏蒸后樱桃中的溴离子含量仍未降低,说明了溴元素在水果内部的稳定性,也证明樱桃熏蒸后的存储条件不会使溴离子含量产生显著变化。
3 结 论
建立了一种纯水超声快速提取、HPLC-ICP-MS检测樱桃中溴元素残留形态的分析方法,并通过ICP-MS法确证其总溴含量,顶空进样-GC法测定溴甲烷残留量,对溴甲烷熏蒸后樱桃中的溴残留进行了研究。
参照土耳其樱桃入境检疫要求将樱桃进行溴甲烷熏蒸处理,研究发现经溴甲烷熏蒸后的樱桃中含有的溴元素皆转化为溴离子,没有溴酸根形成,测得的溴离子含量与总溴含量相符。通过溴甲烷熏蒸后28 d内未熏蒸与熏蒸后樱桃中溴甲烷残留量和溴离子含量的对比,发现溴甲烷挥发性极强,在樱桃中残留1 周后即无法检出,这使得海关口岸在进出口水果的虫害控制和熏蒸过程追溯上有一定难度,无法通过溴甲烷残留量判定水果入境前的熏蒸情况。而熏蒸前后樱桃中的溴离子含量有明显的差异,熏蒸后樱桃中的溴离子残留量远高于未熏蒸,并且在樱桃内部稳定存在。对樱桃中溴离子残留量的监控,是甄别樱桃入境前是否进行了溴甲烷熏蒸的有效手段,也是衡量熏蒸后的溴残留是否在安全范围的可靠方式。
本方法快速、简便、精密度高,在水果熏蒸过程追溯的应用上可取代溴甲烷残留量的分析,在水果进出口风险监控筛查中发挥作用,促进口岸监管方式的转型升级。
