基于RNA-seq分析酒酒球菌SD-2a酸胁迫应答机制
2022-07-07刘龙祥赵红玉
刘龙祥,彭 帅,赵红玉,袁 林,李 华,3,4,王 华,3,4,*
(1.滨州学院生物与环境工程学院,山东省黄河三角洲野生植物资源工程技术研究中心,山东 滨州 256600;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;4.西北农林科技大学合阳葡萄示范站,陕西 渭南 715300)
苹果酸乳酸发酵(malolactic fermentation,MLF)是葡萄酒酿造过程中的一个重要过程。MLF通常在乙醇发酵后开始。MLF降低了总酸度,提高了葡萄酒的细菌稳定性和感官性能。MLF作为酿酒过程中最困难的控制步骤,并不总是成功。葡萄酒的一些理化性质,如高浓度乙醇或亚硫酸盐和低pH值,可以抑制MLF过程。由于酒酒球菌()对葡萄酒的恶劣环境条件具有良好的适应能力,因此作为MLF的主要诱导菌株。
可以在如此恶劣的葡萄酒环境中生存,说明体内一定有一种或多种机制防御胁迫因素的潜在损害。最近研究提出了多种胁迫应答机制,如细胞内外pH值平衡、细胞膜组分和流动性、氧化应激反应、DNA和蛋白质损伤修复,但应对酸胁迫的具体机制还不清楚。
RNA-seq是研究胁迫应答反应的常用方法,但只有两项研究对进行了全转录组RNA-seq分析。一种检测了3 株不同的菌株在MLF期间表型的遗传变异,另一种聚焦于对短期酸胁迫的响应。菌株间蛋白质编码基因的变异可达10%,因此利用合适的参考基因组进行RNA-seq分析显得尤为重要。Sternes等的研究将转录组数据映射到PSU-1基因组,而本研究使用SD-2a基因组作为参考基因组,这是这项研究的特点之一。为了更全面、系统地研究的胁迫响应机制,本研究结合生理数据对转录组数据进行分析。
细菌胁迫应答反应的启动是一个连续动态变化的过程,不同阶段可能会启动不同的应对反应,同一基因在不同阶段可能表现出不同的行为。因此,在原研究的基础上,延长SD-2a酸胁迫处理时间,借助生理指标进一步探究其应激反应。本研究选择SD-2a(CGMCC 0715)菌株作为研究对象,它与商业菌株(VinifloraOenos)相比具有更高的MLF能力,并且能够在更恶劣的胁迫条件下生存。通过正常(pH 4.8)与酸胁迫(pH 3.0)处理条件下转录组测序与生物信息技术分析,筛选SD-2a酸胁迫应答关键基因与关键通路,并通过理化指标检测(细胞膜完整性、细胞膜脂肪酸组成及含量、H-ATPase活性、细胞膜流动性和胞内pH值),验证并补充酸胁迫应答机制,旨在为酸胁迫反应机制的研究提供更多的数据支持,有助于深入系统地研究胁迫适应性机制,为葡萄酒生产过程中MLF的稳定、可控奠定理论基础。
1 材料与方法
1.1 材料与试剂
SD-2a分离自山东省烟台市的葡萄酒,本实验保藏。
4-羟乙基哌嗪乙磺酸、三氯乙酸、缬氨霉素、尼日利亚菌素、邻苯二醛、-巯基乙醇、硼酸、偏磷酸和四氢呋喃等试剂均为国产分析纯;H-ATPase assay kit上海杰美基因医药科技有限公司;ATP Assay Kit、BCECF AM 上海碧云天生物技术公司;细菌RNA提取试剂盒(D6950) 美国Omega BioTek公司;聚合酶链式反应(polymerase chain reaction,PCR)Premix宝生物工程(大连)有限公司。
1.2 仪器与设备
QuantStudio 6 Flex荧光定量PCR仪 美国Life Technologies公司;LS55荧光分光光度计 美国PE公司;Infinite M200pro全波长多功能酶标仪 瑞士Tecan公司;FACSCalibur流式细胞仪 美国BD公司;MS-5977E气相色谱仪 美国Agilent Technologies公司。
1.3 方法
1.3.1 培养条件
将细胞置于pH 4.8的果糖-苹果酸番茄种子(fructosmalate acid tomato broth,FMATB)培养基中28 ℃培养,在指数期(OD≈1)结束时收获,在无菌烧瓶中混合后分成6 等份,分别接种于pH 3.0和pH 4.8(对照)的FMATB培养基中,所有实验都在28 ℃独立培养进行3 次。样品分别在酸胁迫处理前(0 h)和酸胁迫或对照处理3 h后采样。对照处理是将细胞转移到pH 4.8的培养基中,去除离心和培养时间对实验结果的影响。
1.3.2 RNA提取和测序
RNA提取、cDNA文库构建、RNA测序和数据分析均按照Liu Longxiang等的方案进行。序列文库由北京博奥生物有限公司建立并测序。
1.3.3 转录组数据分析
使用SD-2a基因组进行转录组数据的组装。使用FastQC(Version 0.11.5)对测序质量进行评估,然后使用NGSQC(v0.4)对低质量数据进行过滤。使用HISAT2对每个样本的clean reads进行比对。
根据Liu Longxiang等进行样本间基因表达分析和独立统计假设检验,得到表达的差异倍数(fold change,FC)、值和值(校正后的值)。以值或值进行显著性分析。|logFC|≥1(2 倍差异)、<0.05是区分差异表达基因(differentially expressed gene,DEG)的参数。
DEG的功能注释使用NCBI、Uniprot、ENSEMBL、基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行。最后,利用默认参数,通过GO和KEGG函数分析对所有DEG的主要GO和KEGG类别进行注释。
1.3.4 转录组数据验证
采用real-time PCR对RNA-seq数据进行验证。在前人研究基础上选择基因进行real-time PCR(表1)。real-time PCR采用与RNA-seq相同的RNA样本,采用Primer Premier软件(5.0版)对引物进行筛选分析。根据、、、和的几何均值对real-time PCR数据进行归一化处理。real-time PCR和数据分析按照文献[7]进行。

表1real-time PCR实验使用引物及基因描述Table 1 Gene descriptions of primer sequences used for validation of RNA-seq results by real-time PCR
1.3.5 细胞膜完整性检测
采用荧光染料碘化丙啶测定酸胁迫处理对细胞膜完整性的影响。收集酸胁迫处理后0、1 h和3 h的菌体细胞8 000 r/min离心3 min,去上清液,使用磷酸盐缓冲液(50 mmol/L,pH 7.0)洗涤2 次,最后调整至OD为5,添加碘化丙啶染料(终质量浓度为50 µg/mL)。细胞在37 ℃孵育30 min,使用流式细胞仪进行测定,样品以488 nm发光、630 nm荧光发射检测。每个样本收集20 000个细胞,使用CELLQuest程序进行处理。
1.3.6 细胞膜脂肪酸和H-ATPase测定
按照1.3.1节的方法培养细胞。在酸胁迫处理前(0 h)和酸胁迫或对照处理3 h后采样。
采用O’Fallon等直接脂肪酸甲酯合成法提取并处理细胞脂肪酸。使用DB-WAX毛细管柱(30 m×0.32 mm,0.25 μm),采用气相色谱测定脂肪酸甲酯组成。
色谱条件:初始温度175 ℃,保温1 min,随后以5 ℃/min速率提高到240 ℃,然后保温10 min。氮气作为载气,流速为1 mL/min,分流比为50∶1。脂肪酸甲酯通过检索NIST 14ms数据库进行鉴定。
H-ATPase活性根据H-ATPase检测试剂盒进行测定。
1.3.7 细胞膜流动性和胞内pH值测定
按照1.3.1节的方法培养细胞。在酸胁迫处理前(0 h)和酸胁迫或对照处理3 h后采样。将待测细胞调整到OD为0.6,用0.25%甲醛在37 ℃固定30 min,然后用0.2 mol/L磷酸盐缓冲液(pH 7.4,0.25%甲醛)冲洗2 次。
采用分子间芘激振(0.1 μmol/L)法测定膜脂肪酸链的横向扩散,37 ℃标记40 min,37 ℃条件下用LS55型荧光光谱仪测定。激发波长为335 nm,发射波长为373 nm(对于单体)和470 nm(对于激态分子)(分别为5 nm和5 nm狭缝)。用准分子与单体的比值()表示横向扩散。
膜内部脂酰链旋转扩散用1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH)处理后的荧光各向异性表示。菌体细胞使用5 μmol/L DPH溶液37 ℃孵育1 h后,在37 ℃下用荧光分光计进行测定,激发波长为360 nm,发射波长为430 nm(狭缝宽度5 nm)。荧光偏振度()和各向异性()的计算参照Wu Chongde等方法。
细胞内pH值(pH)使用BCECF AM试剂测定,采用Breeuwer等的方法。
1.4 数据分析
采用Excel 对数据进行整理,绘制表格,使用SPSS statistic 20对数据进行统计学分析,使用OriginPro 8.5、TBtools v1.068进行绘图。
2 结果与分析
2.1 RNA-seq数据验证
为研究酸胁迫处理影响最大的基因或者代谢通路,本研究将对照组(pH 4.8_0 h和pH 4.8_3 h)与酸胁迫处理组(pH 3.0_3 h)进行比较转录组学研究。转录组测序原始数据提交至NCBI Sequence Read Archive(SRA)数据库(登录号SAMN08102829)。
对11个基因进行real-time PCR以验证RNA-seq数据。在不同的比较组中,11个基因的real-time PCR数据与RNA-seq数据存在显著相关性(图1),说明RNA-seq数据是可信的。
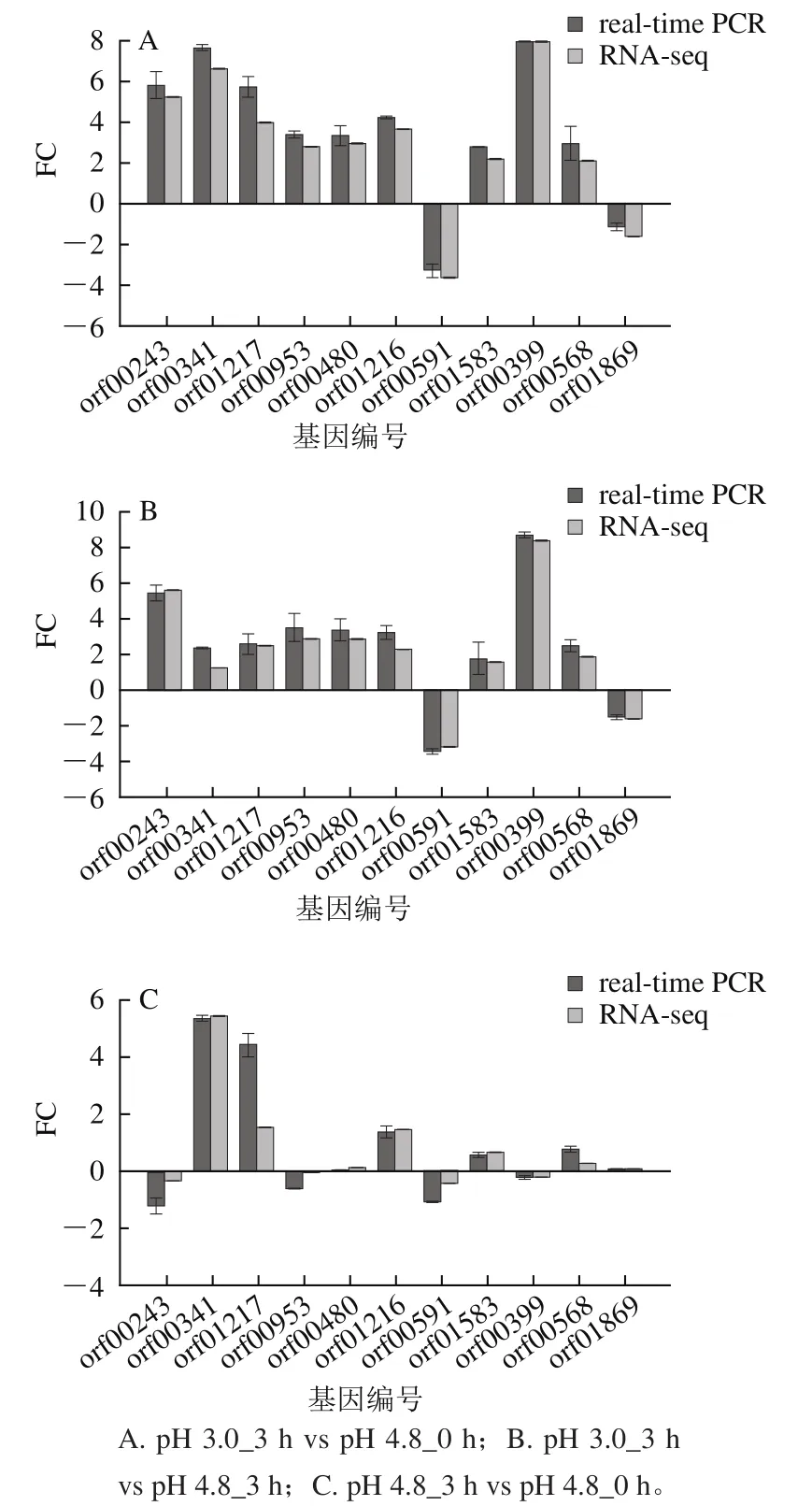
图1 筛选基因的RNA-seq与real-time PCR数据对比Fig. 1 Comparison of RNA-seq and real-time PCR results for selected genes
2.2 酸胁迫对O. oeni应答影响的整体分析
为消除离心等处理对样品的影响,分别以pH 4.8_0 h和pH 4.8_3 h为参比条件,进行转录组数据的分析。共发现881个DEG。DEG数目远高于Margalef-Catala等测序数据,但低于Liu Longxiang等用酸处理SD-2a 1 h后的DEG数目。
各比较组DEG数目如图2、3所示。其中,比较组VS1和VS2分别有644个和609个DEG,而比较组VS3有288个DEG,比较组VS3中的DEG主要是因为培养时间的延长发生的差异表达,而不是因为酸胁迫处理。这是选择pH 4.8_0 h作为对照样本的局限性。因此,本研究主要采用pH 4.8_3 h的样品数据作为对照。
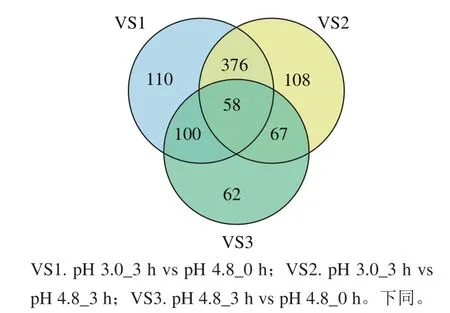
图2 3个比较组共有和特有基因对比Venn图Fig. 2 Venn diagrams showing unique and shared genes among three groups
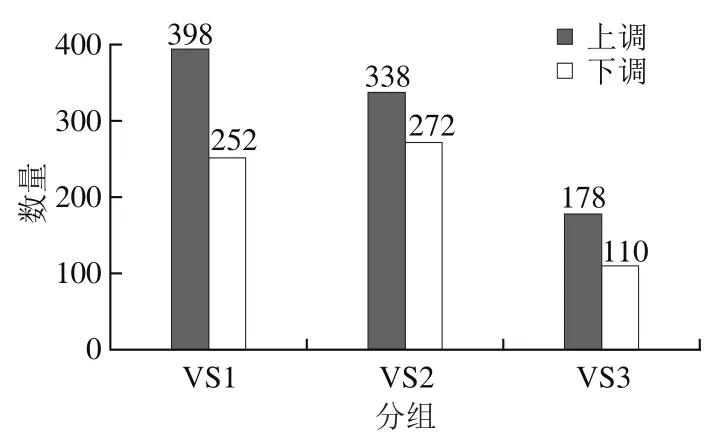
图3 3个比较组上调基因与下调基因统计图Fig. 3 Up-regulated and down-regulated genes among three groups
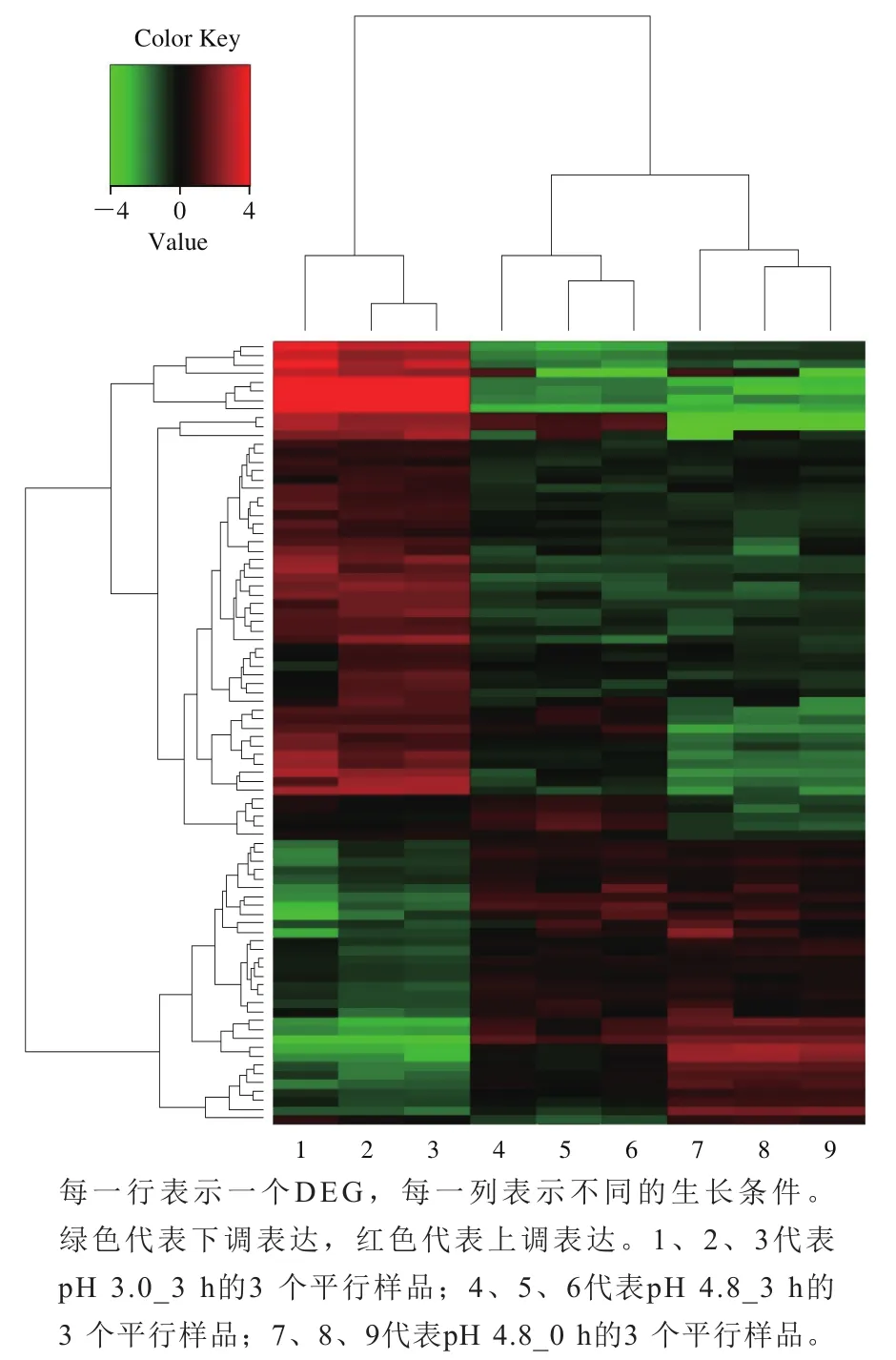
图4 不同处理O. oeniSD-2a中部分DEG聚类热图Fig. 4 Heat map obtained from hierarchical clustering analysis of partial differentially expressed genes in O. oeni SD-2a grown under different conditions
酸性胁迫处理后DEG表达模式相关性热图如图4所示。平行样本的表达图谱聚在同一个分支上,表明平行样本之间具有较高的相关性,说明影响DEG表达模式的关键因素是酸胁迫处理。
2.3 DEG分类和功能分析
由表2可知,GO富集的DEG主要属于生物过程的范畴。所有组的大多数DEG(VS1、VS2和VS3)被发现参与代谢过程(GO:0008152)、催化活性(GO:0003824)、细胞过程(GO:0009987)、单一生物过程(GO:0044699)和结合(GO:0005488),这与Liu Longxiang等报道的DEG相似。KEGG富集结果显示,氨基酸代谢、碳水化合物代谢、膜转运和翻译途径对酸胁迫更为敏感,而转运和分解代谢、萜类和多酮类代谢、其他次生代谢产物的生物合成、转录和信号转导途径变化较小(表3)。

表2 GO数据库富集DEG总数Table 2 Total number of differentially expressed genes enriched in GO database
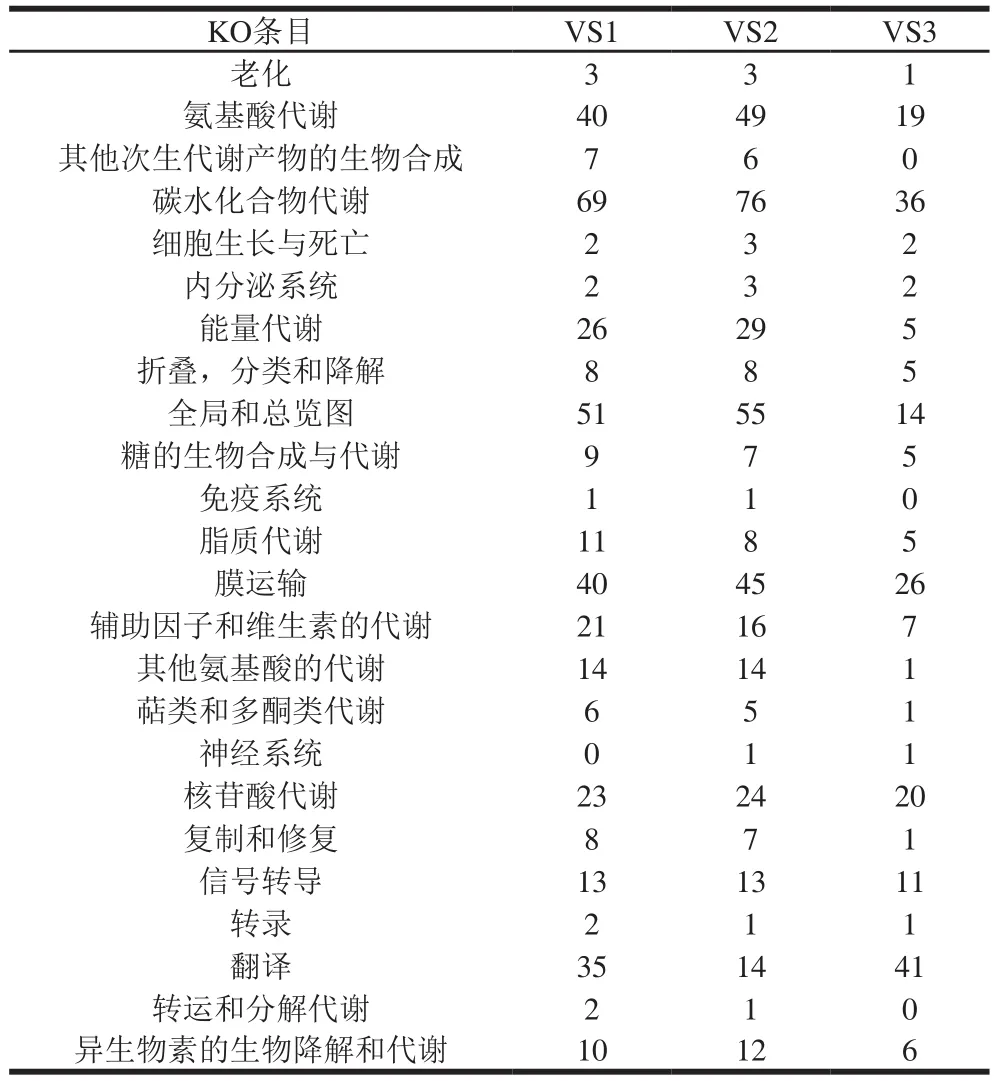
表3 KEGG富集到不同代谢通路的DEG总数Table 3 Total number of differentially expressed genes enriched in KEGG pathway
2.4 O. oeni SD-2a酸胁迫应答机制分析
2.4.1 阻隔H
细胞膜是抵御胁迫的重要手段,本研究测定了细胞膜完整性、脂肪酸成分和流动性等胁迫应答指标。如图5所示,对照组(1 h和3 h)细胞膜完整性分别为96.77%和95.88%,处于较高水平,随时间延长略有下降。处理组(1 h和3 h)细胞膜完整性分别为85.44%和83.55%,与对照组的趋势一致。与对照组相比,处理组细胞膜完整性有所下降,但仍保持在较高水平,这保证了实验中有足够的活细胞响应酸胁迫处理,保证了实验结果具有指导意义。
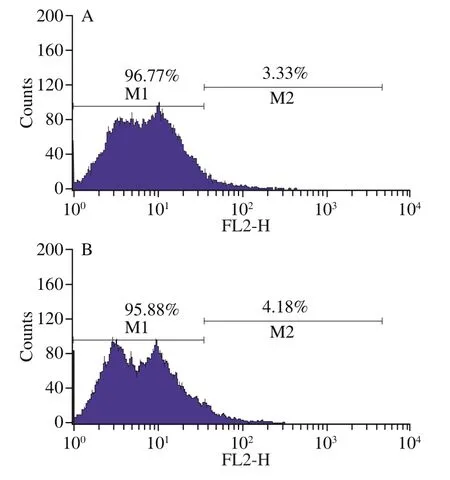
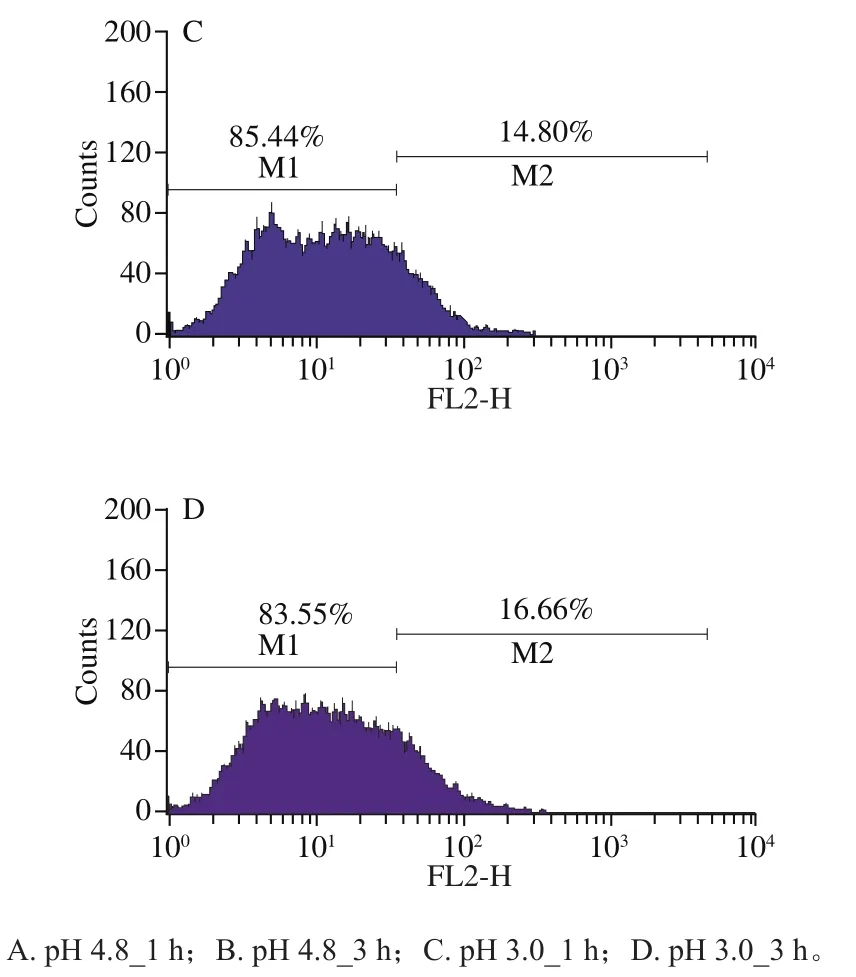
图5 流式细胞术分析O. oeniSD-2a在酸胁迫和对照条件下的细胞膜完整性变化Fig. 5 Flow cytometry analysis of change in membrane integrity of O. oeni SD-2a under acid stress and control conditions
改变细胞膜的组成和流动性是应对外界因素胁迫的重要响应方式,其中细胞膜脂肪酸在调整细胞膜流动性方面起重要作用。脂肪酸的生物合成途径的关键酶是乙酰辅酶a羧化酶,在酸胁迫与对照条件下表达量无显著差异,且脂肪酸生物合成途径中没有富集到DEG,说明酸胁迫处理并为改变脂肪酸的生物合成。环丙烷脂肪酸是调节细胞膜流动性的关键物质之一,环丙烷脂肪酸合成酶(cyclopropane fatty acid synthase gene,CFA)可以催化单不饱和脂肪酸生成环丙烷脂肪酸,在实验组和对照组中的表达量也未发生显著变化。此前有一项研究发现,长期酸和乙醇培养的细胞中表达增加,但另一项研究发现,乙醇胁迫处理1 h后表达水平下降。这表明短时间胁迫处理并不会改变环丙烷脂肪酸含量,在长时间的胁迫处理后,环丙烷脂肪酸开始加速积累。
SD-2a在酸胁迫下芘差向异构系数()如表4所示。与0 h相比,在实验组和对照组处理均降低,但对照组下降水平显著高于实验组,与细胞膜侧向扩散速率呈正比,因此说明酸胁迫条件下细胞膜侧向扩散速率较高。细胞膜轴向扩散速率的变化通过测定细胞膜内脂肪酸酰基链的转动扩散表示。SD-2a在酸胁迫条件下表现出较高的荧光各向异性(),荧光各向异性与细胞膜轴向扩散速率呈反比,即酸胁迫条件下细胞膜轴向扩散速率较低。因此,在酸胁迫下,SD-2a保持了较高的侧向扩散速率和较低的轴向扩散速率,较高的侧向扩散速率可以使细胞保持较高的膜流动性,较低的轴向扩散速率可以保证细胞内部有稳定的离子环境。
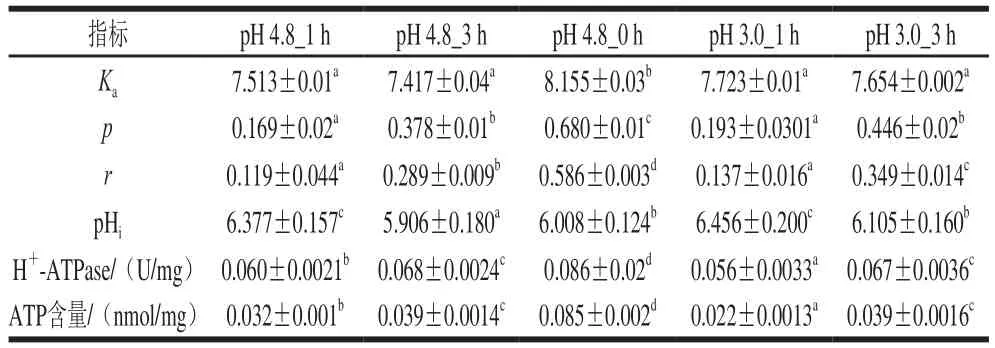
表4 酸胁迫条件下O. oeniSD-2a的生理生化数据Table 4 Physiological and biochemical data of O. oeni SD-2a subjected to acid stress
为研究酸胁迫对细胞生理影响,对细胞膜脂肪酸组分及含量进行了测定(表5)。与对照组(pH 4.8_3 h)相比,总不饱和脂肪酸和总环状脂肪酸的含量减少,细胞膜总饱和脂肪酸的含量增加,而不饱和脂肪酸/饱和脂肪酸比值降低。饱和脂肪酸/饱和脂肪酸比值作为细胞膜流动性的一个指标,目前还没有研究测试细胞膜流动性与脂肪酸组成之间的直接关系。此外,环状脂肪酸的合成没有增加,这与基因表达水平的数据一致。
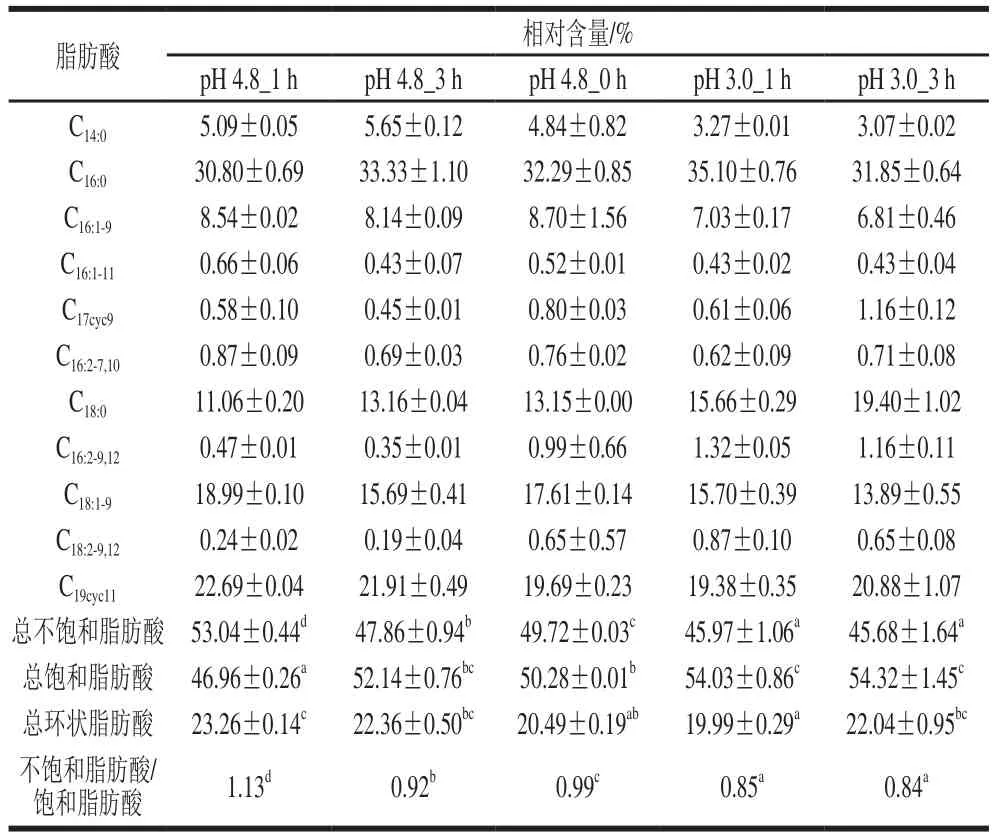
SD-2a的膜脂肪酸组成变化Table 5 Membrane fatty acid composition of O. oeni SD-2a subjected to acid stress表5 酸胁迫条件下O. oeni
本研究涉及肽聚糖合成途径的基因几乎全部被抑制,酸胁迫诱导了-丙氨酸--丙氨酸二肽酶(orf00171)催化肽聚糖的水解作用。这说明酸胁迫抑制了能量消耗过程和细胞壁的生物合成。
这些结果表明,酸胁迫处理后,环丙烷脂肪酸、胞外聚合物和构成细胞壁和细胞膜的肽聚糖的合成下调或保持不变。由此推断,SD-2a的抗酸胁迫能力不是通过改变脂肪酸组成和细胞壁实现的。
2.4.2 外排H
缓解酸胁迫的一个重要策略是将有害化合物(H)外排的系统,其中三磷酸腺苷结合盒(ATP binding cassette transporter,ABC)转运体发挥了重要作用。在转录组中与ABC转运体相关的121个基因中,48个基因发生差异表达。
细菌可以通过H-ATPase排出H维持细胞内外pH值稳定。如表6所示,编码FF-ATPase的基因orf00563、orf00568、orf00569、orf00570在酸胁迫处理后上调表达,说明FF-ATPase在耐酸应答中活性增加。为了证实这一点,测定酸胁迫处理后SD-2a的H-ATPase活性(表4)。酸胁迫处理1 h后,H-ATPase活性比对照组低6.7%。随着时间的延长,酶活性有一定程度的提高,酸胁迫处理3 h后,实验组和对照组的H-ATPase活性无显著差异。随着酸胁迫处理时间的延长,H-ATPase的活性逐渐增强,从而使细胞内pH值稳定在较高水平,维持细胞的正常功能。H-ATPase在SD-2a的酸胁迫反应中发挥了不可或缺的作用。

表6 在酸胁迫条件下O. oeniSD-2a部分DEGTable 6 Some genes in O. oeni SD-2a that were significantly differentially expressed under acid condition
2.4.3 中和H
另一种抵抗酸胁迫的方法是细胞质碱化。目前,细菌中提出的产碱机制有氨基酸脱羧、氨基酸脱氨酶、精氨酸脱氨酶系统、胍丁胺脱亚胺酶系统、MLF、脲酶和谷胱甘肽依赖还原系统。但由于缺少编码相应酶的基因,如脲酶、谷氨酸脱羧酶、赖氨酸、谷氨酸、胍丁胺脱亚胺酶、胍丁胺脱亚胺酶系统等,在中未发现相关机制。
2.4.3.1 氨基酸合成和代谢
在酿酒过程中,氨基酸是许多风味成分的重要前体,如高级醇类、酯类和芳香硫醇。此外,在恶劣环境下,氨基酸在细胞生长和存活中起着重要作用。值得注意的是,酸胁迫处理3 h后,一些氨基酸的生物合成显著增加。特别是,乙酰乳酸合成酶(acetolactate synthase,ALS)是支链氨基酸生物合成过程中的第1个限速酶,其表达量增加3.8 倍。精氨酸生物合成的限速酶,精氨酸琥珀酸合成酶,也显示出表达增加2.9 倍。有报道称,精氨酸可以诱导胁迫相关基因的表达,如和,精氨酸也能刺激一些菌株在低pH值下的繁殖。只有少数氨基酸合成相关酶表达下降。在葡萄酒的MLF环境中,氨基酸的正常生物合成可以通过消耗游离H改善葡萄酒的品质,降低细胞内H的浓度。
乳酸菌中氨基酸的代谢主要包括转氨作用、脱羧作用、脱氨基作用和脱硫作用。高浓度的生物胺会影响葡萄酒的口感与安全性。生物胺的合成需要氨基酸的脱羧作用,而精氨酸是许多葡萄和葡萄酒品种中含量最丰富的氨基酸。因此,对精氨酸的代谢可能导致葡萄酒质量下降。研究表明,的精氨酸代谢是通过精氨酸脱亚胺酶途径进行的。该途径的3种酶(精氨酸脱亚胺酶、鸟氨酸转氨甲酰化酶和氨基甲酸激酶)均表现出与对照组相似的表达水平,保证了葡萄酒的安全生产与消费。此外,这一代谢途径是一个产生ATP的反应,因此可以刺激的生长。
2.4.3.2 苹果酸和柠檬酸代谢
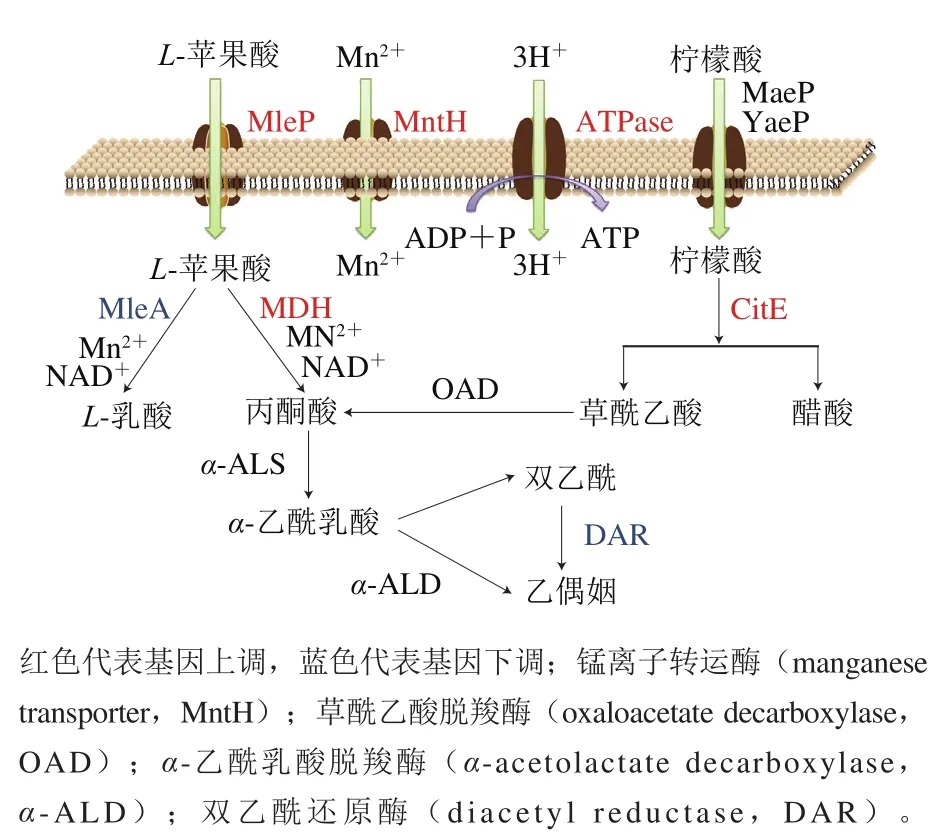
图6 O. oeni苹果酸和柠檬酸主要代谢通路Fig. 6 Main pathways of malate and citrate metabolism in O. oeni
苹果酸和柠檬酸的代谢是维持pH值稳态的重要途径。苹果酸的代谢主要通过MLF完成。-苹果酸通过苹果酸渗透酶(malate permease,MleP)的主动转运进入细胞,然后在苹果酸乳酸酶(malolactic enzyme,MleA)的催化下脱羧形成-乳酸。MleA的催化需要NAD和Mn作为辅助因子。在本研究中,基因表达下调(蓝色),苹果酸脱氢酶(malate dehydrogenase,)基因表达上调(红色)(图6)。这一现象表明在酸性条件下,更多的-苹果酸转化为丙酮酸,而不是-乳酸。
柠檬酸代谢始于柠檬酸的跨膜转运,由假定的柠檬酸转运体(MaeP和YaeP)完成。柠檬酸被柠檬酸裂解酶(citrate lyase,CitE)裂解形成草酰乙酸盐和醋酸盐。柠檬酸代谢诱导香气挥发物的产生,如双乙酰和乙氨酸(图6)。双乙酰形成途径中的酶的活性不受酸条件的抑制,确保了在葡萄酒的MLF过程中风味化合物不受影响。
苹果酸和柠檬酸的代谢消耗质子,导致细胞内pH值升高,同时产生pH值梯度和膜电位。部分ATP是由特定的ATPase利用跨膜质子动力(proton-motive force,PMF)合成的。苹果酸盐和柠檬酸盐的代谢使细胞获得所需的能量,以维持生长和pH值稳态。
2.4.4 DNA和蛋白质损伤修复
细菌在酸性环境中生存的一个主要问题是低pH值对蛋白质和DNA的潜在损害。生物体通常有能力修复DNA和蛋白质受损的有害影响,也是如此。
MMR基因在中很少被提及,其他中也未发现MMR基因和。这被认为是一种产生高水平多态性和提高环境适应性的机制。本研究在SD-2a的转录本中发现了20个与DNA修复相关的基因(表6),包括之前中没有发现的。但18个基因的表达水平没有显著变化,其中2个基因表达显著下调。大部分DNA修复基因正常表达可降低低pH值下的自发突变率,保证其遗传稳定性。
除了MMR基因,特异性蛋白质的合成是应对应激的重要途径。最值得注意的是伴侣蛋白在酸胁迫下的活化。例如,、、、、和在3 h酸休克后SD-2a中表达增加。许多应激相关蛋白表现出差异表达。其中,作为最具特征的应激蛋白是高表达的。比Liu Longxiang等报道在酸胁迫处理1 h后该基因的倍数变化要高得多。这说明在酸胁迫的早期反应和长期适应过程中都发挥了作用。
2.4.5 能量产生与消耗
部分ATP是由特定的ATPase利用跨膜PMF合成的。跨膜PMF是由质子消耗和流出产生,这是最终合成ATP的主要驱动力。此外,在本研究中,酸胁迫处理后ATPase的4个亚基(、、和)表达上调,这一结果与Liu Longxiang等的报道一致,该报道表明酸胁迫1 h后这4个亚基表达水平增加。但最近研究表明,PMF的建立主要是为了提高内部pH值,而不是为了产生能量。
糖酵解和三羧酸(tricarboxylic acid,TCA)循环是细胞最重要的能量产生方式。但在糖酵解途径和TCA循环中富集的关键基因未表现出差异表达。这说明SD-2a在短期酸胁迫下不能以这种方式获得能量。SD-2a抵御酸胁迫的能量来源可能是PMF积累,也可能是生长初期积累的ATP。
SD-2a作为兼性厌氧细菌,在酸胁迫下氨基酸代谢是SD-2a产生ATP的重要途径。此外,氨基酸代谢在调节细胞内pH值、产生还原力、增强细胞对环境胁迫的抵抗力等方面发挥着重要作用。缬氨酸、亮氨酸、异亮氨酸、精氨酸、鸟氨酸、谷氨酰胺、赖氨酸、蛋氨酸、半胱氨酸、丝氨酸、甘氨酸等氨基酸生物合成途径基因表达量显著升高。此外,天冬氨酸、丝氨酸、甘氨酸、谷胱甘肽、精氨酸、胱氨酸和谷氨酸代谢也被酸胁迫激活。氨基酸生物合成和代谢的激活不仅提供能量,中和H,而且为脂肪、碳水化合物和蛋白质的合成提供骨架。因此,细胞内氨基酸的积累可以有效提高细胞在酸胁迫下的存活率。
为了研究酸胁迫后细胞内能量的变化,测定了细胞内ATP。如表4所示,在酸胁迫处理前,细胞内ATP维持在较高水平。酸胁迫1 h后,ATP含量下降,这可能是SD-2a短暂的适应反应。随着适应时间的延长,细胞内ATP明显增加。SD-2a酸胁迫处理3 h后,实验组ATP含量达到对照组水平。说明SD-2a能从酸性环境中获得足够的能量进行正常生理活动,有利于其在酸性条件下的生存。
综合实验结果,根据差异表达的基因和通路,绘制了酒酒球菌SD-2a酸胁迫应答反应机制示意图(图7)。
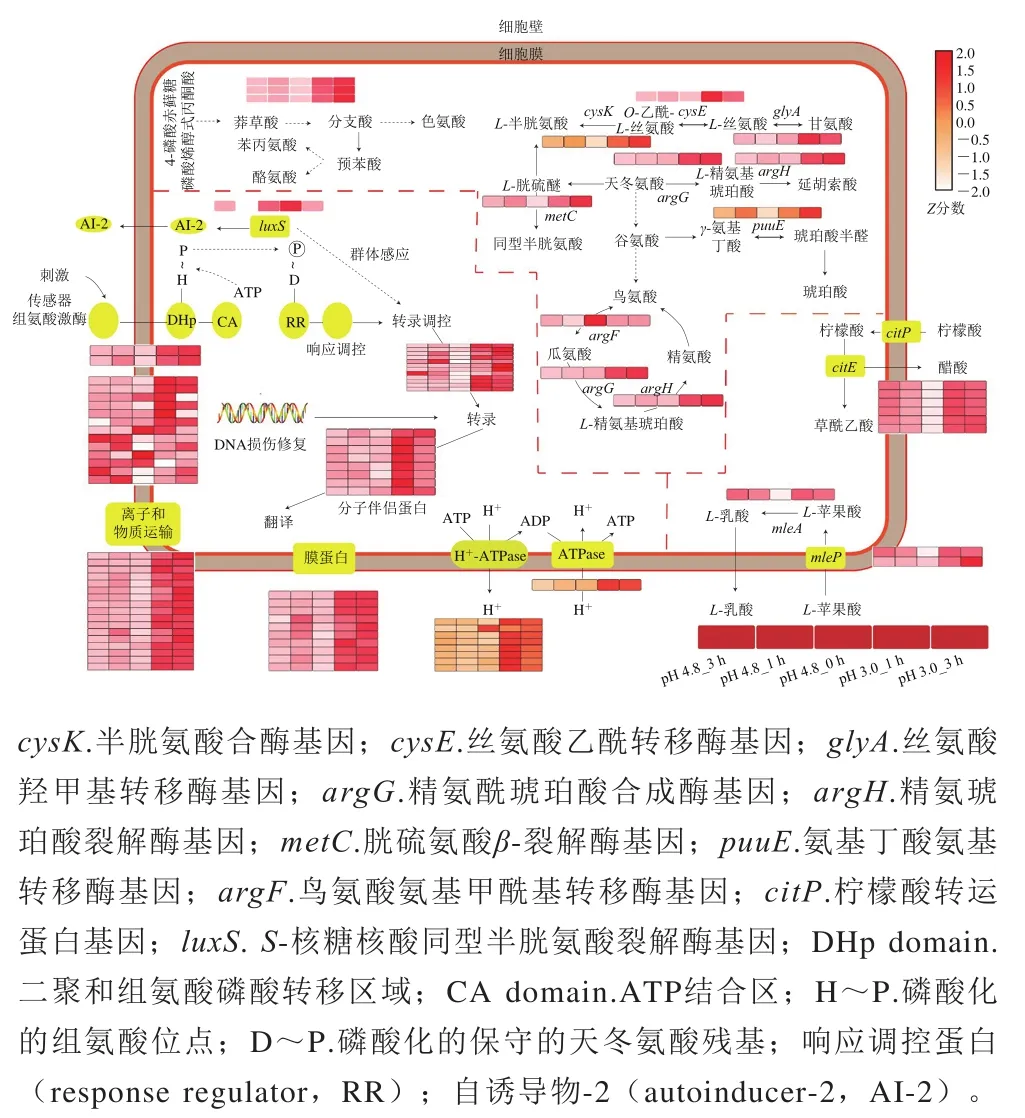
图7 O. oeni SD-2a酸胁迫应答机制示意图Fig. 7 Schematic diagram for acid stress response mechanism in O. oeni SD-2a
3 结 论
已鉴定的DEG参与了许多过程,包括与氨基酸代谢、碳水化合物代谢、膜转运和翻译相关的基因。本研究共新发现了40个DEG。中DEG的鉴定为进一步的胁迫处理提供了转录组分析的基础。
在酸胁迫条件下,为了合成更多ATP并将H泵出细胞,SD-2a的ATPase活性显著增加,适宜的pH值可维持适宜的酶促反应环境。通过调节细胞膜中总不饱和脂肪酸和总环脂肪酸的含量,可以降低细胞膜的流动性,作为抵御酸胁迫的第一道屏障。细胞内TCA循环或ATPase产生的能量显著增加,离子转运、氨基酸代谢、DNA修复基因和伴侣蛋白的合成等有利于抗酸胁迫的能量消耗反应显著增加。而一些不相关的能量消耗反应被抑制。此外,参与群体感应、半胱氨酸和胱硫氨酸循环、双组分系统和乙酰化过程的一些基因在本研究中也有差异表达,这表明它们可能也参与了SD-2a的酸胁迫反应。
