二代测序技术检测临床痰标本中结核分枝杆菌的初步评价
2022-07-06代小伟王嫩寒陈双双杨新宇田丽丽陈红张泓泰李传友
代小伟 王嫩寒 陈双双 杨新宇 田丽丽 陈红 张泓泰 李传友
世界卫生组织(World Health Organization, WHO)发布的2020年全球结核病报告指出,中国估算结核病患者数约为84.2万例,而实际登记的患者数仅为62.4万例[1]。因此,开发快速准确的实验室诊断方法对于结核病患者的早发现、早治疗、阻止结核病的社区传播至关重要。目前,结核分枝杆菌常规检测中,萋-尼抗酸杆菌涂片镜检(简称“涂片”)速度快、方便、成本低,但阳性率低;分枝杆菌培养(包含罗氏培养和MGIT 960液体培养)周期长,无法解决快速诊断的问题;分子诊断方法中的GeneXpert MTB/RIF(简称“Xpert”)虽应用最广,检测时效较令人满意,但属于进口产品,检测成本较高。随着高通量测序技术的发展,利用其进行微生物检测、耐药预测及传播溯源的研究越来越多[2-5],而二代测序技术(next-generation sequencing, NGS)显示出高敏感度的特性。笔者将利用NGS技术直接对临床痰液标本进行结核分枝杆菌检测,并与现有其他相关检测方法进行比较[6],为推进其直接检测痰液标本的可行性提供有利证据。
对象和方法
一、研究对象
参照纳入标准选取2021年8—10月北京市疾病预防控制中心(北京结核病控制研究与防治所)门诊收治的49例疑似肺结核患者,其中男性31例,女性18例,年龄范围为16~86岁,年龄中位数(四分位数)为46(28,57)岁。每例患者采集5份清晨痰标本,共计245份,分别进行涂片、罗氏培养和MGIT 960液体培养、Xpert以及NGS检测。本研究获得本单位伦理审查委员会批准(批准编号:2021-03),并取得所有患者知情同意。
纳入标准:存在咳嗽、咳痰、发热、消瘦、盗汗等全身结核症状,胸部X线摄片异常,可采集到5 ml/次以上痰液标本,并愿意参加研究的疑似患者。
二、仪器和试剂
涂片染色液由珠海贝索生物技术有限公司生产;酸性罗氏培养基由河南赛诺特生物技术有限公司生产;MGIT 960全自动结核分枝杆菌快速液体培养仪及其配套试剂由美国BD公司生产;GeneXpert MTB/RIF核酸检测仪及试剂由美国Cepheid公司生产;MPB64菌群鉴定试剂盒由杭州创新生物检控技术有限公司提供;PCR-荧光探针法使用Roche LightCycler 480仪,试剂由北京博奥晶典生物技术有限公司生产;NGS-MTB基因组提取纯化试剂盒和NGS-测序文库构建试剂盒均由盛世中方(北京)生物科技有限公司提供;NGS分析结果由南京滕辰医学检验实验室报告。
三、研究方法
1.肺结核诊断标准:依据《WS 288—2017肺结核诊断》[7]和《非结核分枝杆菌病诊断与治疗指南(2020年版)》[8],将患者分为确诊病例(病原学检测阳性)、临床诊断病例(无病原学证据,但具有结核病临床体征、影像学异常或免疫学检查阳性)、非结核分枝杆菌(nontuberculosis mycobacteria,NTM)感染病例和非肺结核病例。
2.取样:采集患者5份清晨痰标本,每份不少于2 ml,一并送至门诊环保采样间。实验室当天取样当天检测。
3.涂片镜检:按照《结核病实验室检验规程》[9](以下简称“《规程》”)进行抗酸杆菌涂片镜检及结果判读。同一例患者3份标本用于痰涂片检测,任何一份痰标本发现抗酸杆菌即判定为涂片阳性。
4.培养:(1)罗氏培养:按照《规程》,分别从用于痰涂片检测的3份标本中任取2份痰标本各0.5 ml,使用4%NaOH以1∶1比例进行消化处理,15 min后各取0.1 ml接种到2个酸性罗氏培养基中。每周观察1次培养基,发现菌落生长后挑取菌落完成萋-尼染色涂片,发现抗酸杆菌则报告为培养阳性;2个月未见菌落生长即报告阴性。(2)MGIT 960液体培养:另取1份痰标本0.5 ml加入到50 ml圆底离心管内,再加入1~2 ml 2%NaOH和N-乙酰-L-半胱氨酸(NALC-NaOH)处理液,振荡消化15 min,加入40 ml无菌磷酸盐缓冲液(PBS,pH=6.8)中和离心(3000×g离心18 min),弃上清,加入1 ml PBS进行重悬沉淀,取0.1 ml接种到准备好的培养管内。阴性结果报告时间设为42 d。取仪器报阳培养液进行涂片镜检,确定菌纯度,并使用MPB64抗原法和PCR法进行初步菌群鉴定。(3)培养质量控制:罗氏培养基在冷藏条件下不超过2个月;每个月打印液体培养质量控制报告,每批MGIT培养管进行常规质量控制检测(使用结核分枝杆菌H37Rv菌液)。(4)结果判断:同一例患者两种培养方法中任一培养阳性则判定培养结果为阳性。
5.Xpert检测:取用于痰涂片检测的3份标本中的另1份痰标本1 ml,加入2 ml标本处理液,振荡混匀,消化15 min后,吸取2 ml液化标本于反应盒内,置入检测仪内自动检测,反应结束后可直接观察测试结果。所有检测步骤和质量控制均严格按照说明书进行。本实验室每年参加国家疾病预防控制中心结核病参比实验室组织的结核分枝杆菌分子检测室间质评,考核结果均合格。
6.MPB64菌群鉴定:对培养阳性的菌落或菌液进行菌群鉴定。取0.2 ml生理盐水于1.5 ml离心管内,加入1~2个罗氏培养阳性菌落涡旋混匀或阳性液体培养物,取0.1 ml混匀菌液滴入检测板加样孔内,15 min后观察结果。当检测线(T)和质控线(C)均出现红色条带时,表明培养物为结核分枝杆菌复合群(MTBC),判断为阳性;当检测线(T)处无条带,只有质控线(C)处出现红色条带时,表明培养物为NTM复合群,判断为阴性;如果质控线(C)处无条带出现,需重新检测。
7.PCR检测:对MPB64法检测阴性培养物进行PCR荧光探针法检查。吸取20 μl培养液入80 μl 核酸提取液,充分涡旋后放入核酸提取仪,最大转速振荡5 min,95 ℃水浴5 min,10 000×g离心3 min;取上清2 μl入扩增反应液,上机。样本扩增区线为S型,FAM通道阴性,HEX通道Ct值<40判定为NTM阳性。
8.NGS技术:(1)痰标本DNA提取:取最后1份痰标本1 ml,加入等体积或2倍体积的前NALC-NaOH处理液室温下振荡液化15 min。用PBS中和,3000×g离心18 min。离心后去上清,沉淀物用2 ml的PBS重悬,80 ℃水浴20 min。按照NGS-MTB基因组提取纯化试剂盒说明书进行痰菌基因组提取。按照痰液NGS-MTB检测文库构建试剂盒说明书对痰液中可能存在的结核分枝杆菌基因组进行rpoB基因文库制备。制备后的文库送至南京滕辰医学检验实验室,使用Illumina NextSeq 500进行上机测序,以H37Rv为参考基因组进行序列分析。由于研究所用的rpoB基因在鉴定NTM上还有一定的局限性,需要再增加其他基因才能够进行准确的NTM鉴定,故此次靶向NGS测序未关注NTM方面的鉴定。
四、统计学处理
使用SPSS 19.0对数据进行统计学分析。计数资料以“例(百分率,%)”描述,组间差异的比较采用χ2检验(样本量小于40时,采用Fisher精确概率法),以P<0.05为差异有统计学意义。以临床最终诊断为参照标准,评价涂片、培养、Xpert和NGS测序技术等方法的检测效能,并对各种方法与临床最终诊断的一致性进行Kappa检验。Kappa值在0.00~0.20为极低一致性、0.21~0.40为一般一致性、0.41~0.60为中度一致性、0.61~0.80为高度一致性、0.81~1.00为几乎完全一致。
结 果
一、4种方法检测结果
NGS检测49例疑似肺结核患者的阳性率[69.4%(34/49)]明显高于涂片、培养和Xpert[分别为44.9%(22/49)、51.0%(25/49)和49.0%(24/49)],差异均有统计学意义(χ2=17.614、17.018、20.753,P值均=0.000)。具体见表1。

表1 NGS技术与其他3种方法检测结果比较
二、4种方法在不同类型患者中的检测情况
最终确诊肺结核患者40例(81.6%),非肺结核患者9例(18.4%)。4种方法检测病原学阳性确诊肺结核患者的阳性率差异无统计学意义(P=0.261);检测病原学阴性肺结核患者的阳性率差异有统计学意义(P=0.000)。18例涂片阴性肺结核患者的痰标本经培养法和Xpert检测阳性者均为3例,NGS技术检测阳性者为10例,NGS技术检测阳性率[55.6%(10/18)]均明显高于培养和Xpert[均为16.7%(3/18)],差异均有统计学意义(均为χ2=8.704,P=0.013)。
非肺结核患者中,NTM感染者为经MGIT 960液体培养阳性后再经MPB64抗原检测及PCR初步菌群鉴定确诊;其他8例非肺结核患者结核病常规检查均为阴性,仅2例经NGS技术检测阳性(标本序列数都在100以上),该2例患者有长期咳嗽咳痰症状,按照非肺结核进行治疗后,症状无明显好转,其中1例复查CT显示未治愈,因此考虑结核感染可能。具体见表2。
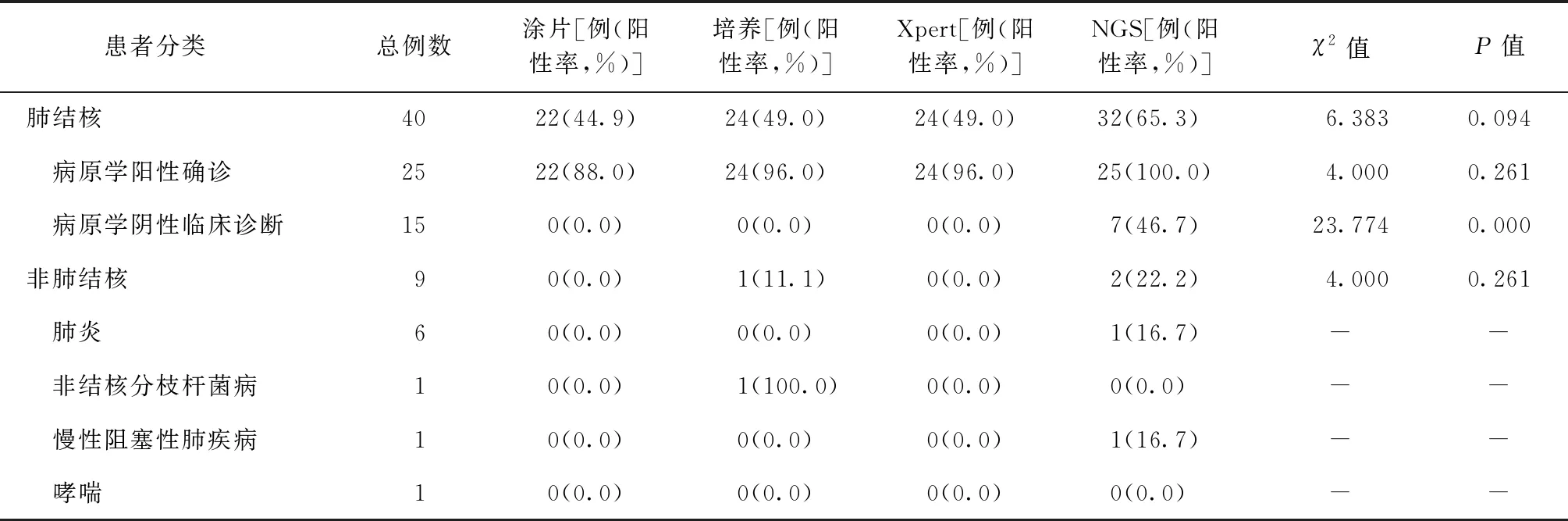
表2 49例临床疑似肺结核患者在4种方法中的检出情况
三、4种方法的检测效能
以临床诊断为参考标准,各种检测方法的敏感度、特异度、阳性预测值、阴性预测值及一致性情况见表3。其中,NGS技术的检测敏感度最高,培养和Xpert次之,涂片法最低。但涂片法和Xpert检测的特异度最高,而培养法特异度稍低,有1例经菌种鉴定为NTM;NGS技术的特异度最低,有2例阳性者为非肺结核。4种方法中,NGS技术的检测结果与临床诊断的一致率最高,一致性中等。
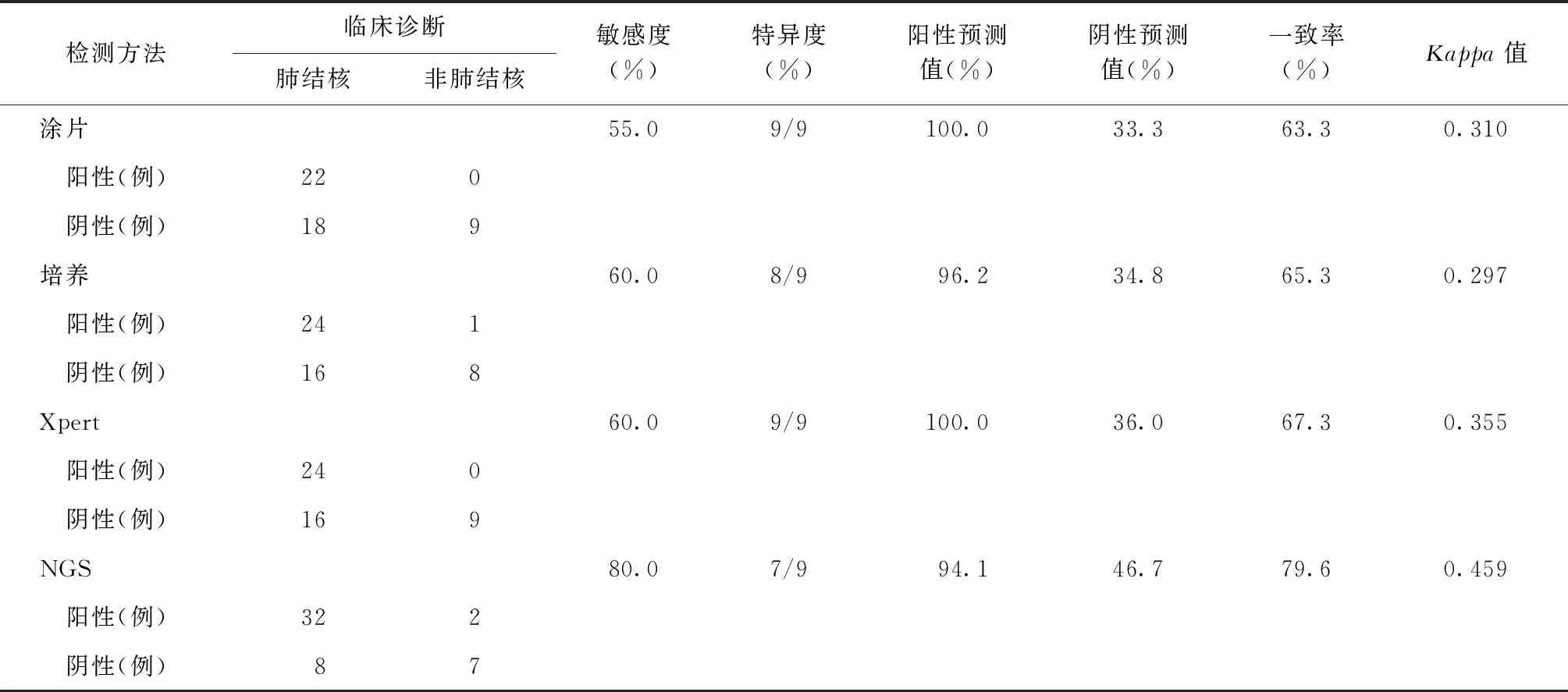
表3 4种方法检测痰标本中结核分枝杆菌的诊断效能
讨 论
《WS 288—2017 肺结核诊断》[7]中明确了结核分枝杆菌病原学检测方法有涂片、固体培养、液体培养及核酸检测。培养方法虽作为结核病诊断金标准但不能满足临床快速诊断的需求,核酸检测的代表是WHO强烈推荐的GeneXpert MTB/RIF试剂盒,以操作简便、时效短、高敏感度和高特异度而受到推崇[10-12]。虽然4种病原学检测方法联合应用可极大地提高结核病诊断效率[6],但作为结核病高负担国家,阳性检出率仍难以进一步提高,亟需开发新的快速高效准确的结核病诊断方法。
NGS技术又称高通量测序技术,是基于核酸序列的边合成边测序,可对多样本、多位点同时进行测序且具有较高覆盖率,已被应用于结核分枝杆菌的耐药预测、微进化与传播、谱系及亚种鉴定等研究[13-16]。尽管宏基因组NGS技术被越来越多地应用于结核病患者不同临床样本的检测中[17-18],但受制于既往昂贵的检测费用,该技术并没有得到临床广泛应用;加之现有研究多是基于临床分离菌株或少数基于痰标本结核分枝杆菌耐药性的分析[19-20],使得基于临床痰标本的诊断效能数据不足。为此,我们基于rpoB基因设计了单重PCR与NGS联合应用检测临床痰标本中结核分枝杆菌的实验,为其在结核病诊断上的价值提供了依据。
本研究对49例疑似肺结核患者痰液标本使用不同方法(涂片法、培养法、Xpert法和NGS技术)进行检测,发现NGS技术的检测阳性率明显高于其他3种方法,差异均有统计学意义,但几种检测方法对肺结核病原学阳性患者的检出率差异无统计学意义。值得注意的是,在检测病原学阴性或涂阴肺结核患者时,NGS技术的检测阳性率分别达到了46.7%和55.6%,显示出明显的技术优势,提示当可疑肺结核患者出现1种或多种病原学检测结果为阴性时,应及时对痰标本进行NGS检测,尽量前移诊断关口,为及早发现结核病患者提供病原学依据。同时发现,以临床最终诊断为参照标准,NGS技术对结核分枝杆菌检测的敏感度、一致率、Kappa值等均明显高于其他检测方法,提示NGS技术较其他传统检测方法,与临床诊断有较好的符合性,具备较高的诊断效能。
需要说明的是,在4种检测方法中,涂片和Xpert检测的特异度均达到了9/9,培养法次之(8/9),检出1例非结核分枝杆菌,而NGS技术的检测特异度低于这几种方法,为7/9,认为主要与2例疑似患者不能确诊为结核病有关。该2例患者均有较长时间的咳嗽咳痰症状,结核病常规筛查方法均阴性,在以诊断性肺炎治疗后,症状并无明显好转,针对此情况,研究重复分析了2例患者测序结果,均检测到结核分枝杆菌rpoB基因特异性序列,且序列数均大于100个,提示检出结核分枝杆菌。故笔者认为此2例非肺结核患者可高度可疑为肺结核,后续还需进一步收集患者标本并随访其症状发展及诊治情况。如该患者最终诊断为肺结核,则可大大提高NGS技术的检测特异度和临床应用价值。
周睍等[21]曾应用宏基因组二代测序技术对活动性结核病患者进行诊断价值评估,其检测标本为支气管灌洗液、脑脊液、胸腔积液、脓液、腹腔积液及肝组织,在确诊患者中NGS的检测敏感度为66.7%,特异度为100.0%,大大提高了活动性结核病的诊断效能。虽然该研究标本不包括痰液,但NGS测序技术能快速检测MTBC,为其在结核病早期辅助诊断方面的应用奠定了基础。2021年,全球结核病报告中特别提到了结核病新诊断技术的创新,其中就包括可直接分析痰标本的新一代测序方法[22]。本研究是基于rpoB基因的单重PCR-NGS技术,相对于宏基因组NGS检测结核病而言,该技术具备更强的靶向性,且具有建库和分析均相对简单、高通量、报告方便解读等特点。实验结果发现,NGS技术检测敏感度高,尤其是在肺结核临床诊断病例和常规病原学检测阴性患者中的阳性率尤为明显,具有很好的结核病诊断及防治应用前景。另外,本研究使用的单重PCR-NGS技术的费用方面与Xpert检测基本相当,明显低于宏基因组测序费用,而且该技术还可同时预测耐药情况,但由于例数较少,本文不做分析,但认为随着科技的不断进步,NGS技术将具有很大的应用前景。
本研究也存在以下局限:首先,因为本次研究经费所限,选例数量相对较少,可能对结果产生偏倚影响,但从研究纳入的病例中能够很明显的观察到NGS技术在阳性检出方面的优势,实验者后续将继续积累样本,以增大结果的代表性;其次,虽然NGS技术也可以同时预测结核分枝杆菌的耐药性,但限于研究选例中耐药患者数量不足以进行比较分析,今后的研究应增加样本量以及耐药的标本数,进行更详细的分组和深入分析;最后,NGS测序结果阳性的疑似肺结核患者,后续的复检和抗结核治疗效果追踪需在患者同意的情况下进行,可能会对诊断结果的最终判定产生一定影响。
利益冲突所有作者均声明不存在利益冲突
作者贡献代小伟:研究设计、数据分析及论文撰写;王嫩寒、陈双双、陈红:采集和整理数据;杨新宇和田丽丽:课题沟通及技术支持;张泓泰和李传友:研究设计、数据分析和知识性指导
