c-型钠钛对小鼠胚胎体外发育的影响
2022-07-06杨诗雨施泓如王晓东刘瑞妍倪志翔佟英伟何长久
杨诗雨,施泓如,王晓东,刘瑞妍,倪志翔,佟英伟,刘 成,李 翔,何长久
(华中农业大学 动物科技学院动物医学院/农业动物遗传育种与繁殖教育部重点实验室/国家级国际联合研究中心,武汉 430070)
胚胎体外生产(IVP)既是人类辅助生殖的技术基础,也是畜牧业中提高母畜繁殖潜力、加快品种改良及种质资源保存的重要手段。胚胎发育效率是制约IVP技术推广的核心因素。早期胚胎比较脆弱,极易受培养环境的影响,如渗透压、温度、pH值的微小改变都会影响胚胎质量,甚至造成胚胎发育阻滞。因此,改进培养液配方是优化IVP技术的主要手段。无论是在生殖医学还是畜牧生产中,被移植的大多是在体外发育至囊胚阶段的胚胎,因为相比更早阶段的胚胎,囊胚移植妊娠率较高。正因为如此,囊胚发育率、囊胚孵化率及囊胚细胞数是评价IVP技术先进性的核心指标。近20年以来,科学家们一直在致力于改进胚胎培养液的成分以提高胚胎存活率和囊胚发育率。
囊胚腔的形成是胚胎主动摄入水分并储存在内部的结果。研究表明,桑椹胚细胞膜上的Na/K泵所营造的内外渗透压梯度差是胚胎摄入水分的主要动力。水分子通过自由扩散或水通道蛋白介导的被动转运方式不断进入胚胎内部,导致囊胚腔的形成与扩张。c-型钠钛(CNP)是钠钛家族的主要成员,与心房钠钛和脑钠肽具有相似的化学结构。研究表明,CNP不仅参与泌尿系统与循环系统的水钠转运,而且还能影响神经胶质细胞中水通道蛋白的表达。越来越多的证据表明,CNP还作为局部信号直接调控哺乳动物生殖活动。在雌性哺乳动物中,CNP不仅可以维持卵母细胞减数分裂阻滞,而且还能促进小鼠早期卵泡的发育。在雄性动物中,CNP已被证实可以调节生精作用、精子运动和睾酮合成。有研究报道,CNP处理的牛卵母细胞,经过体外受精或者孤雌激活,胚胎的囊胚率和质量均得到了显著提高。
鉴于CNP在生殖活动中广泛的调节作用,研究者在体外成熟液中添加CNP,显著提高了卵母细胞的质量。然而,CNP对胚胎体外发育的影响鲜有报道。研究表明,在胚胎和胎盘中均能检测到CNP信号,并且妊娠期子宫中CNP基因表达水平比孕前会升高7倍左右。据此推测CNP可能参与了胚胎发育调控。为了验证这一推测,本试验以小鼠为模型,分别在2细胞胚胎和囊胚腔形成阶段添加CNP,统计CNP对4细胞率、囊胚率、囊胚成腔率、囊胚腔扩张率、囊胚孵化率、囊胚腔直径、囊胚腔面积占比及囊胚总细胞数的影响,现报道如下。
1 材料
1.1 试验动物
3周龄雌性昆明近交系小鼠40只,购自华中农业大学实验动物中心,饲养期间保持12 h/12 h的明暗周期变化(08:00—20:00光照),动物房温度保持22~26℃,自由饮水,自由采食。
1.2 主要试剂
孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG),购自宁波第二激素厂;透明质酸酶、KSOM培养液与石蜡油,购自Sigma-Aldrich(上海)贸易有限公司;DAPI、磷酸盐缓冲液(PBS)、4%多聚甲醛与防荧光淬灭剂(DABCO),购自武汉塞维尔生物科技有限公司;CNP,购自Med Chem Express公司;卵母细胞操作液(M2液),购自北京迈晨科技公司。
1.3 主要仪器、设备
体视显微镜,NIKON公司产品;荧光正置显微镜,Olympus公司产品;CO细胞培养箱,Thermo Fisher Scientific公司产品;超净工作台,北京亚泰科隆仪器技术公司产品。以上仪器、设备均由华中农业大学农业动物遗传育种与繁殖教育部重点实验室提供。
2 方法
2.1 小鼠超数排卵及配种
雌性小鼠腹腔注射PMSG 5 IU以促进卵泡发育,46 h后再注射hCG 5 IU。随后将其与性成熟雄性小鼠进行1∶1合笼,并于次日检查阴道栓以确定交配情况,检查发现见栓30只,将其随机分成两批,其中15只小鼠用于2细胞/4细胞转变阶段添加CNP试验,另外15只用于桑椹胚阶段添加CNP试验。
2.2 体内受精卵的获取与处理
在hCG注射22 h后,采用颈椎脱臼法处死见栓小鼠并分离输卵管,在M2操作液中用注射器针头扎破输卵管膨大部以释放受精卵。随后使用0.3%透明质酸酶溶液去除胚胎周围多余卵丘细胞,将清洗完毕的受精卵转移至KSOM 培养液中,并置于5%CO、37℃培养箱中继续培养。
2.3 胚胎培养
将CNP浓储液按不同体积分别加到KSOM培养液中,最终CNP浓度为0(对照组)、100μg/L(1组)、200μg/L(2组)。采用微滴法进行胚胎培养,每滴培养液50μL,用石蜡油封闭。当胚胎发育至2细胞阶段时,将2细胞随机分配到对照组(17枚)、1组(20枚)、2组(21枚)微滴中继续培养,随后统计4细胞率与囊胚率。当胚胎发育至致密桑椹胚阶段时,将桑椹胚随机分配到对照组(40枚)、1组(38枚)、2组(37枚)微滴中继续培养,随后统计囊胚成腔率、扩张率、孵化率以及囊胚细胞数等指标。
2.4 DAPI染色
使用多聚甲醛固定囊胚,将固定后的囊胚转移到DAPI染色液中,室温孵育10 min。用PBS清洗3次后将囊胚转移至含防荧光猝灭剂的载玻片上,并于荧光显微镜下观察拍照。
2.5 测定项目及数据的统计分析
为研究CNP对囊胚总细胞数的影响,对含不同浓度CNP的培养液中发育24 h的囊胚进行DAPI染色,并拍照统计各组囊胚总细胞数。
将2细胞在不同浓度CNP的培养液中培养,24 h后统计4细胞率(4细胞数/2细胞数×100%);72 h后统计囊胚率(囊胚数/2细胞数×100%]。桑椹胚在不同浓度CNP的培养液中培养24 h后统计囊胚成腔率(囊胚数/桑椹胚数)×100%]、囊胚扩张率(扩张囊胚数/桑椹胚数×100%)、囊胚腔面积占比(囊胚腔面积/囊胚总面积×100%)和囊胚腔直径;48 h后统计孵化率(孵化囊胚数/桑葚胚数×100%)。
采用Image J软件测量扩张囊胚的直径和囊胚腔面积,用IBM SPSSStatistics 24软件对所得的数据进行差异分析,用GraphPad Prism 8.0.2软件作图。多组数据间的显著性比较采用单因素方差分析,百分率数据采用卡方检验及Bonferroni方法进行分析,<0.05视为两个数据间差异显著。
3 结果与分析
试验首先确定了胚胎发育至各阶段所需的时间。受精卵在体外培养24 h后发育至2细胞(见图1A);48 h后发育至4细胞(见图1B);72 h后发育至桑椹胚(见图1C);96 h后发育至囊胚(见图1D),此刻可观察到扩张囊胚,即囊胚腔扩张至囊胚总面积的1/2以上;120 h后发育至孵化囊胚(见图1E)。
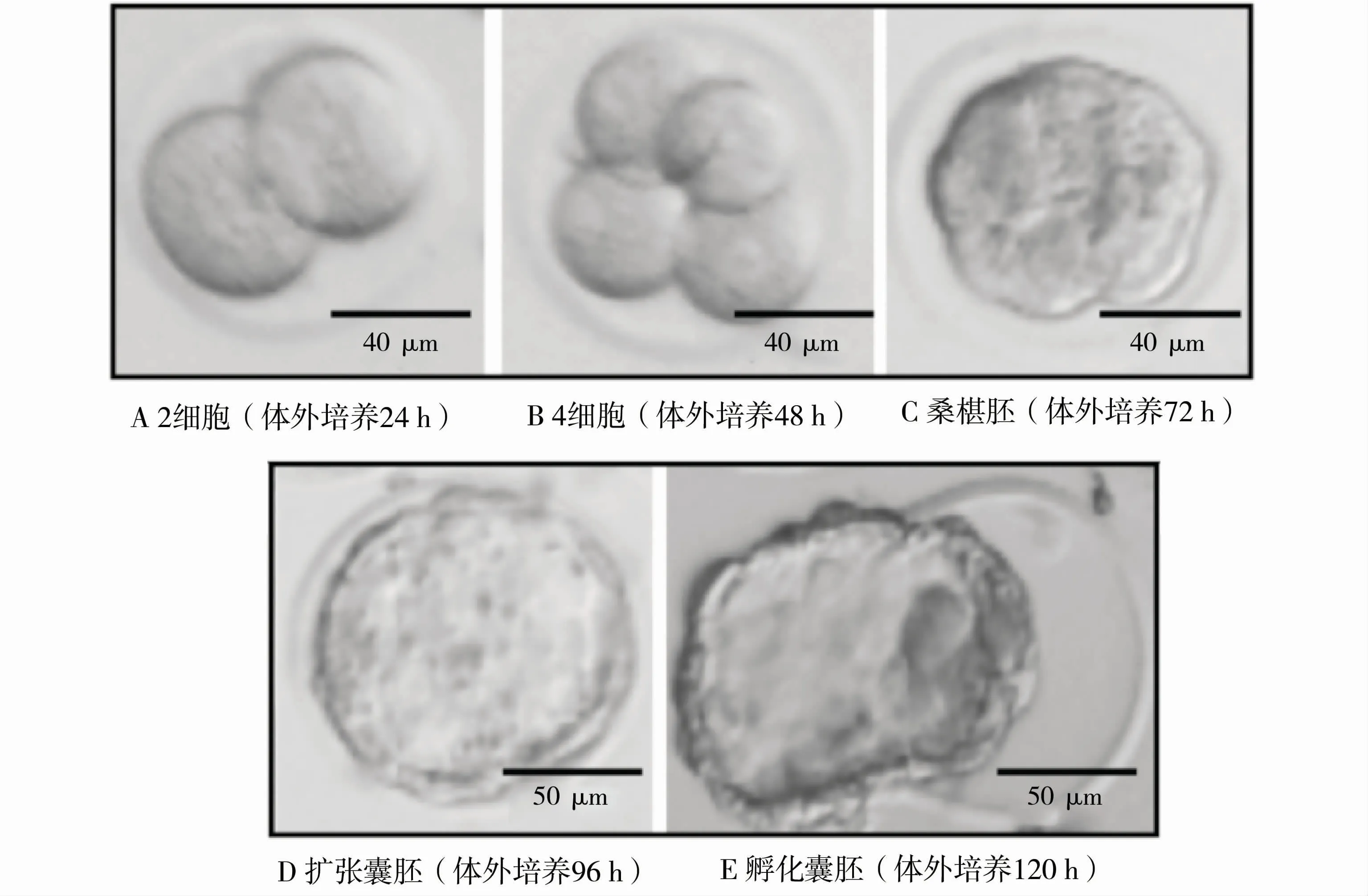
图1 早期胚胎发育不同阶段代表性图片Fig.1 Representative images of different stages of early embryonic development
3.1 早期胚胎体外发育各阶段的观察
3.2 2/4细胞转变阶段添加CNP对胚胎发育的影响
将2细胞随机分配到含CNP浓度为0,100,200μg/L的微滴中培养,24 h后统计4细胞发育率(2细胞在不同浓度CNP的培养液中培养24 h后的代表性图片见图2),72 h后统计囊胚率。结果表明,与对照组相比,1组4细胞率无显著差异(52.50% vs 68.42%,>0.05),2组4细 胞 率 显 著 降 低(33.3% vs 68.42%,<0.05),见图3A。1组和2组的胚胎均无法继续发育至囊胚阶段,见图3B。

图2 2细胞在不同浓度CNP的培养液中培养24 h后的代表性图片Fig.2 Representative images of 2-cell cultured in different doses of CNP medium for 24 hours
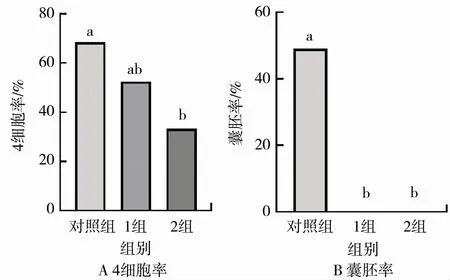
图3 2细胞/4细胞转变阶段添加CNP对胚胎发育的影响Fig.3 Effects of adding CNP on embryonic development at the transition stage from 2-cell to 4-cell
3.3 CNP对小鼠囊胚的成腔与扩张的影响
桑椹胚在不同浓度CNP的培养液中培养的代表性图片见图4。与对照组相比,1组囊胚成腔率(83.10% vs 90.28%)、囊胚腔扩张率(56.34% vs 66.67%)、孵化率(15.49% vs 15.28%)、囊胚腔面积占比(50.77% vs 51.99%)和囊胚腔直径[(86.42±2.76)μm vs(95.29±4.13)μm]均无显著差异(>0.05);而2组囊胚成腔率(43.78% vs 90.28%)、囊胚腔扩张率(17.91% vs 66.67%)、孵化 率(4.48% vs 15.28%)、囊 胚 腔 面 积 占 比(38.15% vs 51.99%)和囊胚腔直径[(73.30±3.22)μm vs(95.29±4.13)μm]均显著降低(<0.05),见图5。
图4 桑椹胚在不同浓度CNP的培养液中培养的代表性图片Fig.4 Representative images of morula cultured in different doses of CNP medium

图5 CNP对小鼠囊胚成腔与扩张的影响Fig.5 Effects of CNP on the cavity formation and expansion of blastocysts in mouse
3.4 CNP对囊胚总细胞数的影响
DAPI染色代表性图片见图6。经统计,1组(41.38±2.71 vs 55.12±3.06)和2组(38.29±2.47 vs 55.12±3.06)囊胚总细胞数与对照组相比均显著下降(<0.05),见图7。
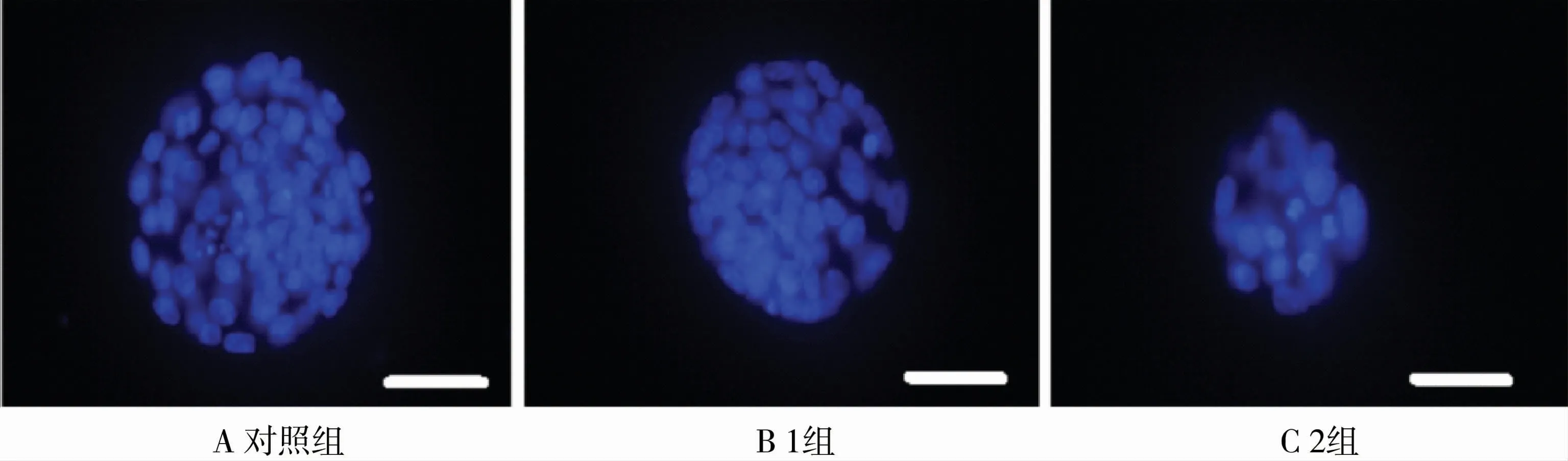
图6 DAPI染色代表性图片(标尺=50μm)Fig.6 Representative images of DAPI staining(scale bar=50μm)
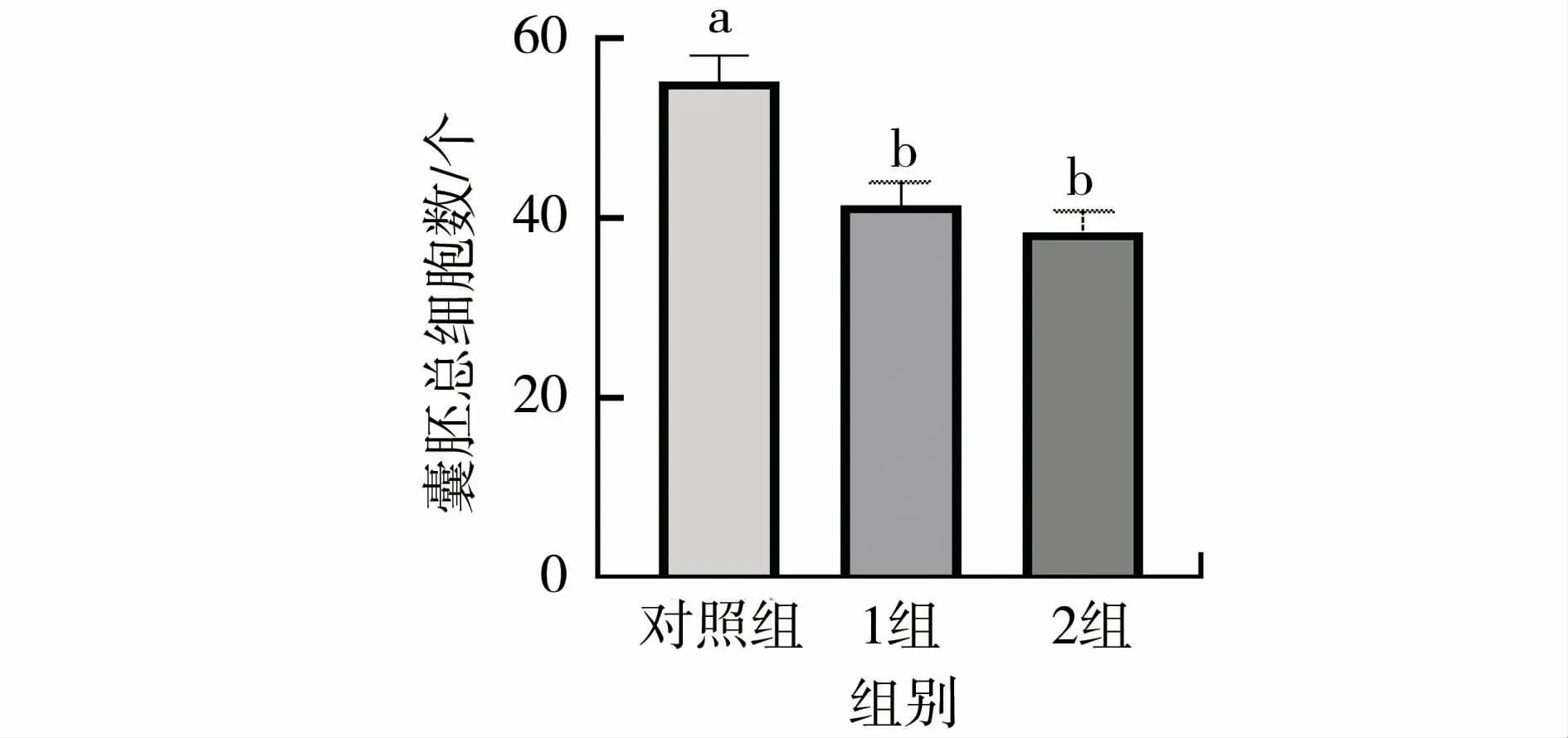
图7 桑椹胚在CNP培养液中培养24 h时囊胚总细胞数Fig.7 The total number of blastocyst cells of morula cultured in CNP medium for 24 hours
4 讨论与结论
小鼠胚胎早期发育过程中,合子基因组激活发生在2细胞阶段,若合子基因组激活失败,就会出现胚胎发育阻滞的现象。本试验中,CNP的添加导致2细胞向4细胞胚胎转变的效率显著下降,并且CNP组少数发育至4细胞的胚胎也无法完成后续发育。说明CNP对早期胚胎的卵裂可能具有广泛的抑制作用,但CNP发挥上述抑制作用的机制尚不清楚。
囊胚腔形成的关键在于水分在胚胎内部的积累,水分积累效率越高囊胚发育越快。因此,囊胚率、囊胚腔扩张率、囊胚扩张等级及囊胚孵化率可以作为囊胚质量评估的形态学指标。当CNP浓度为100μg/L时,与CNP浓度为0相比,囊胚成腔率、囊胚腔扩张率、囊胚腔面积占比和直径均呈下降的趋势,但是差异不显著(>0.05);当CNP浓度继续升高至200μg/L时,囊胚成腔率、囊胚扩张率、孵化率、囊胚腔直径和囊胚腔面积占比继续明显下降,与CNP浓度为0相比差异显著(<0.05)。这说明在胚胎培养液中添加CNP对囊胚腔的形成也有抑制作用。相比于体外囊胚,体内囊胚的总细胞数明显更多。细胞数是评价胚胎细胞周期进展能力和发育潜能的关键指标,研究表明,发育潜能、着床率、活产率都随着细胞数的增加而增加。细胞数降低的原因之一可能是发育停滞或迟缓导致细胞周期延长的结果。本试验中,添加CNP显著降低囊胚总细胞数,这说明CNP对早期胚胎发育潜力具有抑制作用。
50年前,用于胚胎体外培养的培养基问世,经过几十年的探究,目前已经具有比较成熟的胚胎培养系统,培养液能够提供胚胎生长所必需的碳水化合物、氨基酸、无机盐等营养物质和渗透压维持因子。有研究发现,在培养液中添加生长因子或多肽有助于提高胚胎发育的质量,比如添加表皮生长因子、类胰岛素一号生长因子等能够增加囊胚的内细胞团数量,提高囊胚率。CNP不仅具有调节水钠转运的功能,而且还能调控中枢神经系统中水通道蛋白的表达。在小鼠妊娠过程中,在子宫中能检测到CNP特异性的高表达。鉴于囊胚形成依赖于水分转运,因此笔者推测CNP可能影响囊胚腔的形成。最终的试验结果显示CNP对胚胎体外发育表现为广泛的抑制作用,并且主要体现在对卵裂的抑制上。但本研究尚不能排除CNP具有促进囊胚成腔的可能性,因为CNP对卵裂的抑制作用足以掩盖CNP对囊胚腔形成的促进作用。尽管CNP不具有提高胚胎体外发育效率的潜力,但本研究的意义在于阐明了CNP在早期胚胎发育过程中的作用,它可以作为一种有效的胚胎发育抑制剂。需要指出的是,本研究是采用外源添加的方式来评估CNP对体外胚胎发育的影响,并不清楚CNP信号缺失后胚胎所受到的影响。这一问题有待在未来的研究中借助基因编辑技术进行深入探讨。
本研究证实CNP不仅阻碍小鼠2细胞向4细胞胚胎的转变,还抑制囊胚腔的形成与扩张,降低囊胚质量。说明CNP是一种早期胚胎发育的有效抑制分子。
