诱导乳腺上皮细胞重编程前后miRNA表达谱差异分析
2022-07-06吕丹薇张丹丹刘明星胡雅楠王国栋覃梁珊
吕丹薇,张丹丹,刘明星,胡雅楠,王国栋,覃梁珊,黄 奔,*
(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,南宁 530004;2.广西壮族自治区人民医院,南宁 530004)
乳腺生物反应器是少数可以合法用于商业用途的重组蛋白获得系统之一,具有获得的蛋白产量高、纯化简单等特点,有着广阔的生产应用及研究前景。山羊乳腺具有高产奶量和强大的翻译后修饰能力,被认为是非常具有应用前景的重组蛋白生产系统。然而传统的乳腺生物反应器的获得需要涉及到转基因胚胎及转基因动物的获得,整个过程前期投入大且成功率低,严重限制了乳腺生物反应器的生产与应用。因此,如果能在体外获得功能性的乳腺上皮细胞,并将其应用于转基因乳腺的重建,或许可以很好地解决乳腺生物反应器的生产限制问题。
传统的体外获得功能性乳腺上皮细胞的方法主要采用原代细胞分离技术,这种方法存在细胞获得率低、耗时长、易污染等缺陷。细胞重编程技术在体外获得功能性细胞方面的应用为乳腺上皮细胞的获得提供了新的解决方案。常见的诱导细胞发生重编程的方法包括转录因子和小分子化合物,随着研究的不断深入,一些miRNA也陆续被发现可以用来诱导细胞发生重编程。
miRNA是一类长度约为22 bp的内源性小分子非编码RNA,在物种间具有较高的保守性。miRNA对基因表达的调控主要表现在基因转录后的调控。在细胞重编程方面,miRNA通过负向调节各种关键的mRNA的表达,在重编程过程中调控细胞表型的改变,在重编程后维持细胞表型的稳定。有研究表明,miRNA在诱导细胞多能性和重编程细胞的获得方面发挥着重要作用,不仅可以与转录因子联合调控细胞重编程,还可以单独调控细胞重编程以获得诱导高能干细胞(IPSC)、神经细胞和心肌细胞等功能性细胞。此外,miRNA在乳腺发育及泌乳环节也发挥着重要的作用。例如,miR-126-2p、miR-15a调节β酪蛋白的分泌,miR-454、miR-143、miR-15b和miR-27a可以调节乳脂的合成代谢,miR-484、miR-155、miR-143可以调节乳糖的合成与代谢。尽管已有研究相继报道了许多与大家畜乳腺发育和泌乳相关的miRNA,但至今还没有研究关注miRNA在大家畜重编程乳腺上皮细胞获得前后表达水平的变化,也未见大家畜miRNA在重编程过程中的调控机制研究。
广西大学黄奔课题组(以下称“本课题组”)前期通过使用含有Forskolin、TTNPB、VPA、Repsox、Tranylcypromine五种小分子化合物的诱导培养基,对山羊耳缘成纤维细胞进行了为期8 d的诱导,成功地将山羊耳缘成纤维细胞重编程为具有泌乳能力的乳腺上皮细胞。本研究建立在前期研究的基础上,旨在通过对重编程前后的细胞进行Small RNA测序和生物信息学分析,揭示重编程前后细胞miRNA表达水平的变化,并在Small RNA水平上印证重编程前后细胞命运的改变,现报道如下。
1 材料与方法
1.1 细胞样品来源
诱导前的山羊耳缘成纤维细胞、诱导8 d的山羊耳缘成纤维细胞,均为本课题组前期研究中保存的细胞样品,具体见参考文献[19]。
1.2 主要试剂和仪器设备
TRIzol,购自武汉赛维尔生物科技有限公司;琼脂糖,购自BIOWEST公司;cDNA合成试剂盒、荧光定量PCR试剂盒,购自南京诺唯赞生物科技股份有限公司。
超净工作台,苏州佳德净化科技公司产品;离心机,Eppendorf公司产品;电泳仪,Bio-Rad公司产品;PCR仪,Analytikjena公司产品;荧光定量PCR仪,罗氏(Roche)公司产品;安捷伦2 100 RNA Nano 6 000 Assay Kit,美国Agilent公司产品;K5500分光光度计,北京凯奥科技发展有限公司产品。以上仪器、设备均由广西大学亚热带农业生物资源保护与利用国家重点实验室提供。
1.3 Small RNA文库的构建及测序
以诱导前的山羊耳缘成纤维细胞为试验组、诱导8 d的山羊耳部缘成纤维细胞为对照组。两组的Small RNA文库构建及测序交由安诺优达基因科技(北京)有限公司完成。详细步骤:(1)样品处理。使用TRIzol法从样品中提取总RNA。(2)总RNA质检。采用2%琼脂糖凝胶电泳检测总RNA是否有杂质和降解情况,采用凯奥K5500分光光度计检测总RNA纯度,采用安捷伦2 100 RNA Nano 6 000 Assay Kit检测总RNA样品的浓度及完整性。(3)构建测序文库。利用胶分离技术对质检合格的总RNA进行片段选择,选择15~35 nt的片段。对筛选后的RNA片段分别进行3′接头和5′接头的连接,并将其反转录为cDNA。通过PCR扩增,建立测序文库,并对构建好的测序文库进行进一步库检,参考图1。(4)上机测序。采用SE50测序策略对库检合格的文库进行Illumina HiSeq高通量测序。
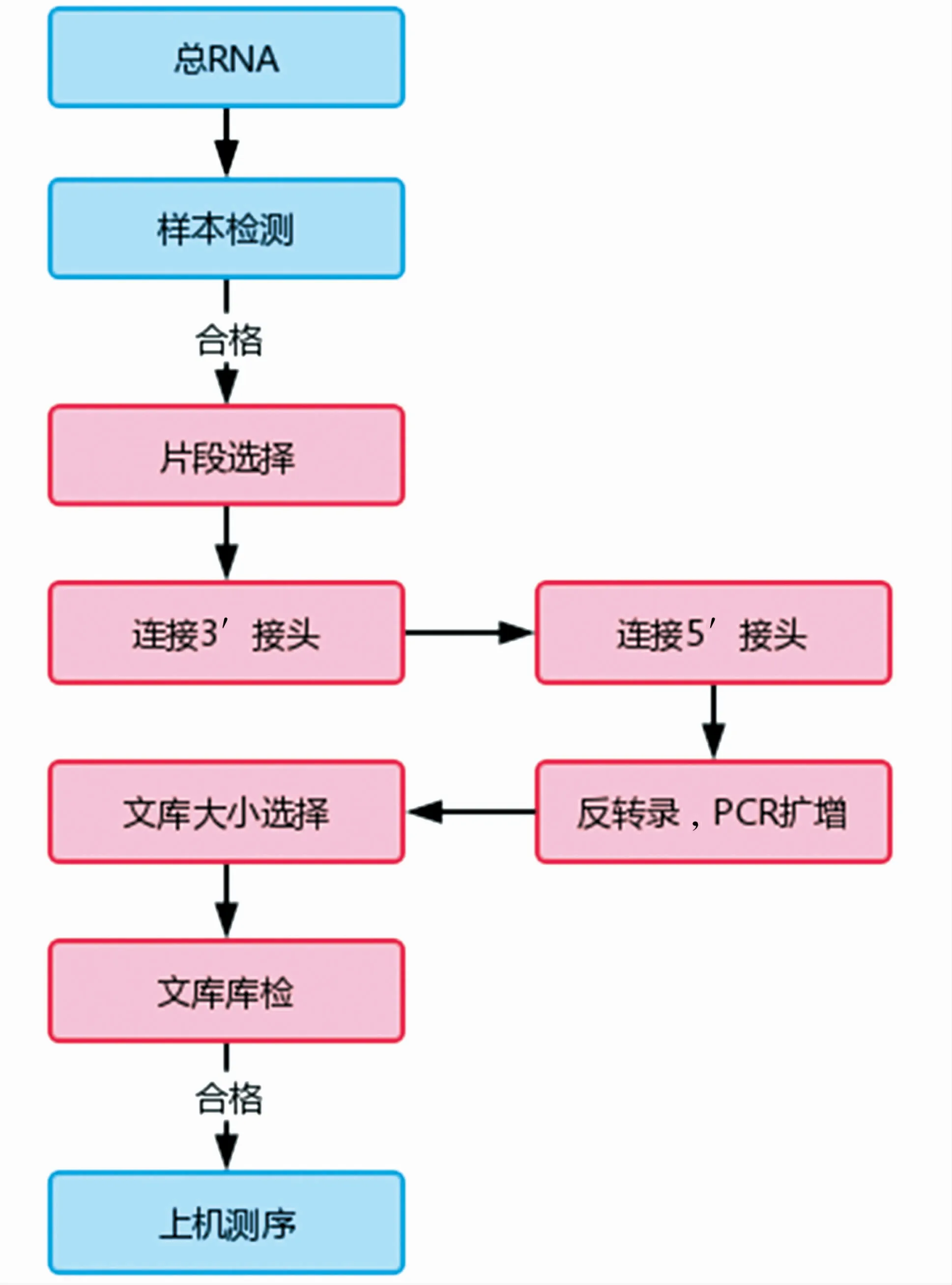
图1 Small RNA文库构建流程Fig.1 Small RNA library construction process
1.4 差异miRNA的筛选与分析
获得测序原始数据后,将4行数据作为一个单位,对原始数据的条数进行统计。接着,去除原始数据中低质量的、N比例大于10%的、没有3′接头的、去除两端接头长度为0的、包含ployA/T的序列,并进行Q20、Q30质控,去掉长度<15 nt和>35 nt的所有重复序列,得到过滤后的数据(clean reads)。通过基因组比对分析软件Bowtie 1.1.2将上述clean reads与参考基因组比对,条件设置为完全匹配,获得clean reads在参考基因组中的定位信息。将比对上基因组序列的clean reads与miRbase数据库进行比对,获得已知miRNA。对于没有被注释为已知miRNA的clean reads,使用miRDeep2软件中的方法进行新miRNA的预测。
采用DEseq软件对已知miRNA和新miRNA进行差异表达分析,筛选条件:校正后值<0.05(padj<0.05)且试验组和对照组平均表达量倍数变化的ln值绝对值≥1(|ln(Fold_change)|≥1),使用BenJamini&Hochberg法进行多重检验,矫正错误发现率值(false discovery rate,FDR),并根据上述FDR值筛选出差异显著的miRNA。使用miRanda 3.3a预测差异miRNA的靶基因,并使用R语言对靶基因进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.5 差异miRNA的RT-qPCR验证
随机选取7个差异显著的已知miRNA对差异分析结果进行RT-qPCR验证。miRNA引物设计参考miRBase上的miRNA成熟体序列,使用Vazyme公司开发的MiRNA Design软件进行设计,由擎科生物南宁合成部合成,引物序列参考表1。使用Vazyme HiScriptⅢRT SuperMix for qPCR(货号R323-01)逆转录酶将RNA反转录为cDNA。以山羊U6为内参,用Vazyme Q711-02/03试剂盒的方法对获得的cDNA进行荧光定量PCR,反应体系见表2。反应程序:95℃预变性3 min;95℃变性10 s,60℃退化30 s,共40个循环;95℃反应15 s,生成熔解曲线。每个样本设计4个技术重复孔,在Roche定量PCR仪中进行反应,数据结果采用2法进行计算,用SPSS 20对数据进行分析。
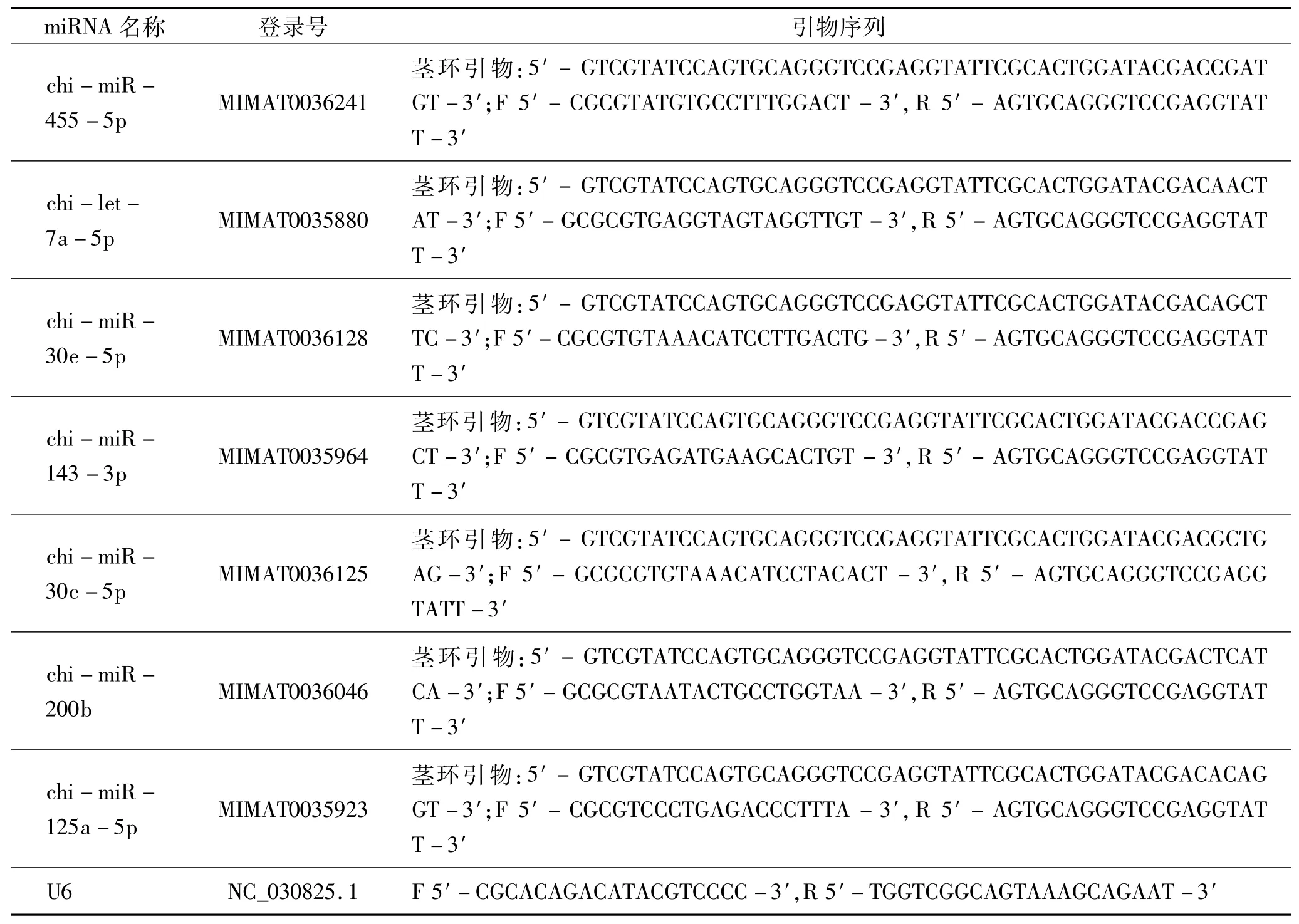
表1 RT-qPCR引物信息Tab.1 Primer information of RT-PCR

表2 RT-qPCR反应体系Tab.2 RT-qPCR reaction system μL
2 结果与分析
2.1 测序数据的预处理和比较
测序结果显示:对照组、试验组的山羊成纤维细胞均获得13 442 618条原始数据。对原始数据进行进一步处理后,对照组、试验组分别获得11 390 634,11 457 432条clean reads,各样本Q20碱基百分比均在98.81%以下,Q30碱基百分比均在98.05%以下。将对照组和试验组的clean reads与参考基因组比对,对照组平均有8 693 829条clean reads与山羊参考基因组匹配,平均匹配率为78.21%;试验组平均有8 733 739条cleans reads与山羊参考基因组匹配,平均匹配率为76.3%。以上结果表明,clean reads具有可靠性,数据质量均一良好,可用于后续分析。
2.2 差异表达miRNA的筛选
经过所有样本的clean reads比对,已知miRNA 403个,预测到新miRNA 125个。在已知miRNA中,有135个miRNA差异显著(<0.05),其中有72个miRNA显著上调(<0.05)、63个miRNA显著下调(<0.05)。在新miRNA中,有11个miRNA差异显著(<0.05),其中有6个miRNA显著上调(<0.05)、5个miRNA显著下调(<0.05)。差异显著程度排名前15位的miRNA见表3、图2。
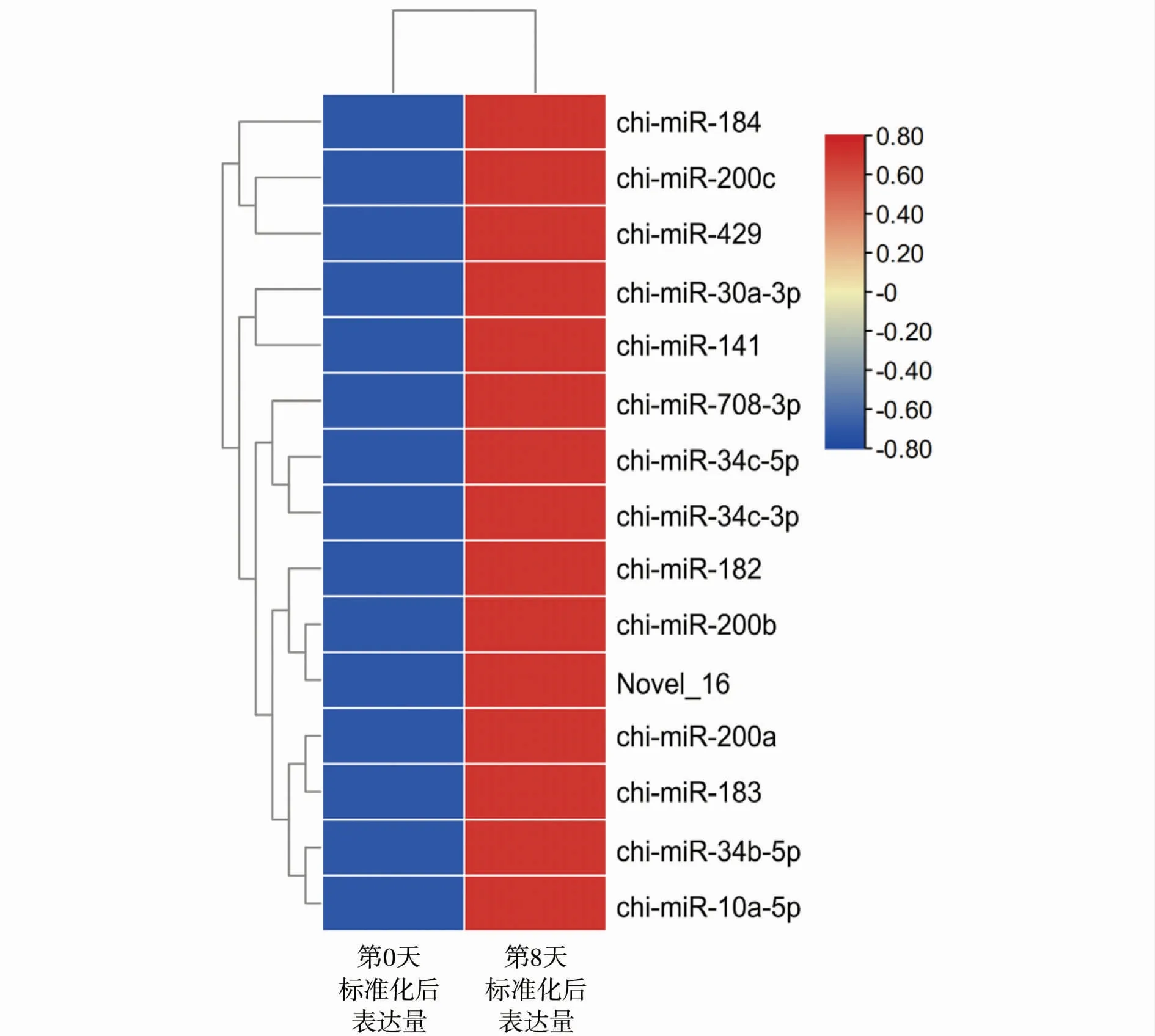
图2 差异miRNA丰度热图Fig.2 Heatmap of differentially expressed miRNA abudance
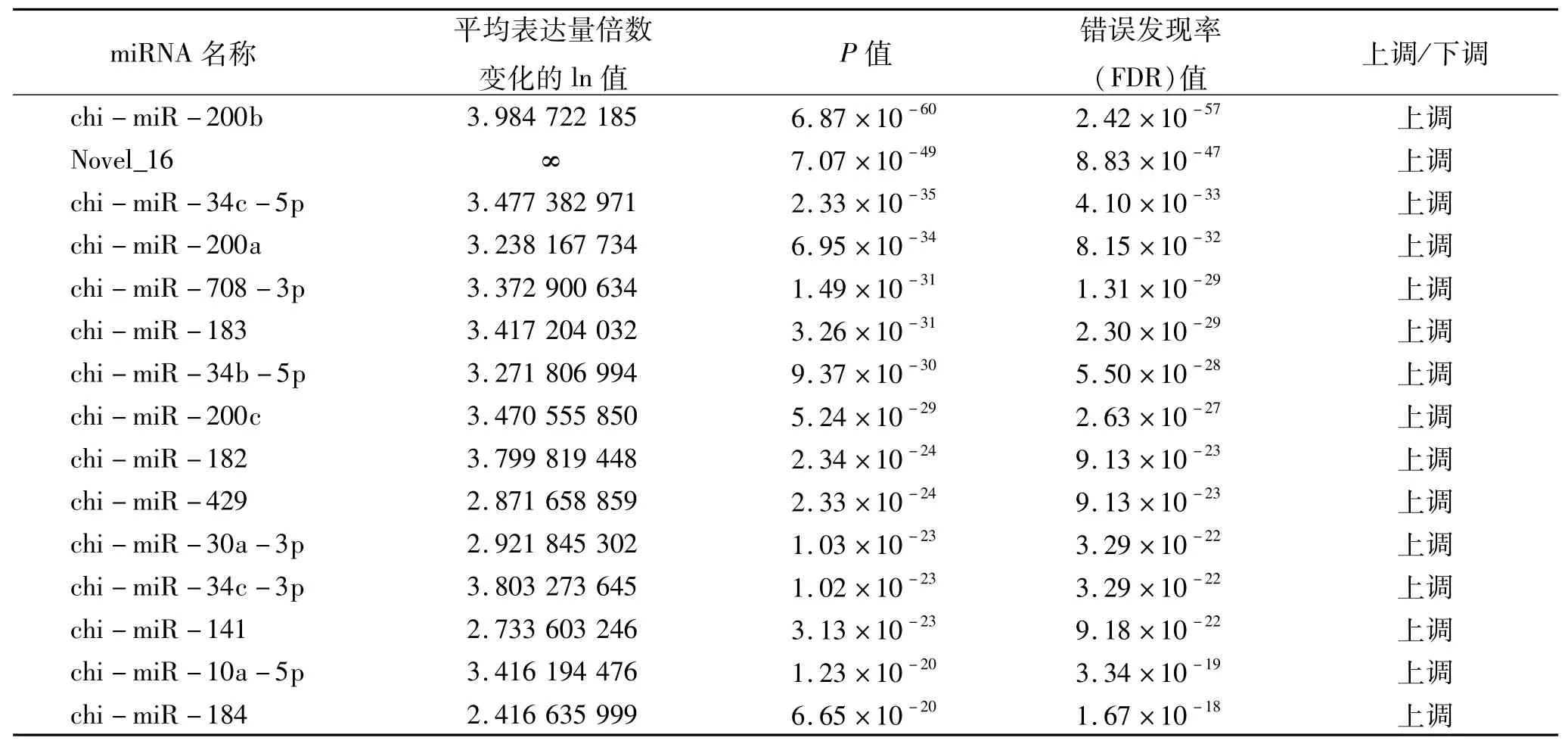
表3 差异表达miRNA(排名前15位)Tab.3 Differentially expressed miRNA(top 15)
2.3 差异表达miRNA的定量PCR验证
为了进一步验证重编程前后已知miRNA及基因差异分析结果的准确性,以山羊U6作为内参,随机选择了7个差异显著的已知miRNA进行定量PCR验证。结果显示,与重编程前相比,重编程后chimiR-455表达量下调,chi-let-7a-5p、chi-miR-30e-5p、chi-miR-143-3p、chi-miR-30c-5p、chi-miR-200b、chi-miR-125a-5p表达量上调,其中chi-miR-30e-5p、chi-miR-143-3p、chimiR-30c-5p、chi-miR-200b表达量极显著上调(<0.000 1)。综上所述,差异miRNA的定量结果与测序数据的差异分析结果一致,见图3。说明测序数据真实有效,重编程前后miRNA的差异表达分析结果具有一定的参考价值。
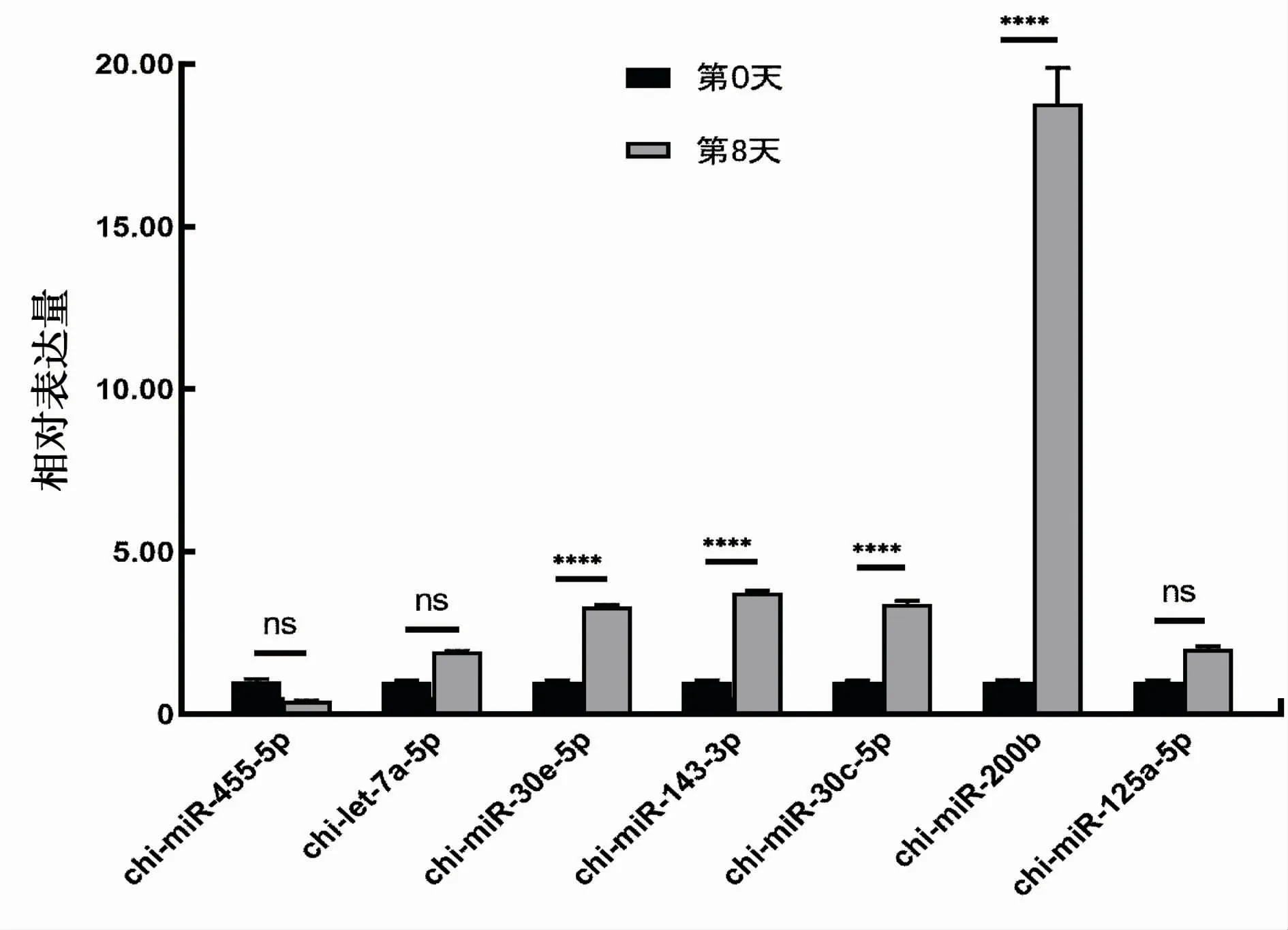
图3 差异miRNA的RT-qPCR验证图Fig.3 RT-qPCR validation results of differential miRNAs
2.4 差异表达miRNA的靶基因富集分析
通过135个差异显著的已知miRNA,共预测到13 257个无重复差异靶基因,通过11个差异显著的新miRNA共预测到2 885个无重复差异靶基因,共富集到18 732个GO条目。具有显著差异的已知miRNA和新miRNA的靶基因的分子功能(molecular function)主要与结合(binding)、催化活性(catalytic)、信号转导(signal transducer)、分子传导(molecular transducer)等相关;参与的生物过程(biological process,BP)主要包括细胞进程(cellular process)、生物调控(biological regulation)、单一生物进程(single-organism process)、代 谢 进 程(metabolice process)、细胞组分和生物发生(celluar component organization or biogenesis)、发育进程(developmental process)等;细胞组分主要与细胞(cell part)、细胞器(organelle)、细胞器组分(organelle part)、膜(membrane)、膜组分(membrane part)等相关。其中生物调控(biological regulation)、代 谢 进 程(metabolice process)、细胞组分和生物发生(celluar component organization or biogenesis)、发育进程(developmental process)等生物进程与细胞重编程及乳腺发育分化密切相关,见图4、图5。
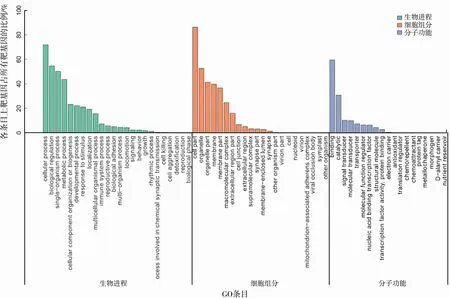
图4 差异已知miRNA靶基因的GO功能富集分析Fig.4 GO functional enrichment analysis of differentially expressed known miRNA target genes
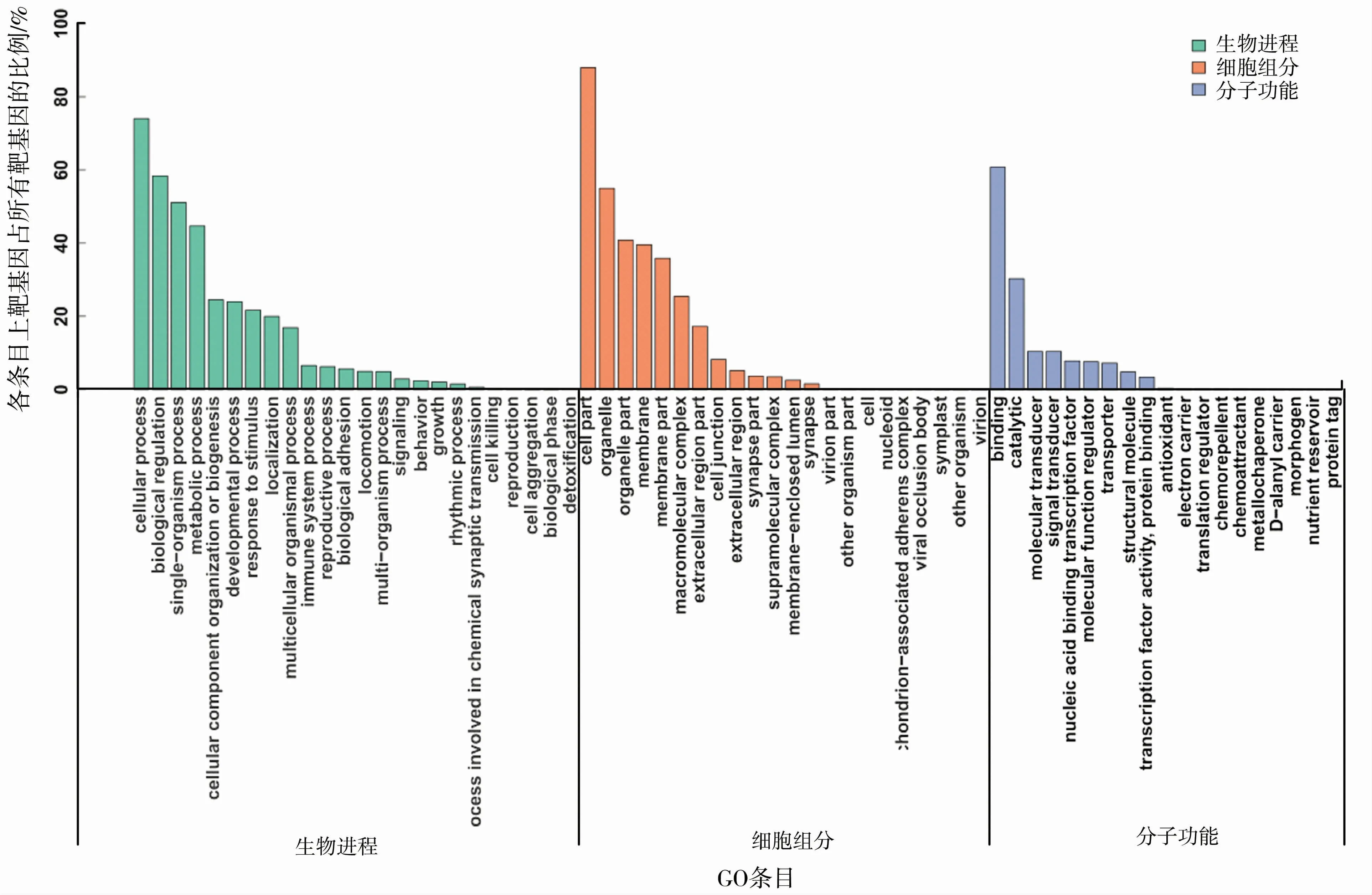
图5 差异新miRNA靶基因的GO功能富集分析Fig.5 GO functional enrichment analysis of differentially expressed novel miRNA target genes
KEGG通路分析发现,差异显著的已知miRNA和新miRNA共富集在346个信号通路上,其中差异显著的已知miRNA的靶基因显著富集在雌激素信号通路(estrogen signaling pathway)、催乳素信号通路(prolactin signaling pathway)、催产素信号通路(oxytocin signaling)、Hedgehog信号通路(hedgehog signaling pathway)、脂肪酸生物合成(fatty acid biosynthesis)、脂肪细胞因子信号通路(adipocytokine signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)和胰岛素信号通路(insulin signaling pathway)等通路中,这些通路在乳腺发育和泌乳过程中发挥着重要的调控作用,见图6;差异显著的新miRNA的靶基因显著富集在蛋白质消化和吸收(protein digestion and absorption)、MAPK信号通路(MAPK signaling pathway)、黏着斑(focal adhesion)、ECM-受体互作(ECM-receptor interaction)等通路中,这些通路在细胞重编程和乳腺发育中发挥着重要的调控作用,见图7。
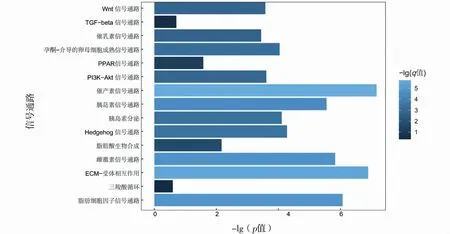
图6 差异已知miRNA靶基因的KEGG通路富集分析Fig.6 KEGG pathway enrichment analysis of differentially expressed known miRNA target genes
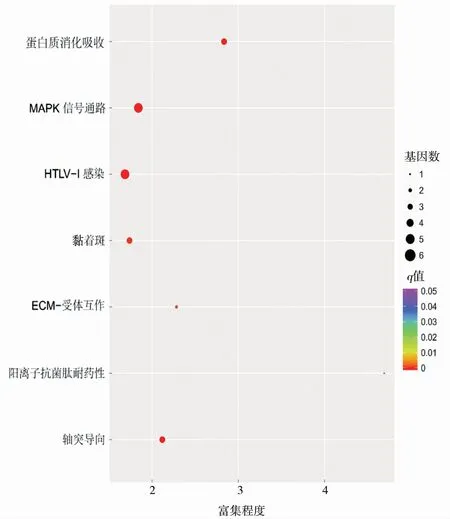
图7 差异新miRNA靶基因的KEGG通路富集分析Fig.7 KEGG pathway enrichment analysis of differentially expressed novel miRNA target genes
3 讨论
miRNA是乳腺发育过程及重编程过程的重要调节因子,在小鼠、人、奶牛等哺乳动物的乳腺组织中,其表达水平会随着乳腺的发育而不断变化。本研究中差异miRNA的分析结果表明,重编程后细胞的miRNA表达模式发生了明显的变化,且在差异程度排名前15位中有部分miRNA与乳腺发育和泌乳密切相关,例如chi-miR-200a、chi-miR-200c、chi-miR-141、chi-miR-183、chi-miR-184。miR-200a、miR-200c、miR-141是miR-200家族的成员,其中miR-200a对乳腺的分化具有关键的调节作用。K.Nagaoka等发现,在妊娠期及哺乳期小鼠乳腺组织中,miR-200a表达量明显增加;此外,上调miR-200a会促进上皮细胞标志性基因CDH1和酪蛋白标志性基因CSN2的表达,抑制成纤维细胞标志性基因Viminten的表达。miR-200c和miR-141是泌乳过程的重要调控因子,S.Le Guillou等对奶牛泌乳期乳腺组织的miRNA表达情况进行了分析,发现miR-200c和miR-141是乳腺上皮组织中表达量最高的miRNA之一。此外,Li Z.等的研究结果表明,与非泌乳期奶牛乳腺组织相比,泌乳期奶牛乳腺组织中miR-200c和miR-141表达量显著增加。miR-183与乳脂代谢过程密切相关,它可以通过靶向MST1基因调控山羊乳腺细胞的乳脂代谢,也可以通过靶向IRS1基因调控奶牛乳腺上皮细胞的乳脂代谢。而miR-184是一种在奶牛乳腺上皮细胞中高度富集的miRNA,在人和小鼠中,miR-184具有促进乳腺上皮细胞命运进程,抑制乳腺肿瘤形成的作用。重编程前后差异的miRNA的功能集中在乳腺发育分化和泌乳方面,这表明了在重编程前后细胞功能发生了改变。
上皮-间充质转化(EMT)是指上皮细胞经过特定程序转化为间质表型的细胞的生物学过程。EMT过程是可逆的,称为间充质-上皮转化(MET)。EMT与MET过程均与胚胎发育、组织重塑、癌症发生密切相关。在本课题组的研究结果中,成纤维细胞向乳腺上皮细胞命运的转换需要涉及到EMT途径的抑制。重编程前后差异miRNA的分析结果表明,在差异倍数排名前15位的差异miRNA中,有部分miRNA对EMT过程具有调控作用,它们分别是miR-34c-5p、miR-34c-3p、miR-708-3p、miR-200b。miR-34c-5p、miR-34c-3p是miR-34家族的成员,miR-34c-5p可以通过作用于Notch信号通路抑制EMT的发生,而miR-34c-3p可以通过MAP3K2信号通路调控EMT的发生。miR-200b是miR-200家族的成员,它是抑制EMT途径的关键因子。在具有EMT特征的胰腺癌细胞中,miR-200b的表达水平会呈现出显著下调的趋势。此外,如果在乳腺癌细胞中上调miR-200b表达水平,可以抑制乳腺癌细胞的EMT。miR-708-3p可以通过靶向EMT激活因子来抑制EMT的进程,例如J.W.Lee等通过在细胞中过表达miR-708-3p发现,miR-708-3p可以通过直接靶向ZEB1、CDH2及vimentin等EMT激活因子,进而抑制乳腺癌细胞的EMT。在重编程前后部分差异表达的miRNA的功能集中在重编程方面,这表明在重编程后细胞状态可能发生了改变。
雌激素信号通路、PI3K-Akt信号通路、催乳素信号通路对乳腺发育分化及泌乳具有关键的调控作用。雌激素是诱导青春期乳腺发育的关键调控因子。雌激素通过与雌激素受体α结合,促进双调蛋白与表皮生长因子受体的结合,激活FGF的表达,并进一步推动乳腺侧支和末端芽的发育,最终获得功能性乳腺。此外有研究表明,给切除了卵巢的小鼠注射雌二醇可以恢复其乳腺上皮细胞的DNA合成能力,如果在青春期小鼠乳腺中进行抗雌激素处理,则会抑制乳腺导管末端芽中上皮细胞的合成。PI3K-Akt信号通路在细胞的生长、代谢、增殖、凋亡及血管生成等重要的生物过程中发挥着重要作用。在乳腺发育方面,月桂酸和油酸能激活G蛋白偶联受体84(GRP84),进而通过PI3K-Akt信号通路促进乳腺的发育,而硬脂酸则会通过作用于G蛋白偶联受体120(GPR120)抑制PI3K-Akt信号通路进而阻碍乳腺的发育。在泌乳方面,PI3KAKt信号通路可以调控泌乳过程中乳糖及乳脂的合成,并同时诱导催乳素的合成,促进机体进入哺乳期。以上研究结果说明,PI3K-Akt信号通路在乳腺上皮细胞的增殖和生长、乳腺导管的形成及泌乳方面发挥着重要的调控作用。催乳素是一类由脑垂体或乳腺上皮细胞分泌的激素,它通过与细胞膜表面的催乳素受体结合,在哺乳期乳腺发育、乳脂合成及分泌过程中发挥着重要的作用。在泌乳方面,Zhang Z.等的研究表明,麦芽提取物可以通过作用于催乳素信号通路和JAK-STAT信号通路,进而促进大鼠乳腺组织泌乳。在乳腺的发育方面,N.D.Horseman等和C.J.Ormandy等通过构建转基因小鼠发现,敲除PRL基因或PRLR基因后,小鼠在青春期乳腺导管分支会减少,并且腺泡芽不发育。上述研究表明,催乳素信号通路对乳腺发育及泌乳过程具有重要的调控作用。综合差异miRNA的靶基因GO功能富集结果和KEGG通路富集结果发现,有部分差异miRNA的靶基因参与的生物过程和分子功能与在乳腺发育过程中所涉及到的发育、代谢、信号转导及催化活性相关,且部分基因所富集的通路对乳腺发育分化及泌乳过程具有重要的调控作用。这说明重编程后细胞的基因功能及基因的表达模式发生了显著的变化,印证了重编程后细胞命运的改变。
4 结论
山羊耳缘成纤维细胞重编程前后差异miRNA靶基因的功能、参与调控的信号通路与乳腺发育分化及泌乳密切相关。且经小分子化合物诱导后山羊耳缘成纤维细胞的性质、功能及命运发生了改变。
