新型心肌黄酶检测荧光探针的合成及生物成像
2022-07-04房街芹贾明轩朱立平
周 莹,房街芹,贾明轩,朱立平
(云南大学化学科学与工程学院,云南 昆明 650091)
我国是恶性肿瘤的高发国家,对癌症的监测与治疗一直是医学相关研究领域的重点方向。分子氧是好氧生物中一种重要代谢产物,对于维持细胞的生命活动具有十分重要的意义[1]。当组织氧供应受限制时,会发生低氧现象,导致依赖氧气的生理过程发生显著变化。由于癌细胞以极快的速度不停生长,其内部需氧量远远超出血液的供应量,极易导致组织内部出现低氧[2]。在固体肿瘤内,低氧导致部分酶出现过表达现象,其中硝基还原酶、偶氮还原酶及心肌黄酶的浓度变化最为明显[3]。
心肌黄酶(DT-diaphorase),简称DTD,是一种细胞质黄素蛋白酶[4]。由于心肌黄酶在癌细胞中的表达量是在正常细胞中的2~50倍,因此心肌黄酶可用作癌症的生物标志物及荧光探针目标的检测物[5]。鉴于心肌黄酶检测的重要性,开发心肌黄酶含量检测方法及心肌黄酶高表达区域定位技术十分重要,也受到了国内外科学家的广泛关注。
有机小分子荧光探针,由于其具有多样性的结构、可调控的光谱性质及对识别物具有高选择性、高灵敏度响应等特点,已逐渐成为广泛应用于生物小分子检测的主要研究手段和工具[6,7]。但目前已有的心肌黄酶探针中普遍存在发射波长较短、响应时间长、选择性低等问题,这严重影响了心肌黄酶荧光探针的准确性和灵敏性[8]。结合专一性识别模式,引入发射波长较长的荧光团母体,利用新型光学成像技术,开发快速、准确的心肌黄酶检测探针,用于细胞内低氧水平的检测、辅助恶性肿瘤的早期诊断,是我们近期的工作重点,具有十分重要的理论及临床意义[3,9,10]。
本研究选择尼罗红类衍生物作为荧光基团,通过酯键或酰胺键的连接方式与识别基团三甲基苯醌相连[11],设计了“off-on”型响应探针Milla 1。其探针具有良好的光稳定性和光响应性,当与心肌黄酶反应后,可观察到635 nm处发射峰荧光强度增加约4.4倍。探针Milla 1对心肌黄酶的检测表现出检测限低、反应时间短、选择性强等特点。因此,探针Milla 1被成功应用于HeLa细胞和秀丽隐杆线虫内源性和外源性的心肌黄酶检测中,证明了Milla 1是一个良好的心肌黄酶检测探针。
1 实验部分
1.1 实验试剂与仪器
实验中所提及的和所使用的所有药品试剂均为市售分析纯,购买后不需要任何处理可直接用于实验[12]。心肌黄酶(DTD)采购于上海源叶科技有限公司,S1007-2 KU(20 mg)。使用梅特勒托利AB204-N分析天平进行称量,使用布鲁克DRX 500核磁共振仪通过1H-NMR和13C-NMR确定合成的探针,使用Agilent100LC/MSD TOF高分辨质谱仪进行质谱分析验证,使用岛津UV-240IPC紫外可见分光光度计进行紫外光谱测试,使用F97XP荧光可见分光光度计进行荧光光谱测试,使用Olympus FV-10i激光共聚焦显微镜进行细胞成像实验,最后的秀丽隐杆线虫荧光成像是通过Olympus BX51荧光正置显微镜进行测试的。
1.2 探针Milla 1的合成
化合物MA的合成步骤:冰浴条件下将化合物1(4.35 g,26.4 mmol)溶于15 mL浓盐酸和5 mL水的混合物中,取亚硝酸钠(2.18 g,31.6 mmol)溶于15 mL水并分批滴加到反应体系中,室温反应2 h。得棕色固体MA,产物不稳定,不需纯化直接进行下一步反应。
化合物XD3的合成步骤:氮气保护下,将MA和1,6-二羟基萘(2 g,12.5 mmol)溶于30 mL N,N-二甲基甲酰胺(DMF)中,140 ℃回流4 h,冷却至室温。层析柱法纯化(二氯甲烷(DCM):乙酸乙酯=10:1)得深绿色固体XD3,产率50%。
化合物MG,MH的合成步骤详见参考文献[2,12-16]。
探针Milla 1的合成步骤:取化合物XD3(170 mg,0.5 mmol)和化合物MH(125 mg,0.5 mmol)溶于30 mL无水DCM中,加入催化剂4-二甲氨基吡啶(DMAP)(30 mg,0.25 mmol),室温反应1 h后,向反应体系加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)(145 mg,0.75 mmol),室温过夜反应。层析柱法纯化(石油醚:DCM=1:3),得深紫色固体Milla 1,产率75%。1H-NMR(400 MHz,氘代氯仿(CDCl3)):δ8.30~8.27(d,J=8.8 Hz,1 H),8.20(d,J=2.0 Hz,1 H),7.59~7.57(d,J=9.2 Hz,1 H),7.25~7.23(t,J=4.4 Hz,1 H),6.68~6.65(m,6 H),6.45(d,J=2.0 Hz,1 H),6.34(s,1 H),3.49~3.43(m,4 H),2.20~2.18(d,J=8.3 Hz,3 H),1.97(s,3 H),1.92(s,3 H),1.65(s,2 H),1.56(s,2 H),1.27~1.24(t,J=7.0 Hz,6 H)。13C-NMR(100 MHz,CDCl3):δ 12.31,12.75,14.56,29.14,38.57,45.28,47.97,96.41,105.64,110.04,116.39,123.55,125.06,127.77,129.65,131.38,133.83,138.88,139.15,139.44,143.03,147.07,151.15,152.00,152.47,153.03,171.21,182.90,187.53,191.11。HEMS(ESI):C34H34N2O6,通过计算得[M+H]+=567.249,实测值:m/z=567.249。
合成路线如图1所示。
图1 探针Milla 1合成路线
1.3 光谱测试
1.4 细胞、线虫成像实验
内源性心肌黄酶实验方法:在细胞中加入抗氧化剂谷胱甘肽乙基酯,浓度分别为0,0.4,0.8和1.2 mg·mL-1。在37 ℃恒温的二氧化碳真空干燥箱中孵育2 h,用PBS缓冲液清洗干净后,加入探针Milla 1母液10 μmol,于原条件下孵育2 h后,继续用PBS缓冲液清洗干净,再分别加入20 μL的DAPI(4’,6-二脒基-苯基吲哚)试剂恒温孵育30 min。待测细胞继续用PBS缓冲液清洗干净,在共聚焦显微镜上进行细胞成像。
外源性心肌黄酶实验方法:在细胞培养皿中分别加入心肌黄酶活力单位为0,15,30和65 μ·mL-1于37 ℃恒温的二氧化碳真空干燥箱中孵育2 h后,用PBS缓冲液清洗干净,再分别加入探针Milla 1母液和NADH溶液,使细胞中探针浓度保持在20 μmol,NADH浓度保持在0.5 mmol,继续于原条件下孵育2 h后,用PBS缓冲液冲洗干净,再次分别加入20 μL的DAPI试剂,继续恒温孵育30 min。待测细胞用PBS缓冲液清洗干净,在共聚焦显微镜上进行细胞成像。
在培养线虫的试管中分别加入活力单位为0,30和65 μ·mL-1的心肌黄酶,在37 ℃恒温的二氧化碳真空干燥箱中孵育2 h后,用PBS缓冲液清洗干净后,加入探针Milla 1母液(20 μmol)和NADH(0.5 mmol),之后继续在37 ℃恒温的二氧化碳真空干燥箱中孵育2 h。待测试线虫用PBS缓冲液清洗后,在荧光正置显微镜上进行生物成像。
2 结果与讨论
2.1 探针Milla 1对心肌黄酶的紫外光谱测试
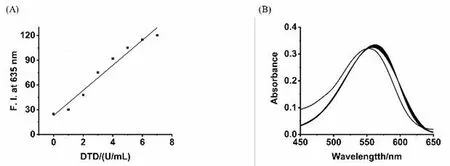
探针Milla 1对心肌黄酶的紫外滴定使用岛津UV-240IPC紫外可见分光光度计进行测定。我们利用DMSO/PBS(1/1,V/V,pH=7.4)作为测试体系,在外源性加入NADH(0.5 mmol)的条件下研究了Milla 1和心肌黄酶的紫外可见光谱的变化,其紫外可见吸收光谱如图2(A)所示。探针Milla 1在560 nm处有一个吸收峰,随着心肌黄酶的不断加入,当酶的活力达到65 μ·mL-1时,吸收光谱蓝移至550 nm处,强度无明显变化,测试体系达到饱和。
2.2 探针Milla 1对心肌黄酶的荧光光谱测试
随后,我们对Milla 1和心肌黄酶的反应进行了荧光光谱研究(DMSO/PBS=1/1,V/V,pH=7.4,激发波长:585 nm,狭缝宽度:5 nm×5 nm,电压:700 V)。如图2(B)所示,随着不同酶活力单位的心肌黄酶的加入,在最大发射波长635 nm处的荧光值不断增加,当心肌黄酶的酶活力达到65 μ·mL-1时,荧光强度增加了约4.4倍后,不再发生变化。以上光谱实验结果证明,Milla 1可用于心肌黄酶含量变化的荧光光学检测。

λ/nm
2.3 探针Milla 1对心肌黄酶的检出限测试
接下来,我们进行了Milla 1和心肌黄酶(DMSO/PBS=1/1,V/V,pH=7.4)的反应检出限测试。如图3(A)所示,在心肌黄酶浓度范围为0~8 μ·mL-1时,荧光发射强度具有良好的线性关系(R2=0.9699)。基于国际纯粹与应用化学联合会(IUPAC)规定的检出限(LOD)公式LOD=3σ/k[17-18],(σ表示空白试验的标准偏差,k表示荧光强度与心肌黄酶浓度之间校准曲线的斜率)。计算可得到,该反应检测限为0.4 μ·mL-1。以上检测限数值表明,Milla 1对心肌黄酶的检测具有较高的灵敏度。
2.4 探针Milla 1的荧光选择和紫外选择性光谱测试
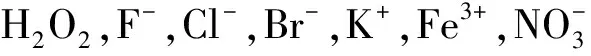
DTD/μ·mL-1
2.5 探针Milla 1对心肌黄酶的响应时间测试
我们分别对探针Milla 1和不同浓度心肌黄酶(0,65 μ·mL-1)在60 min反应内,635 nm处的荧光值进行了测试。如图3(D)所示,探针Milla 1在没有DTD时,635 nm处的荧光强度没有变化;在65 μ·mL-1心肌黄酶的作用下,可以发生断键反应,释放出荧光团,引起635 nm处的荧光值增强。反应进行20 min后,635 nm处的荧光强度趋近于平稳不再改变。因此,我们可以推测探针Milla 1与心肌黄酶的反应时间约为20 min。
2.5 探针Milla 1对心肌黄酶的反应机理
在NADH的存在下,探针Milla 1与心肌黄酶发生还原反应及质子化,使反应基团苯醌变为对苯二酚(或半醌),利用断键反应释放出荧光团XD3,实现对心肌黄酶的光学检测。如图4(A)为探针Milla 1与心肌黄酶反应的机理图。如图4(B)所示,探针分子离子峰为[M+H]+:567.249,加入心肌黄酶反应后,该探针分子离子峰消失,同时检测到断键反应后的荧光团分子离子峰[M+H]+:335.1389(图4(C))。以上质谱数据证明了我们提出的反应机理是正确。
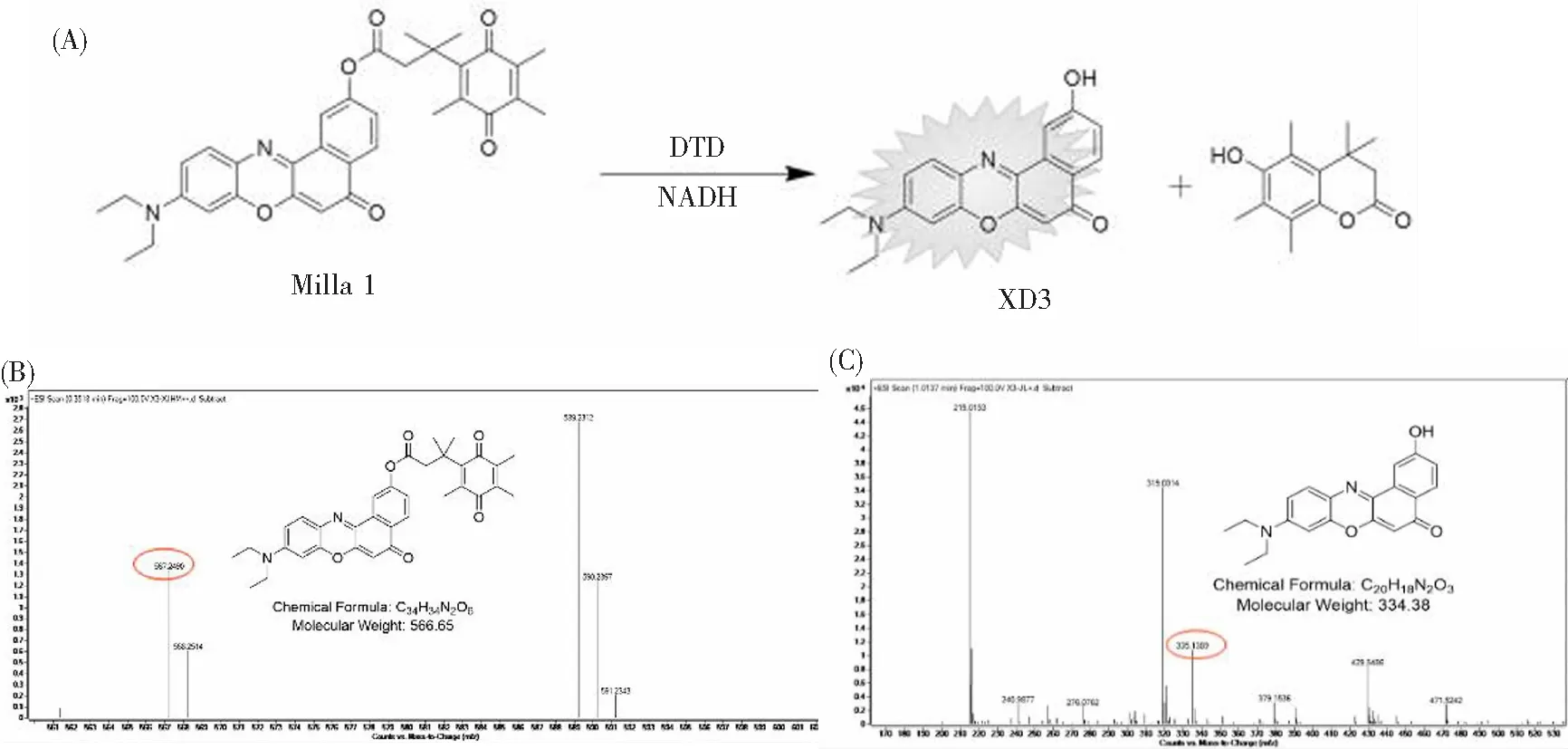
图4 (A)探针Milla 1与心肌黄酶(DTD)反应的机理图。(B)探针Milla 1与心肌黄酶(DTD)反应前的高分辨质谱图。(C)探针Milla 1与心肌黄酶(DTD)反应后的高分辨质谱图。
2.7 探针Milla 1对心肌黄酶的细胞毒性测试
为研究探针在生物体内的毒性情况,我们对探针进行了不同癌细胞和人正常细胞内的毒性测试。如图5所示,在探针浓度为40 μmol时,探针Milla 1对肺癌A549、肝癌SMMC-7721、宫颈癌Hela、乳腺癌MCF-7和结肠癌SW480的体外肿瘤和人正常肺上皮细胞BEAS-2B的体外生长均未达到半数抑制活性。以上实验证明,探针Milla 1对癌细胞和人正常细胞的毒性均较小。
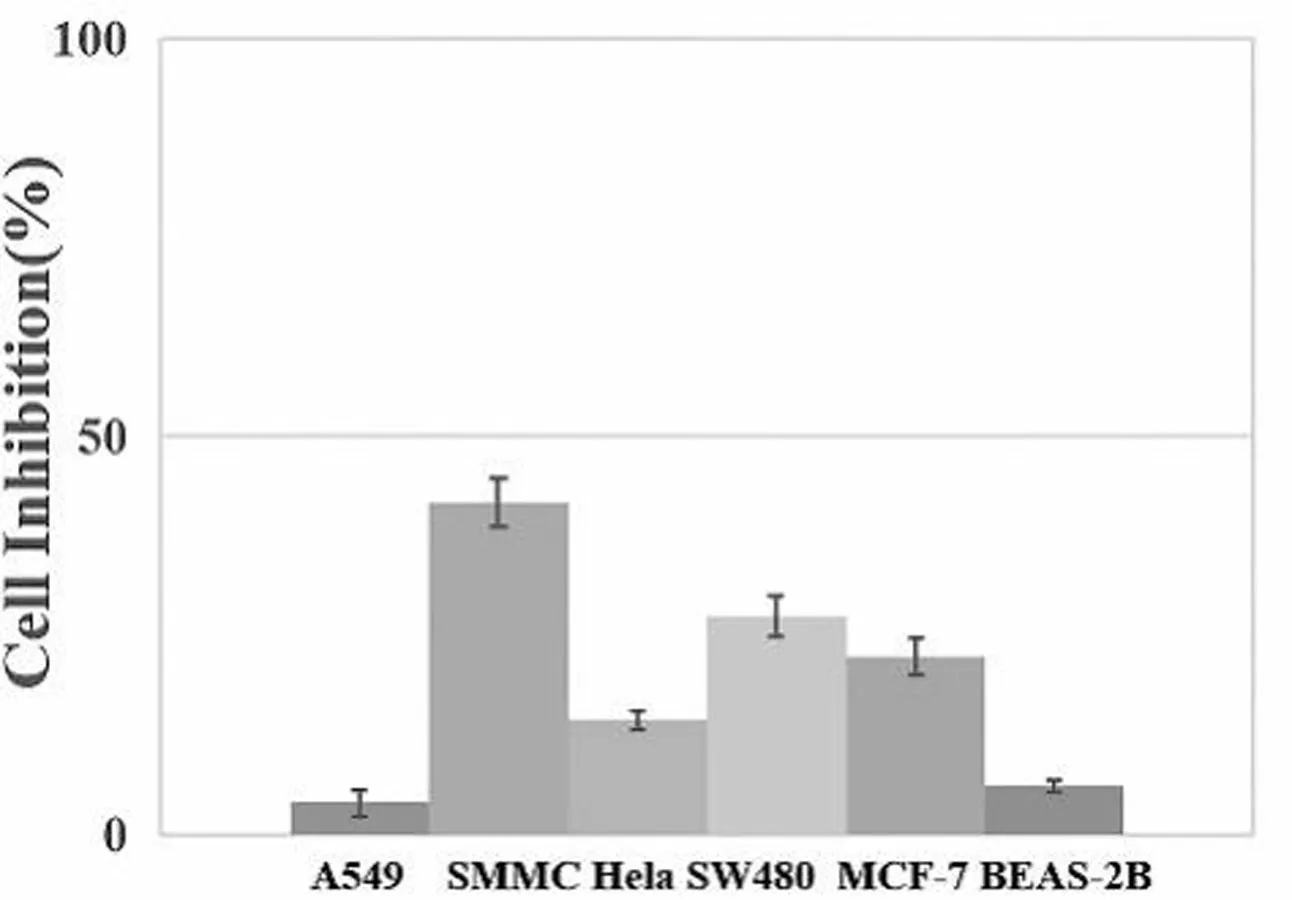
图5 探针Milla 1对癌细胞A549、SMMC-7721、Hela、SW480、MCF-7和人正常细胞BEAS-2B的毒性测试图
2.8 探针Milla 1对心肌黄酶的细胞成像测试
我们利用宫颈癌Hela细胞,进行了光学成像实验,探索了探针Milla 1对内源性和外源性的心肌黄酶的光学响应及检测能力。由于抗氧化剂谷胱甘肽乙基酯孵育的Hela细胞会呈现低氧状态,其自身会产生一定量的心肌黄酶。如图6(A)所示,在内源性心肌黄酶成像实验中,随着加入的抗氧化剂(谷胱甘肽乙基酯)的量增加,细胞内低氧程度逐渐加强,细胞内也呈现明显的荧光增强梯度性变化现象。由此可知,探针Milla 1可以通过荧光成像的方法检测细胞内源性心肌黄酶含量变化并反映出相关区域的低氧程度。如图6(B)所示,在细胞外源性心肌黄酶成像中,加入不同酶活力的心肌黄酶后,探针也可以在细胞内呈现明显梯度性荧光增强现象。因此我们认为,通过探针Milla 1荧光强度的变化可以检测出细胞内源性和外源性的心肌黄酶含量波动,进而反映出相关区域低氧程度。(图6(C)、(D))
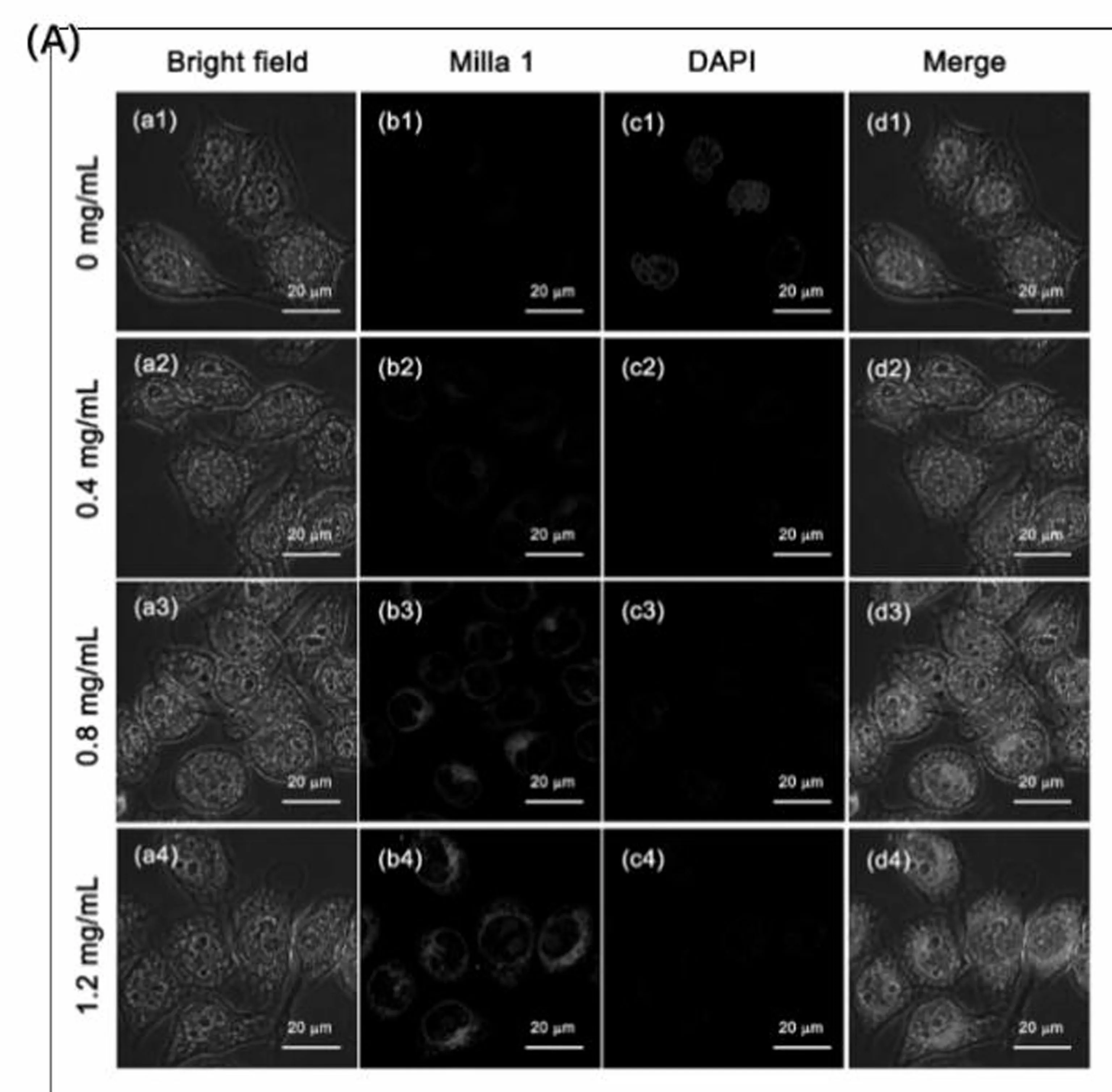
图6 (A)探针Milla 1(20 μmol)在Hela细胞中的内源性心肌黄酶的荧光成像,(B)探针Milla 1(20 μmol)在Hela细胞中的外源性心肌黄酶的荧光成像。(a)为明场(白光)通道;(b)为探针Milla 1(红光)通道;(c)为DAPI核染色(蓝光)通道;(d)为前三个通道的叠加图。(C)探针Milla 1内源性心肌黄酶荧光强度值。(D)探针Milla 1外源性心肌黄酶荧光强度值。
2.9 探针Milla 1对心肌黄酶的秀丽隐杆线虫荧光成像测试
除此之外,我们利用探针Milla 1,以秀丽隐杆线虫为生物模型,再次测试其在生物体中对心肌黄酶检测及成像的可能性。如图7(A)所示,在秀丽隐杆线虫进行外源性心肌黄酶和探针Milla 1孵育后,随心肌黄酶浓度的增加,线虫体内呈现梯度性的红色荧光增强现象。(图7(B))由此可见,探针Milla 1可成功用于秀丽隐杆线虫外源性心肌黄酶检测和光学成像实验中。
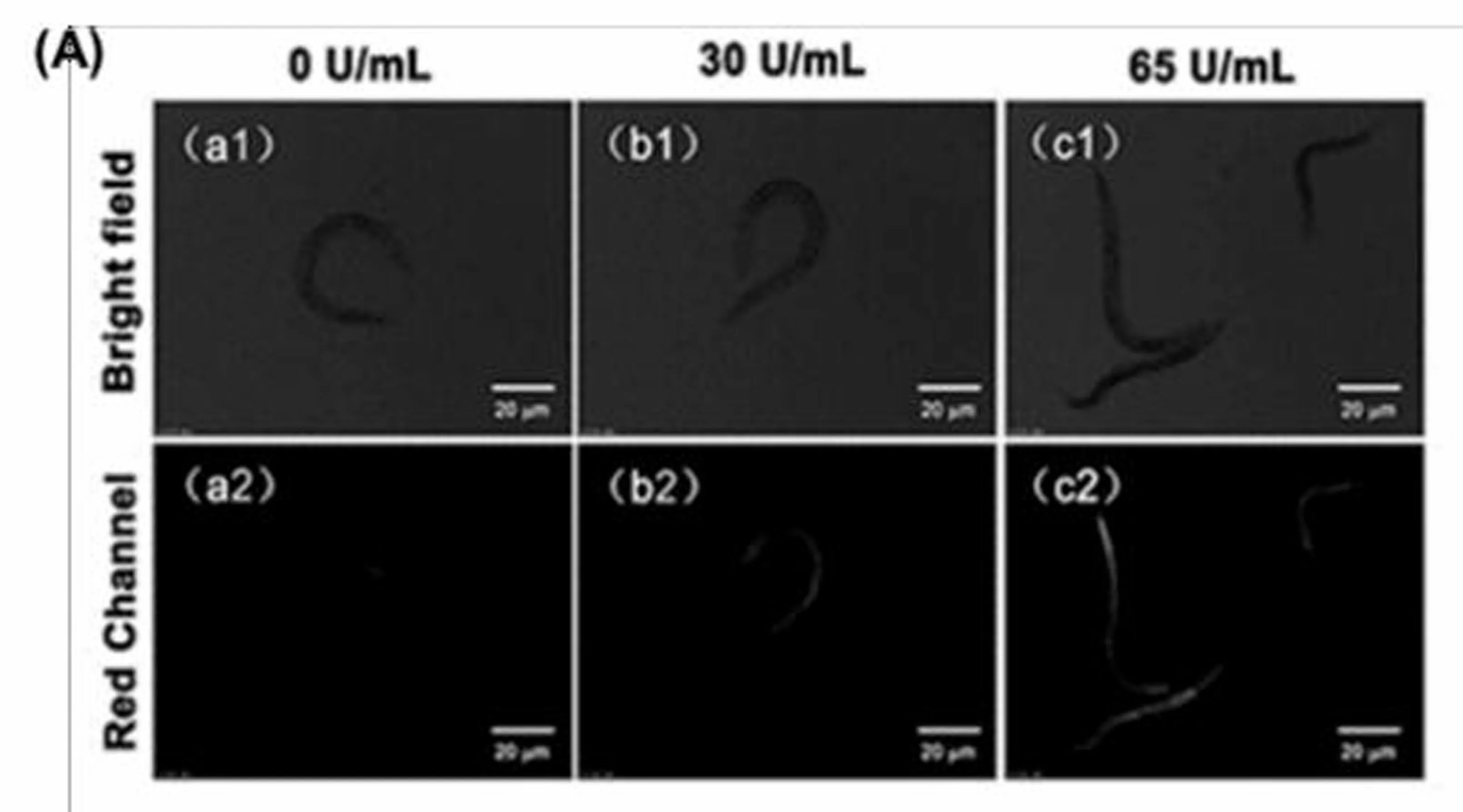
图7 (A)探针Milla 1(20 μmol)在NADH(0.5 mmol)存在下,通过心肌黄酶孵育的线虫的活体荧光成像图。(a1)、(b1)和(c1)为明场(白光)通道,(a2)、(b2)和(c2)为探针Milla 1(红光)通道。(B)探针Milla 1在不同浓度下的平均荧光强度值
3 结论
综上所述,我们设计合成了基于二甲基苯醌识别机理的新型荧光探针Milla 1,并将其应用于心肌黄酶的体内及体外检测中。探针Milla 1表现出对心肌黄酶的快速专一性识别,Milla 1对心肌黄酶的检测具有检测限低和选择性高等优点。HeLa细胞和线虫成像实验表明,Milla 1可以检测到内源性和外源性心肌黄酶含量的变化,进而对相关生物体内低氧程度进行光学监测,具有良好的应用前景。我们希望本文的有机合成和测试能够为以后的心肌黄酶检测用荧光探针设计和合成提供帮助。
