姜黄素对HepG2裸鼠移植瘤的抑制作用及对瘤体组织中NLRP3、IL-1β表达的影响
2022-07-04左清平黄娟娟张顺芝何鸽飞长沙市第一医院药剂科长沙410005
左清平,黄娟娟,张顺芝,何鸽飞(长沙市第一医院药剂科,长沙 410005)
肝细胞癌(hepatocellular carcinoma,HCC)在消化系统恶性肿瘤中不仅恶性程度高,且极易转移、复发,患者5年内的生存率极低[1]。目前治疗HCC的方法一般为手术切除、肝移植、肝动脉介入栓塞化疗、射频消融等,以上治疗方法在临床疗效欠佳,因此寻找新的治疗方法是临床一直以来的研究热点[2]。姜黄素(curcumin)为姜黄的重要活性成分之一,具有抗氧化、抗炎、降血脂、抗动脉粥样硬化、抗肿瘤等多种生物学作用[3]。研究发现姜黄素在抗肿瘤方面疗效显著,对乳腺癌、胃癌、甲状腺癌等多种癌症中的肿瘤细胞的生长均有明显的抑制作用[4]。姜黄素可抑制肿瘤组织血管新生,动物实验发现姜黄素及其衍生物双去甲氧基姜黄素能抑制肺癌和胰腺癌的生长和转移,减少肿瘤组织微血管数目[5]。此外,姜黄素具有明显的抗炎作用,可下调白细胞介素(IL)-1β、IL-6等炎症细胞因子的表达,抑制机体的炎症反应,抑制肿瘤的进展[6]。NLR家族是启动的炎症体形成的主要感受器蛋白,且拥有众多的活化信号,其中神经中枢内Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)的活性信号最为广泛多样,其可以在众多病原体或非病原体来源刺激物刺激下活化,参与炎症相关疾病的发展[7]。NLRP3表达上调能够通过激活下游多种炎症信号通路促进、加剧炎性细胞对肝脏组织的浸润[8]。有研究显示,IL-1β的上升能够通过加剧体内急性炎性反应,对机体的免疫损伤过程产生不同程度的影响[9]。已有多篇文献报道,IL-1β可能在肝癌进展过程中具有重要的促进作用,由于IL-1β同时也是炎症体活化的重要产物,因此推测炎性小体功能失调可能在肝癌的进展中具有重要作用[10]。本研究旨在探究姜黄素对人肝癌裸鼠原位种植瘤生长及NLRP3和IL-1β表达的影响。
1 材料与方法
1.1 细胞株与培养
HepG2肝癌细胞株(上海中科院细胞库,批号:ZYK20201015)。将HepG2细胞常规置于含10%胎牛血清、青霉素、链霉素的RPMI 1640培养液中,37℃、5%CO2培养箱中培养,胰蛋白酶对细胞进行消化传代,每3日换液传代1次。
1.2 实验动物
选用湖南斯莱克景达实验动物有限公司购买的BALB/c-nu型雌性裸鼠53只,SPF级,体质量为15~20 g,5周龄。小鼠均统一饲养在SPF级动物房内,温度恒定23~25℃,相对湿度为40%~60%,自由饮水,食用60℃辐射灭菌饲料。
1.3 试药与仪器
姜黄素(上海阿拉丁试剂有限公司,批号:ST20200211);RPMI 1640培养基、胎牛血清、胰蛋白酶(GIBCO公司);荧光定量PCR试剂盒(Ambion公司);原位细胞凋亡检测试剂盒(Promag公司);兔抗人NLRP3、IL-1β单克隆一抗(美国Epitomics公司)。
1.4 人肝癌HepG2细胞皮下种植瘤模型的建立
取对数生长期的人肝癌HepG2细胞,消化、离心后用PBS溶液洗涤,重悬细胞,调整为5×106个·mL-1的细胞悬液,将其置于EP管中。取3只裸鼠,其颈部皮下作为接种部位,酒精消毒接种部位,用1 mL注射器吸取100 μL HepG2细胞悬液,分别接种于裸鼠颈部皮下,1周左右出现肉眼可见肿瘤;3周肿瘤生长至0.8 cm×1.0 cm×1.2 cm时处死荷瘤裸鼠,无菌条件下剥离瘤体,放入培养液中剔除结缔组织,将肿瘤组织分割成碎块(1 mm×1 mm×1 mm)。麻醉50只裸鼠,对手术部位的皮肤消毒后,沿右肋缘下作1 cm的横切口,暴露肝右叶;用眼科剪在肝实质剪出长、深同约2 mm的切口,将1块HepG2组织碎块植入切口内,缝合将其固定,当活动无出血后,缝合逐层关腹。手术全过程均在超净工作台中完成。
1.5 动物分组和给药
肿瘤移植后的第3日,将50只BALB/c裸鼠随机分为模型对照组,姜黄素低、中、高剂量组,顺铂组,每组10只。模型对照组给予腹腔注射生理盐水干预,每只裸鼠0.2 mL;顺铂组给予腹腔注射2 mg·kg-1顺铂干预治疗;姜黄素低、中、高剂量组分别给予25、50、100 mg·kg-1姜黄素溶液腹腔注射;所有裸鼠均每3日给药1次,共连续给药7次。
1.6 肿瘤抑制率比较
末次给药3 d后颈椎脱臼处死裸鼠,完全剥离瘤体组织,测量肿瘤最长径、最短径,称量肿瘤,计算肿瘤体积抑制率和肿瘤重量抑制率。
1.7 TUNEL检测肝癌细胞凋亡指数
给药结束后2 d,颈椎脱臼处死部分裸鼠,完全剥离原位种植瘤,瘤块以最大面对剖,取其1/2,剖成2~3 mm厚度的薄片,固定于福尔马林溶液中,石蜡包埋组织,并用切片机切成4 μm的薄片,检测切片中肿瘤细胞的凋亡指数;凋亡细胞为棕黄色,蓝紫色为阴性细胞。选每张切片组织的10个高倍视野,随机取2000个肿瘤细胞阳性细胞计数,计数时避开肿瘤坏死区,计算凋亡指数。
1.8 免疫组化检测CD31表达并计算微血管密度(MVD)
CD31用来标记血管内皮细胞,阳性细胞被染成棕黄色。MVD计数方法:只要出现血管内皮细胞或内皮细胞群染成棕色,并且与邻近微血管、肿瘤细胞或其他结缔组织分开的为一条血管。先在×100视野下选取3个血管高密度的区域。再在×200镜计数每个区域的血管数量,作为此肿瘤的微血管密度。
1.9 qRT-PCR检测NLRP3、IL-1β mRNA表达
取肿瘤组织在冰上研磨,将组织制成匀浆后离心,取上清液并测定总RNA,置于-80℃冰箱中保存。采用cDNA逆转录试剂盒对RNA样品进行转录。转录条件:预变性93℃,2 min,1个循环;变性93℃,1 min,退火55℃,1 min,延伸72℃,1 min,40个循环。用2-△△Ct法计算相对表达量,引物序列见表1。
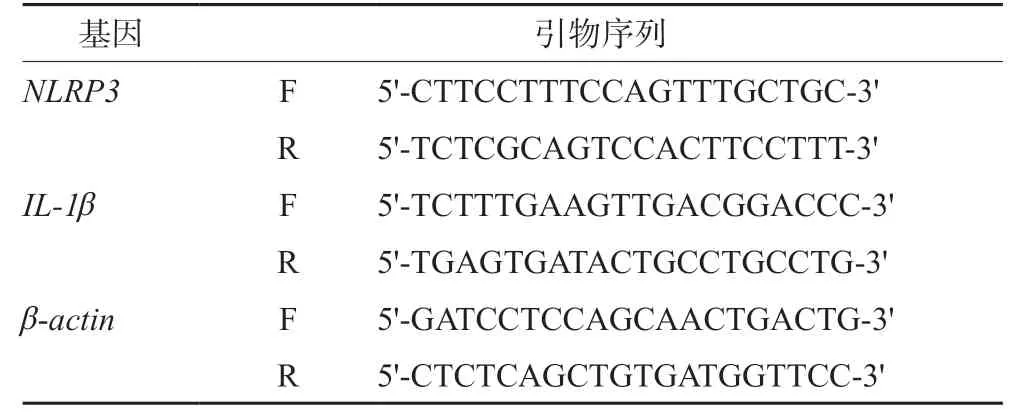
表1 基因引物序列信息 Tab 1 Gene primer sequence information
1.10 Western blot检测NLRP3、IL-1β蛋白表达
分别取各组裸鼠肿瘤组织,研磨后将组织裂解,离心组织后收集上清液,提取总蛋白。取5组裸鼠的蛋白样品转至PVDF膜上,脱脂奶粉封闭蛋白样品1 h,在样品中加入一抗,孵育样品过夜(4℃)。加入二抗后用TBST溶液清洗,凝胶成像并分析。
1.11 统计学分析
采用SPSS 22.0统计学软件对实验数据进行统计学分析,单因素方差比较分析多组间的数据,t检验比较两组间的结果,P<0.05表示差异有统计学意义。
2 结果
2.1 姜黄素对各组裸鼠肿瘤体积和质量的影响
与模型对照组相比,姜黄素低、中、高剂量组裸鼠的肿瘤质量和体积均呈梯度减少(P<0.05);高剂量组裸鼠肿瘤质量和体积较顺铂组相比无明显的差异(P>0.05)。
与模型对照组相比,姜黄素低、中、高剂量组裸鼠的瘤重抑制率和瘤体积抑制率均呈梯度增加,且高剂量组裸鼠的瘤重抑制率和瘤体积抑制率最高;姜黄素高剂量组与顺铂组裸鼠瘤重抑制率和瘤体积抑制率无显著的差异,见表2。
表2 各组裸鼠肿瘤质量和体积比较(±s,n=10) Tab 2 Tumor mass and volume of nude mice in each group (±s,n=10)

表2 各组裸鼠肿瘤质量和体积比较(±s,n=10) Tab 2 Tumor mass and volume of nude mice in each group (±s,n=10)
注:与模型对照组相比,aP<0.05;与姜黄素低剂量组相比,bP<0.05;与姜黄素中剂量组相比,cP<0.05。Note:Compared with the model control group,aP<0.05;compared with the low dose group,bP<0.05;compared with the middle dose group,cP<0.05.
?
2.2 姜黄素对肝癌细胞凋亡的影响
肝癌细胞的细胞核中央呈圆形,均为棕黄色,细胞形态无缺失。模型对照组细胞大部分形态正常,少量细胞核内有着色情况;除模型对照组外,其余4组均有肿瘤细胞凋亡,显微镜下可见凋亡细胞核内呈棕黄色,细胞核呈高度凝聚(见图1)。与模型对照组相比,姜黄素低、中、高剂量组和顺铂组裸鼠肝癌细胞凋亡指数均显著增加(P<0.05);凋亡指数排序为高剂量组>中剂量组>低剂量组(P<0.05),高剂量组裸鼠细胞凋亡指数和顺铂组相比无统计学差异(P>0.05),见表3。

图1 各组肿瘤细胞凋亡情况(×400)Fig 1 Apoptosis of tumor cells in each group(×400)
表3 各组裸鼠肿瘤细胞凋亡指数比较(±s,n=10) Tab 3 Tumor cell apoptosis index in nude mice in each group (±s,n=10)

表3 各组裸鼠肿瘤细胞凋亡指数比较(±s,n=10) Tab 3 Tumor cell apoptosis index in nude mice in each group (±s,n=10)
注:与模型对照组相比,aP<0.05;与姜黄素低剂量组相比,bP<0.05;与姜黄素中剂量组相比,cP<0.05。Note:Compared with the model control group,aP<0.05;compared with the low dose group,bP<0.05;compared with the middle dose group,cP<0.05.
组别 凋亡指数/%模型对照组 1.23±0.54姜黄素低剂量组 5.67±1.02a姜黄素中剂量组 8.92±1.46ab姜黄素高剂量组 15.33±2.17abc顺铂组 16.01±2.21abc
2.3 姜黄素对肝癌微血管密度的影响
姜黄素低、中、高剂量组及顺铂组裸鼠肿瘤的微血管数目较模型组均有不同程度的减少,且呈逐渐递减趋势,高剂量组<中剂量组<低剂量组(P<0.05);高剂量组和顺铂组裸鼠间微血管数量差异无统计学意义(P>0.05),见图2。

图2 各组裸鼠微血管数目比较Fig 2 Number of microvessels in nude mice in each group
2.4 姜黄素对NLRP3、IL-1β mRNA表达的影响
姜黄素低、中、高剂量组及顺铂组裸鼠组织中NLRP3、IL-1βmRNA表达较模型对照组均不同程度的减少(P<0.05);低、中剂量组裸鼠肿瘤组织中NLRP3、IL-1βmRNA表达高于高剂量组和顺铂组(P<0.05);高剂量组和顺铂组裸鼠肿瘤组织中NLRP3、IL-1βmRNA表达无显著差异(P>0.05),见图3。
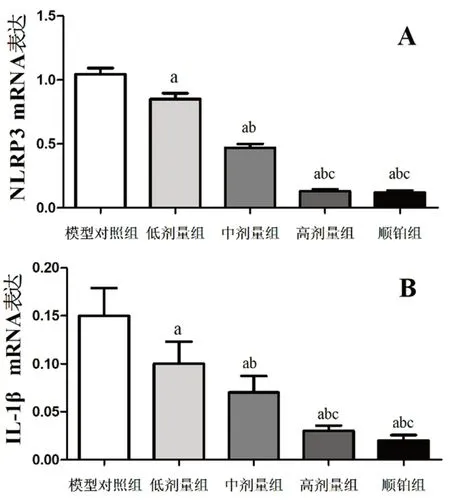
图3 各组裸鼠肿瘤组织中NLRP3(A)、IL-1β(B)mRNA表达情况Fig 3 NLRP3(A)and IL-1β(B)mRNA expression in tumor tissues of nude mice in each group
2.5 姜黄素对NLRP3、IL-1β蛋白表达的影响
与模型对照组相比,中、高剂量组和顺铂组裸鼠肿瘤组织中NLRP3、IL-1β蛋白表达均呈不同程度减少,且呈逐渐递减趋势,高剂量组和顺铂组裸鼠肿瘤组织中NLRP3、IL-1β蛋白表达明显低于低剂量组和中剂量组(P<0.05);且高剂量组和顺铂组裸鼠肿瘤组织中NLRP3、IL-1β蛋白表达无显著差异(P>0.05),见图4。
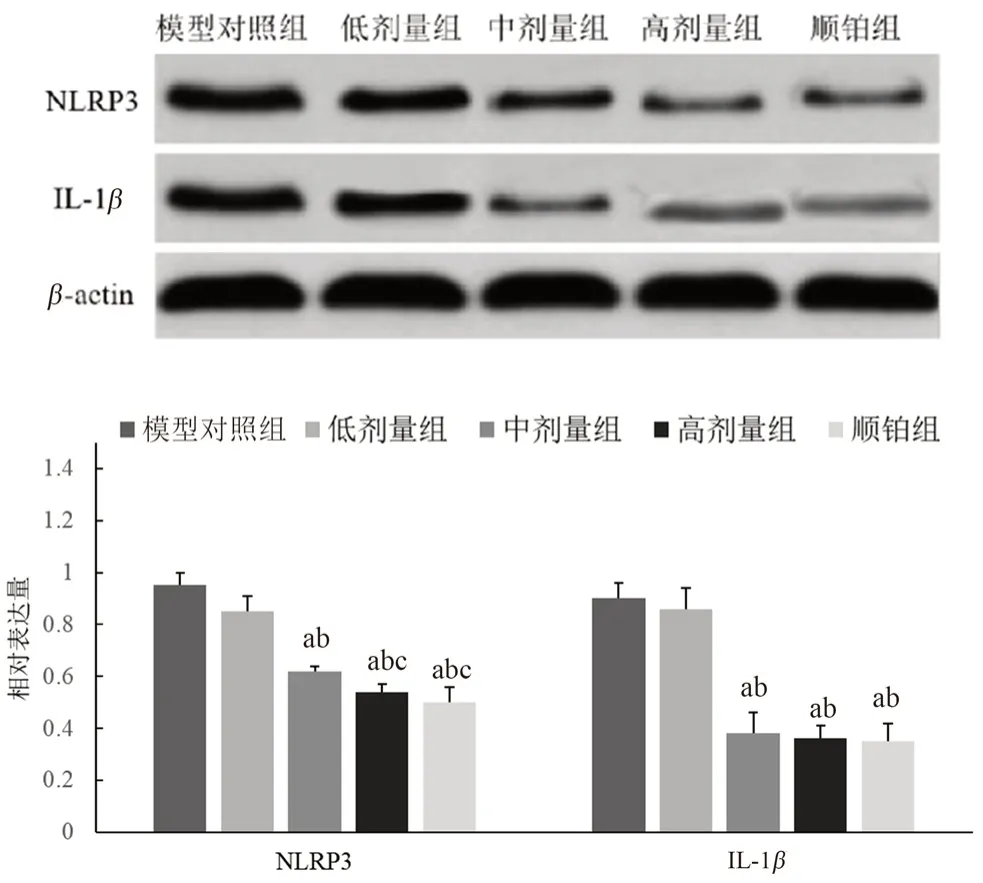
图4 各组裸鼠肿瘤组织中NLRP3、IL-1β蛋白表达情况Fig 4 Expression of NLRP3 and IL-1β proteins in tumor tissues of nude mice in each group
3 讨论
中国是肝癌大国,全球每年一半以上的新发肝癌病例发生在中国。在我国所有消化道恶性肿瘤中,肝癌是死亡率最高的肿瘤之一[11]。肝癌诊断后生存期常小于6个月,生存期5年以上者仅为5%~9%。手术治疗是目前根治肝癌的主要方法,对于中晚期的肝癌患者不能进行手术时,临床上提倡综合治疗[12]。近年来,许多单味中药中的提取物已被证实具有显著的抗肿瘤活性。有学者研究发现,中药可通过多靶点、多环节及多效应抗肿瘤,且疗效显著,不仅对患者的生活质量有明显的改善,还能一定程度地延长患者的生存期[13]。姜黄素来源丰富,广泛存在于姜科植物姜黄、莪术、郁金中,在不同的细胞类型中表现出不同的效应,诱导效应产生的分子机制也不尽相同。目前国内外研究普遍认为姜黄素的抗肿瘤作用机制可能主要与抑制肿瘤细胞的生长和增殖、诱导肿瘤细胞凋亡有关,而且是通过抑制核转录因子的活性,调控癌基因、抑癌基因蛋白和凋亡调控蛋白的表达等途径抑制肿瘤细胞的生长和增殖,诱导肿瘤细胞凋亡[14]。姜黄素对大肠癌、膀胱癌、前列腺癌及乳腺癌等肿瘤的化学防护作用已得到部分证实[15]。
焦亡又称细胞炎性坏死,是一种程序性细胞死亡,表现为细胞不断膨胀增大直至细胞膜破裂,导致细胞内容物经由焦亡孔释放进而激活强烈的炎症反应[16]。焦亡与细胞凋亡有着共同的特征,包括DNA断裂、核浓缩、caspase依赖性和Annexin V染色阳性。然而不同于凋亡,细胞焦亡发生得更快,并会伴随着大量促炎症因子的释放。细胞发生焦亡时,细胞会发生肿胀,在细胞破裂之前,细胞上形成凸出物,之后细胞膜上形成孔隙,使细胞膜失去完整性,释放内容物,引起炎症反应,此时,细胞核位于细胞中央,随着形态学的改变,细胞核固缩,DNA断裂[17]。NLRP3及IL-1β作为焦亡通路的关键蛋白在肝癌细胞的增殖、转移、诊断和预后中发挥重要作用[18]。研究发现,NLRP3、ASC、Caspase-1和IL-1β在肝癌实质细胞中的表达显著低于癌旁组织,且成正相关。肝癌发生时,NLRP3表达明显下调,随着肝癌进展,NLRP3炎症组分的表达水平与肝癌患者的病理分级和临床分期成负相关[19]。另有研究表明,肝癌细胞在缺氧条件下发生上皮间质转化,导致NLRP3、Caspase-1激活,进而促进炎性因子释放导致肝癌细胞的侵袭和转移[20]。此外,炎性细胞因子IL-1β可通过促进ST3Gal IV和FUT I基因的表达,从而促进肝癌的转移[21]。因此,基于焦亡相关基因开发靶向药物或筛选治疗药物可能是肝癌治疗的新策略。
本研究比较了不同浓度的姜黄素对制备的裸鼠肝移植瘤模型中肿瘤的影响,结果显示与模型对照组相比,姜黄素低、中、高剂量组裸鼠的肿瘤质量和体积均明显减小,说明姜黄素对肝癌有抑制作用,姜黄素低、中、高剂量组裸鼠肝癌细胞凋亡指数高于模型对照组,可见姜黄素对肿瘤细胞凋亡有促进作用,且呈浓度依赖性。曹聪等[22]研究证实,不同浓度的姜黄素均可抑制肝癌耐药细胞HepG2/ADM的增殖。在5、10、20、40 μg·mL-1姜黄素作用下HepG2/ADM细胞的增殖抑制率随着药物浓度的增加而增加。
肝内MVD可作为肝癌患者无病生存率预测因子。因此对肝癌的血管生成进行有效的抑制也是治疗肝癌的重要途径,抑制血管生成也成为肝癌药物研发重要的策略之一[23]。本研究结果显示,姜黄素可降低MVD,减少血管生成,抑制肝癌细胞生长,姜黄素浓度越高效果越明显。NLRP3作为炎性小体,其能影响到体内的炎症信号通路的激活,进而激活下游炎症因子,促进肝脏间质细胞纤维化改变[24]。IL-1β能够促进肝脏的炎性损伤,同时还能调控树突状T淋巴细胞的功能,影响到免疫细胞的功能活性[25]。不同浓度姜黄素干预移植瘤裸鼠后肿瘤组织中NLRP3、IL-1β表达均明显被抑制,且随姜黄素浓度增加,蛋白抑制效果越显著,提示姜黄素对肝癌组织中NLRP3、IL-1β表达有明显抑制作用,抑制炎性反应,进而对肝癌进行改善。董德嘉等[26]研究证实,结论检测NLRP3、IL-1βmRNA表达水平有助于了解酒精性肝硬化的病变肝组织炎症活动度、肝损伤程度及纤维化程度,对临床诊断具有一定的指导意义。
综上所述,姜黄素可抑制HepG2裸鼠移植瘤的生长,对肿瘤组织中NLRP3、IL-1β表达有显著抑制作用。
