液相色谱法检测鱼类肝脏中天然维生素A
2022-07-01黄文婷曹文红章超桦秦小明高加龙郑惠娜
黄文婷,曹文红, 2, 3, 4, 5, 6, 7,章超桦, 2, 3, 4, 5, 6, 7,秦小明, 2, 3, 4, 5, 6, 7,高加龙, 2, 3, 4, 5, 6, 7,郑惠娜, 2, 3, 4, 5, 6, 7
(1.广东海洋大学 食品科技学院,广东 湛江 524088; 2.国家贝类加工技术研发分中心,广东 湛江 524088;3.广东省水产品加工与安全重点实验室,广东 湛江 524088; 4.广东省海洋生物制品工程实验室,广东 湛江 524088; 5.广东省海洋食品工程技术研究中心,广东 湛江 524088; 6.水产品深加工广东普通高等学校重点实验室,广东 湛江 524088; 7.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)

VA本身是微量元素且其性质不稳定,易被光、热、氧、酸、碱等破坏[8-9],因此选择一种能准确反映样品真实含量的提取方法,就显得尤为重要。目前VA提取方法主要有皂化法和直接提取法。皂化法又分为室温皂化法及水浴皂化法,其中水浴皂化法适用范围广,但操作烦琐且温度较高,可能会对VA造成一定损失,室温皂化法作用温和,但所需时间长;而直接提取法提取时间较短,操作简便。
VA的检测方法有紫外法、荧光法和液相色谱法,其中紫外法和荧光法灵敏度较低,操作烦琐,而液相色谱法是目前检测VA的主要方法。液相色谱法又分为正相色谱法与反相色谱法,正相色谱法容许样品中存在较多的脂肪,其流动相也可有较大的极性范围跨度[10]。在2010版药典中规定采用正相色谱法测定药品中的顺式及反式VA[11],Rebeca等[12]的研究结果表明正相色谱能很好地分离VA异构体,分离度良好。反相色谱法稳定性更高[13],其常用于VA1含量的分析测定。目前关于VA2的研究较少[14-16],由于VA2性质不稳定,现多数研究方法中仅以VA1含量作为VA总含量,这可能会造成检测结果与实际结果不符,无法真实反映样品VA含量情况。为正确评估鱼类肝脏中VA含量,本研究对正相色谱法和反相色谱法进行了比较,同时以龙趸石斑鱼肝脏为原料,对水浴皂化法、室温皂化法、直接提取法3种样品预处理方法进行了比较,筛选出了最佳的样品预处理、检测方法,并比较了9种经济鱼类肝脏中VA类型及其总含量,以期为天然VA新资源的开发利用提供前期基础数据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
草鱼、乌鳢、金鲳鱼、点篮子鱼、花鲢、珍珠龙胆石斑鱼、罗非鱼、大口黑鲈、龙趸石斑鱼肝脏,购自湛江霞山水产品批发市场,鱼现杀后将肝脏用冰块运回实验室,去除表面脂肪及结缔组织,用预冷的生理盐水清洗后用厨房纸巾吸干表面水分,匀浆后立即冻存于-80℃冰箱。
抗坏血酸、无水硫酸钠、氢氧化钾、石油醚、2,6-二叔丁基对甲酚(BHT),均为分析纯,汕头西陇公司;无水乙醇(分析纯),天津科密欧公司;甲醇(色谱纯)、VA1标准品(纯度≥95%),美国Sigma公司;VA2标准品(纯度≥93%),加拿大TRC公司;异丙醇(色谱纯),上海阿拉丁公司;正己烷(色谱纯),美国Thermo Fisher公司。
1.1.2 仪器与设备
e2695高效液相色谱仪(配2489紫外检测器),美国Waters公司;FA 2004型分析天平,上海舜宇公司;N-1300旋转蒸发仪,上海爱朗公司;SHZ-B恒温水浴振荡器,上海迅博公司;MGS-2200H氮吹仪,上海爱朗公司;超声波清洗机,昆山超声公司;Z-16KL 离心机,美国Sigma公司;D-24UV明澈超纯水一体机,德国默克公司;ZLS-3真空离心浓缩仪,湖南赫西公司。
1.2 试验方法
1.2.1 VA标准溶液的配制
将25 mg VA1标准品和2.5 mg VA2标准品分别用25 mL和5 mL无水乙醇溶解后制成标准储备液,VA1标准储备液临用前参照GB 5009.82—2016附录B进行浓度校正,校正后VA1标准储备液质量浓度为1.29 mg/mL,VA2因没有可参照的方法未对其进行浓度校正。分别吸取0.25 mL VA1标准储备液和0.4 mL VA2的标准储备液于同一10 mL容量瓶中,用甲醇定容,配制成混合标准中间液。分别准确吸取0.1、0.25、0.5、1.0、2.0、3.0 mL混合标准中间液于5 mL棕色容量瓶中,用甲醇定容至刻度,配制成VA1和VA2系列混合标准工作液。
1.2.2 样品的预处理(VA的提取)
因为VA不稳定,操作时使用棕色瓶及锡箔纸包裹的玻璃瓶,尽量避免光线照射。
1.2.2.1 水浴皂化法
参照GB 5009.82—2016,准确称取1.6 g龙趸石斑鱼肝脏于锥形瓶中,加入20 mL水混匀,加入1.0 g抗坏血酸和0.1 g BHT作为抗氧化剂,加入30 mL无水乙醇,再加入一定量的质量分数为50%的氢氧化钾溶液作为皂化液,混匀后盖上瓶塞于80 ℃恒温水浴振荡皂化30 min,皂化后立即用冰水冷却。将皂化物用30 mL水转入250 mL棕色分液漏斗中,加入石油醚振荡萃取5 min,将下层水相移至另一分液漏斗中进行第二次萃取,合并醚相并水洗至中性,然后经3 g无水硫酸钠过滤入1 L旋转蒸发瓶中,在旋转蒸发仪上浓缩至近干,用甲醇分次溶解残留物后定容至10 mL,过0.22 μm滤膜后待测。
1.2.2.2 室温皂化法
参考刘波等[17]的方法,并稍有改动。准确称取1.6 g龙趸石斑鱼肝脏至锥形瓶中,加入20 mL水,加入1.0 g抗坏血酸和0.1 g BHT,加入30 mL无水乙醇,再加入一定量的质量分数为50%的氢氧化钾溶液作为皂化液,混匀后在氮气流下吹扫5 min,用橡皮软塞塞紧瓶口,振荡过夜。用石油醚萃取后水洗至中性,经旋转蒸发仪浓缩后用甲醇定容至10 mL,过0.22 μm滤膜后待测。
1.2.2.3 直接提取法
参照Nimalaratne等[18]的方法,并稍有改动。准确称取1.6 g龙趸石斑鱼肝脏于平底烧瓶中,加入20 mL正己烷,再加入1.0 g抗坏血酸和0.1 g BHT,混匀后超声处理(超声功率为240 W,超声频率为40 kHz)一定时间。然后于5 000 r/min下离心10 min,取上清液在真空离心浓缩仪上25℃旋蒸至干,用甲醇定容至10 mL,过0.22 μm滤膜后待测。
1.2.3 VA的液相色谱检测条件
分别采用反相色谱法和正相色谱法检测VA。反相色谱法条件:Waters BEH C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(体积比 96 ∶4);流速0.8 mL/min;进样量10 μL。正相色谱法条件:Phenomenex Luna Silica色谱柱(250 mm×4.6 mm,5 μm);流动相为正己烷-异丙醇(体积比99.7∶0.3);流速1 mL/min;进样量10 μL。
将VA1和VA2系列混合标准工作液进液相色谱进行检测,以VA1和VA2的质量浓度(x)为横坐标,相应峰面积(y)为纵坐标绘制标准曲线。将样液进液相色谱进行检测,得到峰面积,再根据标准曲线得到VA1和VA2的质量浓度,按下式计算VA含量。
X1=ρ×V×f×100/m
(1)
X2=(ρ×V×f×100/m)×0.4
(2)
X3=X1+X2
(3)
式中:X1、X2、X3分别为VA1、VA2含量和VA总含量,μg/100 g;ρ为根据标准曲线计算得到的试样中VA的质量浓度,μg/mL;V为定容体积,mL;f为换算因子(VA的换算因子为1);m为样品的质量,g;0.4为VA2换算系数,VA2活性为VA1的40%,进行计算时将其折算[19]。
1.2.5 数据处理
VA含量采用“平均值±标准差”(n=3)表示。对不同预处理方法提取的VA含量及不同鱼类肝脏VA含量进行单因素方差分析(One-way ANOVA),若差异显著则采用Duncan法进行多重比较,以p<0.05作为差异显著性的判断标准。
桩59-X30井S3层位油藏埋深3 560.82~3 582.48m,破裂压力梯度为0.018 6MPa/m,该区块的油层破裂压力定为66.42MPa。根据油田注水开发的一般要求,为防止注水时压开地层,井底的最大注水压力不得大于地层破裂压力的90%。由此可得,井底的最大许用注水压力为60MPa。
2 结果与分析
2.1 VA检测方法的确立
VA2在视觉调节上具有与VA1同样重要的作用,VA1与VA2的互相转化是动物对光变化的一种适应性反应。VA1在325 nm处有最大吸收峰,VA2在350 nm处有最大吸收峰,VA2不稳定、变化较快,因此以350 nm作为两者的共同测定波长[14]。为了更准确地测定样品中VA含量,本研究对正相色谱法和反相色谱法进行了比较。
将VA1和VA2混合标准工作液(VA1质量浓度为12.9 μg/mL,VA2质量浓度为8 μg/mL)分别采用正相色谱法和反相色谱法进行检测,所得液相色谱图如图1所示。

图1 混合标准溶液在正相及反相色谱中的液相色谱图
由图1可知:采用正相色谱法,仅检测出一个单峰,无法将VA1、VA2分离开,更换流动相、流动相比例及流速均无法分离;而采用反相色谱法, VA1、VA2分离情况良好。
将19.35 μg/mL的VA1及12 μg/mL的VA2混合标准溶液连续进样6针,以相对标准偏差(RSD)表示检测方法的稳定性,结果反相色谱法平均RSD为 0.38%,小于正相色谱法的4.48%,说明反相色谱法稳定性更高。因此,本研究选用反相色谱法作为检测VA1和VA2的方法。采用反相色谱法,按1.2.4绘制标准曲线,结果见图2。由图2可见,VA1和VA2的线性方程分别为y=29 100x-5 515,y=87 906x-7 591.5,相关系数(R2)分别为0.999 8及0.999 9,二者分别在0.645~19.35 μg/mL与0.4~12 μg/mL范围内线性关系良好。

图2 VA1、VA2的标准曲线
2.2 样品预处理方法的确定
2.2.1 3种样品预处理方法提取条件的确定
2.2.1.1 水浴皂化法
皂化法是通过碱与油脂发生皂化反应,以去除样品中共存的类脂化合物,将VA酯转变为游离VA,并使得被油脂包裹的游离VA脱离出来,以供测定。质量分数为50%的氢氧化钾溶液适合大部分样品的皂化需求[20]。碱用量的增多有利于完全皂化,若加入的碱量不足,皂化反应不完全,会造成测定结果偏低。但若加入的碱量过多,水洗过程中需要大量的水将其洗至中性,造成浪费,且VA是敏感成分,碱用量过多会对VA造成一定的氧化破坏。采用水浴皂化法,在不同的氢氧化钾(质量分数50%)用量下,对龙趸石斑鱼肝脏中的VA进行提取,并采用反相色谱法检测VA总含量,结果见图3。

图3 氢氧化钾用量对水浴皂化法的影响
由图3可知,随着质量分数为50%的氢氧化钾用量的增加,VA总含量呈先上升后下降的趋势,在50%氢氧化钾用量为10 mL时,VA总含量达到最大值,此后随着50%氢氧化钾用量的增多,VA总含量开始下降,这可能是因为加入了过多的碱,加速了游离VA的氧化破坏。因此,在水浴皂化法中选择50%氢氧化钾用量为10 mL。
2.2.1.2 室温皂化法
采用室温皂化法,在不同氢氧化钾(质量分数50%)用量下,对龙趸石斑鱼肝脏中的VA进行提取,并采用反相色谱法检测VA总含量,结果见图4。

图4 氢氧化钾用量对室温皂化法的影响
由图4可知,随着50%氢氧化钾用量的增多,VA总含量呈先平缓上升后下降的趋势,50%氢氧化钾用量为25 mL时,VA总含量达最大值,随后再增加氢氧化钾用量,VA总含量下降。因此,在室温皂化法中选择50%氢氧化钾用量为25 mL。
2.2.1.3 直接提取法
直接提取法是利用超声的空化效应辅助有机溶剂浸提,从而加速细胞内物质的释放[21]。超声时间过短则VA提取效果不好,超声时间过长又会造成能源浪费。采用直接提取法,在不同的超声时间下,对龙趸石斑鱼肝脏中的VA进行提取,并采用反相色谱法检测VA总含量,结果见图5。

图5 超声时间对直接提取法的影响
由图5可知,随着超声时间的延长,VA总含量呈先上升后平稳的变化趋势,超声20 min时,VA总含量最高,但与超声15 min时的VA总含量没有显著差异。因此,选择超声时间为15 min。
2.2.2 不同提取方法的精密度比较
按照2.2.1确定的条件,分别采用3种样品预处理方法对龙趸石斑鱼肝脏中的VA进行提取,并采用反相色谱法检测VA总含量,在一天内连续进样4次,连续测定3 d,以相对标准偏差(RSD)来表示精密度(RSD越大精密度越小),计算不同提取方法的日内RSD及日间RSD,结果见表1。

表1 3种样品预处理方法的RSD比较 %
由表1可知:水浴皂化法与室温皂化法的日内RSD分别为1.07%和1.39%,这两种提取方法的差值较小,而与直接提取法的日内RSD(6.91%)差值较大;室温皂化法的日间RSD最小,为2.77%,而水浴皂化法与直接提取法的日间RSD较大。这可能是因为室温皂化法的反应温度较为温和,而水浴皂化法反应温度较高,VA不稳定且对温度敏感,放置时间越长VA损失越多[22]导致,而直接提取法则在超声过程中易发生乳化现象造成整个体系不稳定,对检测造成一定影响,因而使得其RSD较大,此与姜波等[23]的研究结果一致。3种样品预处理方法的日内RSD均小于10%,日间RSD均小于15%,均符合分析方法的要求[24]。
2.2.3 不同提取方法VA含量的比较
按照2.2.1确定的条件,分别采用3种样品预处理方法对龙趸石斑鱼肝脏中的VA进行提取,并采用反相色谱法检测VA含量,结果如图6所示。
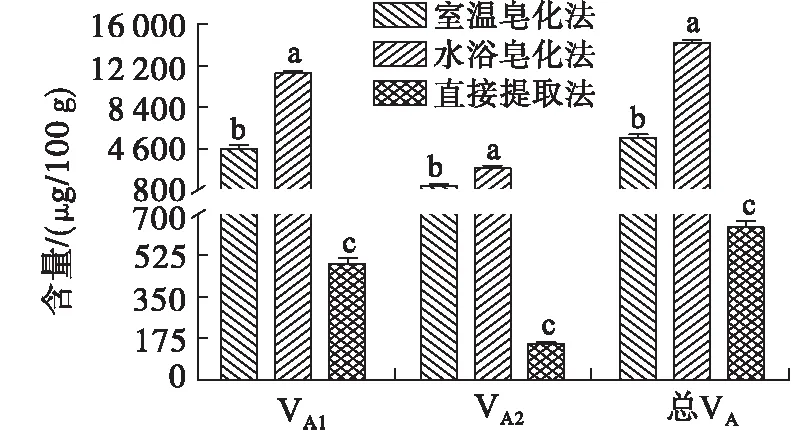
注:不同字母表示同一类别不同方法之间具有显著差异,p<0.05
由图6可知,在3种样品预处理方法中,水浴皂化法VA1、VA2含量及VA总含量均显著高于室温皂化法及直接提取法(p<0.05),而室温皂化法VA1、VA2含量及VA总含量均显著高于直接提取法(p<0.05)。
本研究结果显示直接提取法VA含量最低。不同提取方法所适用试验对象不同,虽然直接提取法对水貂肾脏[12]、奶粉[18]及植物油[23]中VA的提取效果良好,但根据本研究结果此方法并不适合龙趸石斑鱼肝脏中VA的提取。室温皂化法因没有加热处理,作用更温和,反应速率也较低,而本研究对象的脂肪含量高,因此在室温条件下其所需的皂化反应时间更长,然而长时间暴露于碱性环境中对VA反而造成了破坏,这可能是室温皂化法VA含量低于水浴皂化法的原因。经过对比分析,结合表1试验结果,选择水浴皂化法对样品进行预处理。
2.2.4 水浴皂化法的加标回收率
向均质处理的龙趸石斑鱼肝脏中分别按低、中、高3种水平加入VA1、VA2标准品,然后采用水浴皂化法进行预处理,再采用反相色谱法检测VA含量,计算加标回收率,结果见表2。

表2 加标回收率
由表2可知,VA1加标回收率在98.40%~110.90%之间,VA2加标回收率在83.62%~99.56%之间,回收率良好。综合以上结果本研究选择水浴皂化法进行VA的提取,由于水浴皂化法日间RSD相对较大,因此需在提取当天尽快测定。
2.3 9种经济鱼类肝脏VA含量比较
选取草鱼、乌鳢、金鲳鱼、点篮子鱼、花鲢、珍珠龙胆石斑鱼、龙趸石斑鱼、罗非鱼、大口黑鲈这9种常见的经济鱼类进行研究,其中草鱼、乌鳢、花鲢、罗非鱼、大口黑鲈为淡水鱼,其余为海水鱼。将这些鱼类的肝脏采用水浴皂化法进行预处理,再采用反相色谱法检测VA含量,结果见图7。
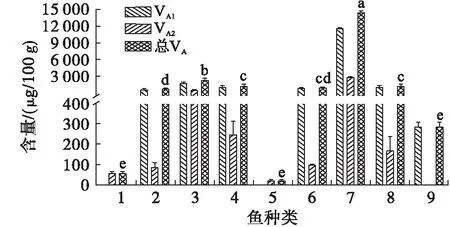
注:1.乌鳢;2.草鱼;3.花鲢;4.罗非鱼;5.大口黑鲈;6.金鲳鱼;7.龙趸石斑鱼;8.珍珠龙胆石斑鱼;9.点篮子鱼。对VA总含量进行分析,不同字母表示具有显著差异,p<0.05
由图7可见,在这9种鱼中,龙趸石斑鱼肝脏中VA总含量为14 413.78 μg/100 g,显著高于其他鱼(p<0.05),花鲢肝脏中VA总含量为2 337.36 μg/100 g,低于龙趸石斑鱼但显著高于其他鱼(p<0.05),珍珠龙胆石斑鱼及罗非鱼肝脏中VA总含量分别为1 265.13、1 287.85 μg/100 g,显著高于乌鳢、草鱼、大口黑鲈及点篮子鱼(p<0.05),金鲳鱼肝脏中VA总含量为1 019.71 μg/100 g,草鱼肝脏中VA总含量为765.03 μg/100 g,两者均显著高于乌鳢、大口黑鲈及点篮子鱼(p<0.05),乌鳢、大口黑鲈及点篮子鱼相比其他鱼肝脏中VA总含量较低,分别为57.01、23.02、287.56 μg/100 g。乌鳢和大口黑鲈肝脏中仅含VA2,点篮子鱼肝脏中仅含VA1,其他6种鱼中都含有VA1、VA2两种类型的VA。
在本研究中淡水鱼类肝脏均含有VA2,一般来说VA2多存在于淡水鱼类中,但随着研究的深入,发现不少海水鱼体内也存在VA2。本研究共测定了4种海水鱼,其中金鲳鱼、龙趸石斑鱼、珍珠龙胆石斑鱼这3种海水鱼类肝脏中均存在VA2。Kondrashev等[25]在叉线六线鱼及线鳚鱼这两种海水鱼体内也发现存在比例不低的VA2。研究表明,脂溶性维生素不能通过体液排出体外,易在体内累积,肝脏中VA的含量随着饮食中VA水平的增加而升高,且两者呈显著线性正相关[26]。本研究选取的9种鱼均为人工饲养,龙趸石斑鱼在这几种鱼中个体最大,养殖时间最长,体内蓄积的VA含量也最高。不同鱼类肝脏中VA种类及含量的不同,与鱼种类、个体大小、自身的食性及饲养管理水平等多方面因素相关[27]。
3 结 论
本文通过筛选鱼类肝脏中VA提取的样品预处理方法和检测方法对鱼类肝脏中VA含量进行测定,确定水浴皂化法能最多地将鱼肝脏中VA提取出来,反相色谱法检测分离VA1、VA2情况良好、稳定性高,水浴皂化法结合反相色谱法适用于鱼类肝脏中VA的分析测定。VA在鱼类肝脏中含量丰富,在检测的9种鱼中,除了乌鳢和大口黑鲈外,其他鱼类肝脏中VA总含量均达200 μg/100 g以上,其中海水鱼龙趸石斑鱼肝脏中VA总含量最高,达到14 413.78 μg/100 g。研究结果为天然VA新资源的开发提供了前期基础数据。
