酶法合成sn-2位富含DHA的中长链结构脂
2022-07-01徐秀丽晁仲昊张石群邹孝强
姜 萱, 杨 瑶, 徐秀丽, 晁仲昊, 张石群, 程 阳, 邹孝强
(江南大学 食品学院,江苏 无锡 214122)
二十二碳六烯酸(DHA)是大脑组织中常见的ω-3长链多不饱和脂肪酸(PUFA),有多种药理与生理功能[1-6]。DHA是大脑生长和维持功能所必需的脂肪酸,对婴幼儿的神经、视力、大脑发育有着重要意义,但是婴儿内源性合成DHA不能满足自身生长发育需求,故需通过饮食补充DHA[7-8]。婴儿的消化系统发育不完善,其胃脂肪酶的水平虽然与成年人相似,但胰脂肪酶和胆盐的含量分别仅为成年人的5%~10%和50%,所以婴儿的每日脂肪摄入量虽然是成年人的3~5倍,但其消化能力有限,吸收率显著低于成人[7-8]。因此,提高DHA在婴儿体内的生物利用度非常重要。
中长中(MLM)型结构脂是最典型的中长链结构脂(MLSL),即中链脂肪酸(MCFA)位于sn-1,3位,而长链脂肪酸(LCFA)位于sn-2位。人体内的胃脂肪酶和胰脂肪酶特异性作用于sn-1,3位,同时由于MCFA有良好的水溶性,在sn-1,3位的MCFA与LCFA相比更容易被水解,并经门静脉吸收后快速供能[9];水解产生的sn-2位的单甘酯(MAG)富含LCFA,可通过肠壁快速吸收。因此,MLM型结构脂被认为是功能性脂肪酸的理想载体[10-11]。
有研究以商业真菌发酵的微生物油为原料,通过酶促酯交换及酸解反应,制备了富含PUFA的MLSL[12-15]。许多研究为提高反应速率选择反应温度40~60℃,在长时间的保温反应过程中PUFA较易发生氧化,丧失生物活性。同时,酶促酯交换反应的体系中不仅包含MLM型结构脂,还包含其他类型的MLSL及未反应的底物,MLM型结构脂分离困难;而酶促酸解反应中,sn-1,3位特异性脂肪酶对PUFA的活性较低,最终的产品中较多MLSL含有2个LCFA分子。因此,酯交换和酸解法难以获得高纯度的MLM型结构脂 。本研究在25℃下采用两步酶法制备富含MLM型结构脂的产品,减少了DHA在反应过程中的氧化,同时有效提高了产品中MLM型结构脂的含量。
本研究首先制备sn-2位富含DHA的MAG,随后通过脂肪酶催化其与癸酸(CA)的酯化反应获得MLM型MLSL。对酯化反应的除水方式,脂肪酶种类及添加量,底物摩尔比及反应时间对甘油酯组成的影响进行了考察,并对最终产物的组成进行了分析,以期为富含DHA的中长链结构脂的工业化应用提供参考。
1 材料与方法
1.1 实验材料
DHA藻油(来源于裂殖壶藻),厦门汇盛生物有限公司;固定化脂肪酶Lipozyme RM IM(来源于Rhizomucormiehei)、Lipozyme 435(来源于Candidaantarctica)、Lipozyme TL IM(来源于Thermomyceslanuginosus)、Novozym 40086(来源于Aspergillusoryzae),诺维信(中国)生物技术有限公司;无水乙醇(纯度≥99.5%),上海麦克林生化科技有限公司;癸酸(纯度99%),北京百灵威科技有限公司;正己烷、异丙醇,色谱纯,百灵威科技有限公司;2,7-二氯荧光素、正己烷、乙腈、乙酸、氯仿,分析纯,国药集团化学试剂有限公司;4 Å分子筛,国药集团化学试剂有限公司;薄层色谱硅胶板(20 cm×20 cm,10 cm×20 cm),乳山市太阳干燥剂有限公司;三油酸甘油酯标准品(纯度≥99%)、二油酸甘油酯混标(其中1,3-二油酸甘油酯含量为85%、1,2-二油酸甘油酯含量为15%)、2-油酸甘油酯(纯度≥95%)、1-油酸甘油酯(纯度≥99%)、37种脂肪酸甲酯混标,Sigma-Aldrich上海有限公司;DHA甲酯标准品溶液(9.99 mg/mL),Supelco公司。
夹层反应釜;低温恒温槽;SHZ-3型循环水多用真空泵;Agilent 7820A气相色谱仪,美国安捷伦科技有限公司;Waters 1525高效液相色谱仪、Waters Acquity UPLC、Waters Xevo G2-S Q-TOF 质谱仪,美国Waters科技有限公司;Alltech 3300蒸发光检测器,美国Grace公司。
1.2 实验方法
1.2.1 MAG的制备
参照文献[16]的方法进行MAG的制备。为了减少2-MAG发生酰基迁移,并防止PUFA氧化,DHA藻油的酶促醇解在25℃下进行。将DHA藻油和无水乙醇按照质量比1∶3混合,置于25 mL夹层反应釜中,添加10% Lipozyme 435,在350 r/min磁力搅拌下反应6 h,旋转蒸发除去体系中的乙醇,得粗产物。再采用溶剂进行萃取,具体为:取1 mL粗产物溶解在9 mL 95%乙腈中,用9 mL正己烷洗涤乙腈体系3次;取乙腈相,旋转蒸发除去溶剂后,溶于10 mL氯仿中,然后与10%乙醇溶液充分混合,分离后收集氯仿层,并用10 mL氯仿洗涤水相2次,合并氯仿层,旋转蒸发除去氯仿,得到MAG。
1.2.2 sn-2位富含DHA的中长链结构脂的制备
将1.2.1制备的MAG与CA以一定的摩尔比混合,添加一定量的脂肪酶,在25℃、350 r/min磁力搅拌、除水条件下进行反应,每隔一定时间取样,分析反应产物的甘油酯组成。
1.2.3 甘油酯组成分析
利用配有LiChrospher Si柱(5 μm,250 mm×4.6 mm)的高效液相色谱(HPLC)和蒸发光散射检测器(ELSD)对中长链结构脂的甘油酯组成进行分析。HPLC条件:柱温30℃;ELSD温度55℃;流动相A为正己烷-异丙醇(体积比99∶1),流动相B为异丙醇-正己烷-乙酸(体积比1∶1∶0.01),流速为1.0 mL/min;梯度洗脱程序为流动相A在10 min内由100%线性降至80%,在10~14 min降至70%,随后在1 min内升至100%并保持5 min,总运行时间为20 min。采用峰面积归一化法进行定量。
1.2.4 甘油三酯(TAG)脂肪酸组成分析
取50 μL待测样品,采用薄层层析(TLC)将样品中的TAG分离,展开剂为正己烷-乙醚-乙酸(体积比80∶20∶1)[17]。在硅胶板上均匀喷洒0.2% 2,7-二氯荧光素乙醇溶液,在紫外光下显色,刮下对应TAG的条带,加入500 μL 2 mol/L的氢氧化钾-甲醇溶液,充分旋涡振荡后,用2 mL正己烷萃取脂肪酸甲酯2次,经无水硫酸钠柱干燥、氮气浓缩后,进行气相色谱分析。
气相色谱条件:SP-TM-380毛细管柱(60 m×0.32 mm×0.2 μm);色谱柱升温程序为先在100℃下保持4 min,然后以15℃/min的速率升温到180℃并保持4 min,最后以4℃/min的速率升温至215℃;进样口温度和火焰离子化检测器温度均为250℃;载气为氮气,流速为1 mL/min;分流比100∶1。
通过与标准品的保留时间进行定性,通过峰面积归一化法进行定量。
1.2.5 sn-2位脂肪酸组成分析
将30 mg样品溶解于10 mL乙醚中,添加0.3 mL烯丙基溴化镁,剧烈搅拌1 min后,加入8 mL酸缓冲液(含0.27 mol/L HCl和0.4 mol/L硼酸)停止反应。除去水相,将乙醚萃取液用硼酸洗涤2次,并用无水硫酸钠干燥。采用氮气将乙醚相蒸发至150 μL,用氯仿-丙酮(体积比90∶10)为展开剂,在硼酸浸渍的TLC板上分离。将sn-2 MAG条带刮下,并用2 mL乙醚萃取2次,用无水硫酸钠干燥、氮气浓缩后进行甲酯化反应,采用气相色谱分析脂肪酸组成[18]。
1.2.6 酯化反应产物中TAG的纯化
参考Hita等[19]的方法对1.2.2得到的酯化反应产物中TAG进行分离纯化。将5.0 g酯化反应产物溶于125 mL正己烷,加入75 mL 0.8 mol/L KOH溶液(30%乙醇配制),充分混合,游离脂肪酸及其钾盐溶于水相,TAG溶于有机相;两相分离后,用10 mL正己烷洗涤水相2次;合并有机相,旋转蒸发除去溶剂,得到纯化的TAG。
1.2.7 TAG构型分析
将1.2.6所得纯化的TAG用色谱纯正己烷配制成质量浓度为 0.5 mg/mL的溶液,进配备BEH C18 柱(2.1 mm×50 mm×1.9 μm)和四级杆飞行时间质谱仪的超高效液相色谱(UPLC)系统分析甘油三酯的构型。UPLC条件:进样量1.0 μL;柱温45℃;流动相 A为乙腈-异丙醇(体积比1∶9),流动相 B为40%乙腈溶液,流动相中均加入10 mmol/L的乙酸铵;梯度洗脱程序为流动相A在0~1 min为70%,在1~30 min由70%线性升至87%,保持1 min,在31~32 min由87%线性降至70%,保持4 min;流速300 μL/min。MS条件:ESI 正离子模式;毛细管电压3.5 kV,锥孔电压30 V;离子源温度100℃;碰撞气体为氩气,流速50 L/h;脱溶剂温度400℃;去溶剂化气体为氮气,流速700 L/h;质量扫描范围(m/z)200~1 500。根据质谱信息对TAG构型进行准确定性,采用峰面积归一化法进行定量。
1.2.8 统计分析
所有样品测定均重复3次,数据由Microsoft Excel 2010和Origin 8.5软件计算得出,并以“平均值±标准差”表示。使用SAS软件对数据进行方差分析(ANOVA)。显著性水平为α=0.05,在p<0.05 时差异显著。
2 结果与讨论
2.1 MAG的甘油酯组成
DHA藻油经过醇解及溶剂萃取后,得到的MAG的甘油酯组成如图1所示。由图1可以看出,MAG中2-MAG含量为80.21%。
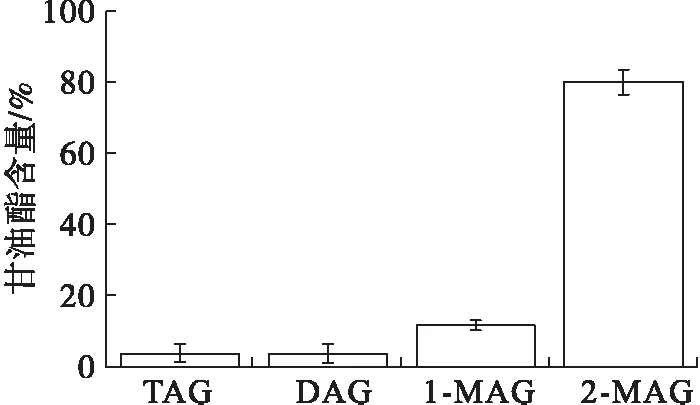
图1 MAG的甘油酯组成
2.2 M-DHA-M型MLSL制备的单因素实验
2.2.1 除水方式对酯化反应的影响
在MAG与CA的酯化反应中,及时从反应体系中除去副产物水,将大大提高产品中TAG的产率。在MAG与CA摩尔比1∶3、Lipozyme TL IM添加量为底物质量的10%、反应温度25℃条件下,考察不同除水方式对反应体系中TAG含量的影响,结果如图2所示。
由图2可以看出,常压下的反应体系反应24 h后,TAG含量均显著高于10 h时的,说明在10 h时酯化反应尚未达到平衡。在常压下,选用棍形分子筛+正己烷体系的TAG含量较高,反应24 h时TAG含量达到82.75%;而选用球形分子筛的反应中,在正己烷体系和无溶剂体系下反应24 h后,TAG含量分别达到75.04%和63.34%。在真空度0.05 MPa下的反应体系在5 h内TAG含量急剧上升,7 h后接近平衡,反应9 h时TAG含量达到97.48%,远高于其他3种除水方式的。有研究表明,正己烷作为溶剂会导致酰基迁移率上升[20];而真空环境下,TAG积累速率更高,平衡条件下TAG含量更高,说明真空除水效率高,与文献[16]结果相符,且真空除水避免了溶剂对酰基迁移的影响。因此,选择0.05 MPa真空作为除水的最佳方法。
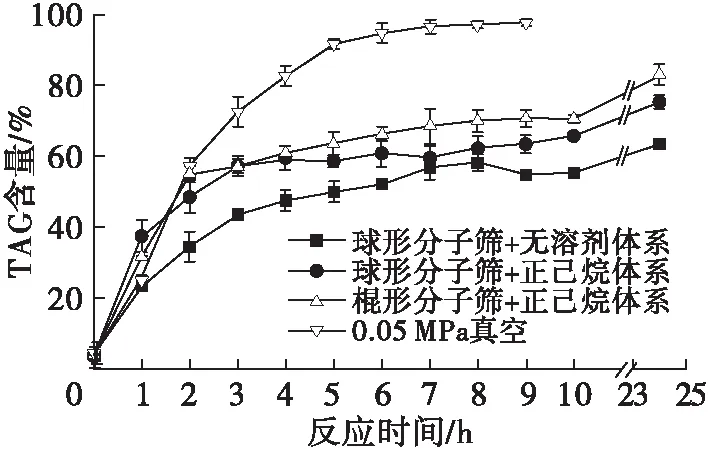
注:正己烷体系(正己烷体积为底物质量的4倍);球形分子筛和棍形分子筛添加量均为200 mg;分子筛在马弗炉中500℃下活化4 h
2.2.2 脂肪酶种类对酯化反应的影响
本研究采用固定化脂肪酶催化MAG与CA的酯化反应。Lipozyme TL IM、Lipozyme RM IM及Novozym 40086为特异性催化sn-1,3位的固定化脂肪酶,为了提高TAG的生产效率,比较了3种脂肪酶在酯化反应中的催化能力。在MAG与CA摩尔比1∶3、脂肪酶添加量为底物质量的10%、反应温度25℃、真空度0.05 MPa条件下,考察脂肪酶种类对反应体系中TAG含量的影响,结果如图3所示。
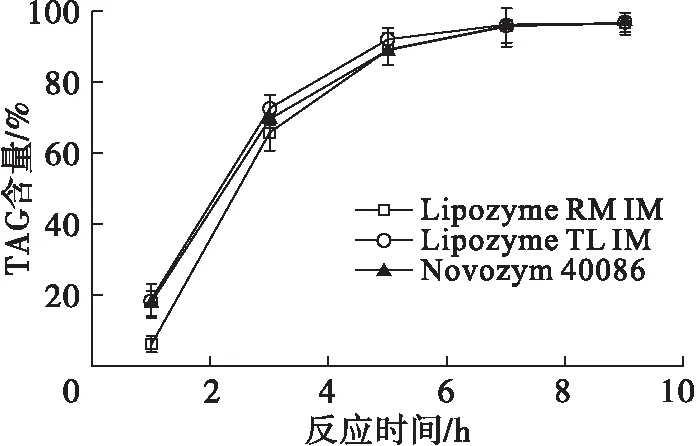
图3 脂肪酶种类对酯化反应体系中TAG含量的影响
由图3可以看出,使用不同种类的脂肪酶不会改变反应的平衡状态,但会影响反应效率,从而影响反应平衡所需时间。Lipozyme TL IM在反应5 h内表现出最强的催化活力,反应5 h时反应体系中TAG含量达到93.57%,而反应7 h时,Novozym 40086、Lipozyme TL IM和Lipozyme RM IM催化的反应体系中的TAG含量均接近96.50%。Lipozyme TL IM的价格相对其他2种脂肪酶更低。综合考虑经济性及催化性能,选择Lipozyme TL IM作为酯化反应的催化剂。
2.2.3 MAG与CA摩尔比对酯化反应的影响
在可逆反应中,底物摩尔比是影响反应平衡状态的重要因素,同时影响反应效率。在Lipozyme TL IM添加量为底物质量的10%、反应温度25℃、真空度0.05 MPa条件下,考察MAG与CA摩尔比对反应体系中TAG含量的影响,结果如图4所示。

图4 MAG与CA摩尔比对酯化反应体系中TAG含量的影响
由图4可以看出,反应9 h时,MAG与CA摩尔比为1∶2的反应体系中TAG含量为92.05%,而MAG与CA摩尔比为1∶3、1∶4及1∶5的反应体系中TAG含量均高于97%。随着MAG与CA摩尔比从1∶2增加到1∶3,酯化反应速率和平衡状态下TAG含量均有显著提升;MAG与CA摩尔比从1∶3增加到1∶5,反应速率和TAG含量提高幅度较小,表明CA足量时,其含量提升对反应速率及平衡状态的影响较小。但是CA的增加会导致体系中脂肪酸含量显著增加,促进氧化,且过量的脂肪酸会增加脱酸的成本,因此应选择脂肪酸含量更低的MAG与CA摩尔比[21]。综合考虑,选择MAG与CA摩尔比1∶3。
2.2.4 Lipozyme TL IM添加量对酯化反应的影响
在MAG与CA摩尔比1∶3、反应温度25℃、真空度0.05 MPa条件下,考察Lipozyme TL IM添加量对反应体系中TAG含量的影响,结果如图5所示。
由图5可以看出:Lipozyme TL IM添加量为10%时,反应体系中TAG含量在反应时间0~5 h时急剧上升,反应5 h达到91.36%,反应7 h后趋于稳定,达到96.56%;Lipozyme TL IM添加量4%、6%及8%的反应体系中TAG含量随反应时间延长不断上升,在反应9 h时分别达到88.95%、94.84%及96.55%。在4%~10%的范围内,反应速率随着Lipozyme TL IM添加量的增加而提高,这是由于Lipozyme TL IM添加量较低时,体系内酶的含量不足以满足底物的接触需求;随着Lipozyme TL IM添加量的增加,酶与底物接触频率增加,酯化反应速率提高。由于反应9 h时Lipozyme TL IM添加量为8%的反应体系与添加量为10%的反应体系中TAG含量接近,因此选择Lipozyme TL IM添加量为8%。
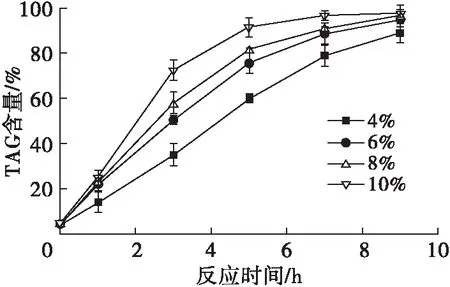
图5 Lipozyme TL IM添加量对酯化反应体系中TAG含量的影响
综上,通过单因素实验,得到酯化反应的最优条件为:反应温度25℃,MAG与CA摩尔比1∶3,脂肪酶Lipozyme TL IM添加量为底物质量的8%,真空度0.05 MPa,反应时间9 h。在优化条件下得到的产物中TAG含量为96.55%。
2.3 TAG的脂肪酸组成
对最优酯化条件得到的产物按1.2.4方法分离TAG,并测定其脂肪酸组成,同时与DHA藻油的脂肪酸组成进行对比,结果如表1所示。
由表1可知:DHA、棕榈酸(PA,C16∶0)及二十二碳五烯酸(DPA,C22∶5)是DHA藻油中的主要脂肪酸,含量分别为54.12%、25.72%及10.96%;而其sn-2位脂肪酸组成中,PUFA(包括DPA和DHA)总含量为87.86%,其中DHA含量为69.39%。TAG中总脂肪酸以癸酸和DHA为主,含量分别为40.27%和40.04%;与DHA藻油相比,TAG中DHA含量略有下降,棕榈酸含量显著下降,而癸酸含量显著提升。TAG中sn-2位的脂肪酸主要为DHA和DPA,含量分别为72.15%和14.73%,癸酸含量仅为3.17%,表明在优化条件下酰基迁移率低。与DHA藻油相比,TAG中sn-2位的DHA含量更高,原因可能是以下两点:一是脂肪酶对DHA的活性较低,在醇解制备MAG的过程中,倾向于水解具有较短碳链及低不饱和脂肪酸,对DHA有一定的富集效果;二是sn-2位上的部分脂肪酸,如棕榈酸及油酸,更容易发生酰基转移,从而导致sn-2位的DHA含量增加。

表1 原料及TAG的脂肪酸组成 %
2.4 产品的TAG构型
采用UPLC-Q-TOF-MS分离鉴定产品中的TAG构型,结果见表2。

表2 产品的TAG种类及含量
由表2可知:从产品中共分析出14个TAG母离子,从中鉴定出16种甘油酯,其中MLSL含量为99.14%,含有DHA的 MLSL含量为67.69%; DHA-CA-CA及DPA-CA-CA是产品中最主要的2种TAG,含量分别为54.78%及20.49%。
结合脂肪酸组成与甘油三酯的鉴定,可以认为产品中的主要成分是MLM型TAG,且富含CA-DHA-CA。
3 结 论
本研究以酶催化醇解DHA藻油(来源于裂殖壶藻)获得的sn-2位富含DHA的MAG为反应原料,以CA为酰基供体,通过脂肪酶催化酯化反应制备sn-2位富含DHA的MLSL。最优酯化反应条件为:MAG与CA摩尔比1∶3,反应温度25℃,脂肪酶Lipozyme TL IM添加量为底物质量的8%,真空度0.05 MPa,反应时间9 h。在最优条件下,酯化产物中TAG含量为96.55%,TAG的脂肪酸组成中,DHA占总脂肪酸的40.04%,占sn-2位脂肪酸的72.15%;纯化的产品中中长链结构脂含量为99.14%,含DHA的中长链结构脂含量为67.69%。该产品富含CA-DHA-CA,可从分子层面提升DHA的生物利用率,并应用于婴儿配方食品及功能性食品。
