白藜芦醇酰胺衍生物的合成、体外抗炎活性与分子对接
2022-06-30王璐琼牟晓凤
辛 敏,王璐琼,牟晓凤,赵 烽
(烟台大学药学院,新型制剂与生物技术药物研究山东省高校协同创新中心(烟台大学),分子药理和药物评价教育部重点实验室,山东 烟台 264005)
炎症是机体在遭受刺激后所做出保护细胞免受损伤与感染的一种防御反应[1]。长期的慢性炎症反应或炎症反应过强会诱导相关疾病的发生发展,如肝炎、糖尿病、痛风、心血管疾病、肿瘤等[2-5]。非甾体类抗炎药(NSAIDs),如阿司匹林、吲哚美辛和布洛芬等是炎症治疗中最常用的药物[6]。然而,长期使用NSAIDs常伴随着胃肠道、肾、肝和心血管系统等器官的副作用[7]。因此,寻找治疗炎症的高效低毒药物是药物设计的一个重要挑战。
天然产物一直以来都是开发和设计新型抗炎药的重要来源。白藜芦醇(Res,图1)是一种存在于葡萄、花生和虎杖等植物中的植物抗毒素[7],具有抗菌[8]、抗炎[9]、抗氧化[10]和抗癌[11-12]等多种生物活性。白藜芦醇可通过阻断NF-κB的活化以及抑制COX-2、iNOS的活性,从而减少PGE2和NO的产生,来发挥抗炎作用[13],并能加速愈合由非甾体抗炎药引起的胃粘膜损伤[14]。但白藜芦醇的结构不稳定,极易被氧化,且双键具有高度光敏性,在紫外光照射下易转变成活性较低的顺式结构。近年来,众多研究者以白藜芦醇为先导物,对其羟基[15]、苯环[16]以及双键[11]等官能团进行化学修饰,以提高其稳定性及生物活性。有研究表明,白藜芦醇酰胺衍生物在抗肿瘤[17]、抗病毒[18]和抗菌[19]方面显示出了良好的活性,但到目前为止,鲜有对白藜芦醇酰胺衍生物抗炎活性明确的研究报道。因此,本研究受白藜芦醇的抗炎活性启发,研究白藜芦醇酰胺衍生物的抗炎作用,挖掘潜在抗炎药物先导化合物。
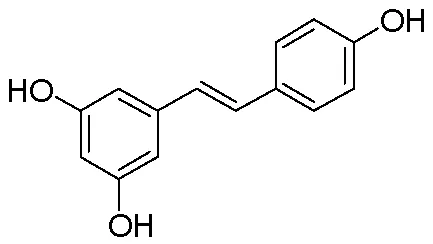
图1 白藜芦醇的结构式
通过对已上市的具有酰胺结构的抗炎药物(如扑热息痛、美洛昔康等)进行结构分析,本研究设计以酰胺键代替白藜芦醇中光敏性的双键结构合成系列结构相对稳定的白藜芦醇酰胺衍生物并对其抗炎活性进行研究。本研究对白藜芦醇的结构进行修饰,共设计并合成了9个白藜芦醇酰胺衍生物(图2)。经文献调研发现以上白藜芦醇酰胺衍生物为已知化合物结构,但其抗炎活性未见报道。因此,本研究在细胞水平研究了这些衍生物对小鼠单核巨噬细胞 RAW 264.7的细胞毒性和对LPS诱导RAW 264.7细胞释放炎症介质NO的抑制作用,在分子水平测试了这些衍生物的COX-2酶抑制活性。最后,采用计算机模拟分子对接探索白藜芦醇酰胺衍生物与COX-2酶的可能作用模式。

图2 白藜芦醇酰胺衍生物2—10结构式
1 材料和方法
1.1 仪器与试剂
400 MHz核磁共振波谱仪(Bruker Advance-400 FT,德国Bruker公司);Expression CMS 质谱仪(美国Advion公司);DF-101S集热式恒温加热磁力搅拌器 (郑州长城科工贸有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);WFH-203型三用紫外分析仪(上海驰唐电子有限公司);RPMI 1640 培养基和胎牛血清(Hyclone公司);MTT、细胞培养级DMSO、LPS 购自Sigma-Aldrich (St.Louis,MO,USA);一氧化氮测定试剂盒(烟台赛尔斯生物技术有限公司);COX-2抑制剂筛选试剂盒(上海碧云天生物技术有限公司);CKX31型倒置显微镜(菲律宾奥林巴士公司);3111 型恒温二氧化碳培养箱(美国Thermo公司);5810R台式高速大容量冷冻离心机(Eppendorf 公司);SYNER-GYHT型酶标仪(美国BIO-TEC公司);实验所需各种原料试剂、催化剂皆购自Adamas公司;乙酸乙酯、石油醚等,所有试剂除特殊说明均为分析纯。
1.2 化学合成
称取苯甲酸类化合物1 mmol溶于5 mL丙酮(acetone)中,先加入3 mmol HATU催化剂搅拌均匀后,加入3 mmol三乙胺,最后加入2 mmol苯胺类化合物,常温搅拌反应16 h,以TLC监测反应进程[20],白藜芦醇酰胺衍生物2—10合成路线见图3。反应结束后,减压蒸干丙酮,以30 mL乙酸乙酯溶解固体。将乙酸乙酯层用5 % HCl 洗4次,水洗1次,饱和NaHCO3洗3次,再用水洗2次,减压蒸干后得到粗产品,对其重结晶得到纯品化合物。白藜芦醇酰胺衍生物2—10合成路线如图3所示。
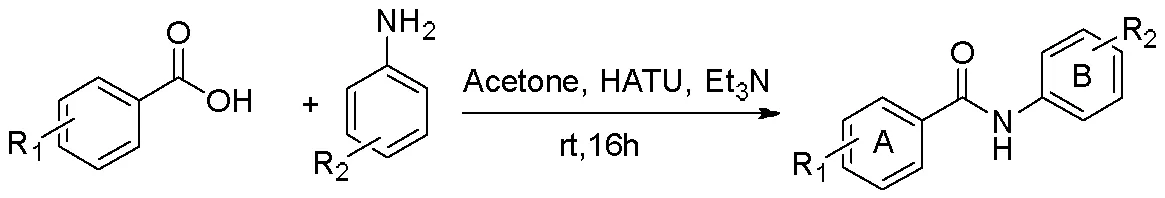
图3 白藜芦醇酰胺衍生物2—10的合成路线
化合物2:白色固体,产率50.9%,mp 154 ~ 155.6 ℃;1H NMR (400 MHz, Acetone-d6)δ9.30 (s, 1H), 8.24 (s, 1H), 7.79 (s, 1H), 7.76 (td,J=4.5, 1.6 Hz,1H), 7.63 (dt,J=8.9, 2.2 Hz, 2H), 7.36 (dd,J=5.1, 0.7 Hz, 2H), 6.82 (dt,J=8.9, 2.2 Hz, 2H), 2.39 (s, 3H);13C NMR (100 MHz, Acetone-d6)δ166.50, 155.24, 139.39, 137.06, 133.18, 132.94, 129.62, 129.30, 125.83, 123.33, 116.44, 21.85; ESI-MSm/z: 227.9 [M+H]+。
化合物3:白色固体,产率57.6%,mp 152.6 ~ 154 ℃;1H NMR (400 MHz, Acetone-d6)δ9.38 (s, 1H), 8.38 (s, 1H), 7.76 (dd,J=10.6, 5.3 Hz, 2H), 7.54 (t,J=2.2 Hz, 1H), 7.41 ~ 7.31 (m, 2H), 7.24 (d,J=7.2 Hz, 1H), 7.14 (t,J=8.1 Hz, 1H), 6.60 (ddd,J=8.0, 2.4, 0.9 Hz, 1H), 2.39 (s, 3H);13C NMR (100 MHz, Acetone-d6)δ166.93, 159.11, 142.01, 139.44, 133.37, 130.68, 129.64, 129.36, 125.91, 112.59, 112.06, 108.66, 21.82; ESI-MSm/z: 227.9 [M+H]+。
化合物4:白色固体,产率73.8%,mp 169.2 ~ 169.9 ℃;1H NMR (400 MHz, Acetone-d6)δ9.46 (s, 1H), 9.23 (s, 1H), 7.86 (s, 1H), 7.83 (dd,J=5.9, 1.9 Hz, 1H), 7.72 (dd,J=8.0, 1.6 Hz, 1H), 7.43 (dd,J=10.0, 4.3 Hz, 2H), 7.09 (td,J=8.0, 1.3 Hz, 1H), 6.98 (dd,J=8.1, 1.5 Hz,1H), 6.89 (td,J=8.0, 1.3 Hz, 1H), 2.42 (s, 3H);13C NMR (100 MHz, Acetone-d6)δ168.03, 150.19, 139.95, 135.60, 134.15, 130.05, 129.63, 128.25, 127.37, 126.15, 124.03, 121.35, 119.12, 21.93; ESI-MSm/z: 227.9 [M+H]+。
化合物5:黄色固体,产率87%,mp 269.6 ~ 271.4 ℃;1H NMR (400 MHz, Acetone-d6)δ9.66 (s, 1H), 8.35 (d,J=8.7 Hz, 2H), 8.31 (s, 1H), 8.22 (d,J=8.7 Hz, 2H), 7.64 (d,J=8.8 Hz, 2H), 6.85 (d,J=8.8 Hz, 2H);13C NMR (100 MHz, Acetone-d6)δ164.74, 155.79, 151.05, 142.82, 132.52, 130.28, 124.96, 123.60, 116.66; ESI-MSm/z: 258.8 [M+H]+。
化合物6:黄色固体,产率46.5%,mp 204.2 ~ 205.1 ℃;1H NMR (400 MHz, Acetone-d6)δ9.79 (s, 1H), 8.35 (d,J=8.8 Hz, 2H), 8.21 (d,J=8.8 Hz, 2H), 7.50 (t,J=2.0 Hz, 1H), 7.27 ~ 7.20 (m, 1H), 7.16 (t,J=8.0 Hz, 1H), 6.64 (ddd,J=8.0, 2.4, 0.9 Hz, 1H);13C NMR (100 MHz, Acetone-d6)δ165.05, 159.15, 150.94, 142.51, 141.39, 130.75, 130.23, 124.79, 112.61, 108.78; ESI-MSm/z: 258.9 [M+H]+。
化合物7:黄色固体,产率89.2%,mp 204.5 ~ 205.8 ℃;1H NMR (400 MHz, Acetone-d6)δ9.57 (s, 1H), 9.06 (s, 1H), 8.40 (dt,J=9.2, 1.8 Hz, 2H), 8.28 (dt,J=9.2, 1.8 Hz, 2H), 7.85 (dd,J=8.3, 1.8 Hz, 1H), 7.10 (dddd,J=8.2, 7.3, 1.7, 0.6 Hz, 1H), 6.99 (dd,J=8.2, 1.7 Hz, 1H), 6.92 (tdd,J=7.3, 1.7, 0.6 Hz, 1H);13C NMR (100 MHz, Acetone-d6)δ165.81, 151.41, 150.05, 141.63, 130.52, 127.76, 127.62, 125.19, 124.20, 121.43, 118.46; ESI-MSm/z: 258.9 [M+H]+。
化合物8:白色固体,产率15%,mp 228.2 ~ 230.1 ℃;1H NMR (400 MHz, Acetone-d6)δ9.54 (s, 1H), 8.55 (s, 1H), 8.29 (s, 1H), 8.05 ~ 7.97 (m, 4H), 7.73 ~ 7.66 (m, 2H), 7.64 ~ 7.55 (m, 2H), 6.85 (d,J=8.9 Hz, 2H);13C NMR (100 MHz, Acetone-d6)δ166.36, 155.27, 136.04, 134.28, 134.03, 132.85, 130.21, 129.37, 129.02, 128.89, 128.84, 128.00, 125.62, 123.31, 116.41; ESI-MSm/z: 263.9 [M+H]+。
化合物9:白色固体,产率14.6%,mp 251.6 ~ 252.9 ℃;1H NMR (400 MHz, Acetone-d6)δ9.61 (s, 1H), 8.55 (s, 1H), 8.42 (s, 1H), 8.06 ~ 7.75 (m, 4H), 7.63 ~ 7.58 (m, 3H), 7.31 ~ 7.28 (m, 1H), 7.17 (t,J=8.1 Hz, 1H), 6.62 (ddd,J=8.0, 2.4, 1.1 Hz, 1H);13C NMR (100 MHz, Acetone-d6)δ166.86, 159.21, 142.06, 136.20, 134.27, 134.07, 130.75, 130.33, 129.51, 129.09, 128.14, 125.72, 112.64, 112.19, 108.73; ESI-MSm/z: 263.8 [M+H]+。
化合物10:黄色固体,产率96.6%,mp 185.5 ~ 187.3 ℃;1H NMR (400 MHz, Acetone-d6)δ9.66 (s, 1H), 9.27 (s, 1H), 8.66 (s, 1H), 8.10 (td,J=7.4, 1.8 Hz, 3H), 8.02 (dd,J=7.4, 1.7 Hz, 1H), 7.79 (dd,J=8.0, 1.6 Hz, 1H), 7.72 ~ 7.57 (m, 2H), 7.11 (ddd,J=8.1, 7.3, 1.6 Hz, 1H), 7.00 (dd,J=8.1, 1.5 Hz, 1H), 6.92 (ddd,J=8.0, 7.3, 1.5 Hz, 1H);13C NMR (100 MHz, Acetone-d6)δ167.95, 150.29, 136.58, 134.24, 132.98, 130.62, 129.98, 129.78, 129.59, 129.31, 128.50, 127.48, 125.58, 124.16, 121.43, 119.16; ESI-MSm/z: 263.8 [M+H]+。
1.3 细胞培养方法
在温度为37 ℃,5% CO2细胞培养箱中,对小鼠单核巨噬细胞RAW 264.7细胞进行培养,将热灭活胎牛血清和 RPMI 1640培养基按比例混合(通常比例为1∶9)成细胞培养液,当细胞生长到培养皿面积80%以上时,即可进行传代培养。
1.4 细胞存活率试验(MTT法)
将RAW 264.7细胞以密度约为1×106个/mL、每孔100 μL体积置于96孔板中,在37 ℃条件下培养1 h,待细胞贴壁后将96孔板分为空白组、阳性对照组、待测样品组,每组设3个平行孔。阳性对照组每孔加入0.2 μL的吲哚美辛(终浓度为100 μmol/L),待测样品组每孔加入0.2 μL不同浓度的化合物。加样结束后将96孔反应板置于37 ℃的细胞培养箱中孵育24 h;24 h后,每孔中加入5 mg/mL MTT溶液8 μL,再将96孔板置于37 ℃条件下继续培养4 h;弃去细胞培养液,每孔加入150 μL DMSO溶解甲臜,置于摇床上以一定速度振摇10 min左右,待甲臜结晶充分溶解后,使用酶标仪在双波长570 nm和630 nm条件下检测各孔中的吸光度(A)。
根据公式计算细胞存活率:
细胞存活率=(A给药组/A空白组)×100%。
1.5 Griess法测定NO浓度
将RAW 264.7细胞以1×106个/mL的密度、每孔200 μL的体积置于96孔板中。96孔板在恒温培养箱中孵育1 h后给药,将96孔板中的细胞分为空白组、LPS 组、阳性对照组、待测样品组,每组设3个平行孔。除空白组其他组每孔均加入2 μL的LPS(终浓度为1 μg/mL)建立炎症模型,阳性对照组每孔加0.4 μL吲哚美辛(浓度为100 μmol/L)。待测样品组依照细胞存活率试验结果从样品无细胞毒性浓度开始降浓度检测其抗炎活性,每孔加入0.4 μL待测样品。孵育24 h,吸取100 μL/孔细胞上清液于另一个96孔板中,同时配制一定浓度梯度的NaNO2溶液,每孔加入现配的Griess试剂(Griess A和Griess B等量混合,100 μL/孔),置于摇床上低速振摇10 min左右,使其显色,使用酶标仪在540 nm波长处检测吸光度,再根据绘制的NaNO2标准曲线计算出孔中的NO2-浓度。
1.6 检测对COX-2的抑制活性
按照制造商的说明进行操作,使用COX-2抑制剂筛选试剂盒检测待测化合物和白藜芦醇对COX-2的抑制活性。将COX-2检测缓冲液(30 mL)、COX-2辅助因子(600 μL)和COX-2工作液(550 μL)先后置于96孔板中,将待测化合物添加到上述溶液中后于37 ℃孵育10 min。孵育后,每孔中加入5 μL COX-2 Probe荧光探针,然后快速在每孔中加入5 μL COX-2 Substrate显色液,孵育10 min后在560 nm和590 nm波长条件下测定荧光。计算每个组的相对荧光值(Relative fluorescence value,RFU)分别记为RFU空白、RFU100%酶活性对照、RFU阳性对照和RFU待测化合物,抑制率的计算公式如下:
抑制率=(RFU100%酶活性对照-RFU待测化合物)/(RFU100%酶活性对照-RFU空白)×100%。
1.7 分子对接
为探索已合成的白藜芦醇酰胺衍生物与COX-2酶之间的结合相互作用,采用Tripos公司的 Sybyl-X 2.0 软件:以Minimize功能对白藜芦醇酰胺衍生物的三维结构进行能量最小化,得到优势构象配体;以COX-2(PDB: 5IKQ)的晶体结构作为分子对接的受体。运用Surflex-Dock模块将A/JMS 602配体周围的氨基酸残基6A范围内定义为对接的活性位点,确定其活性口袋。从蛋白质和水分子中去除配体。根据内源性配体自动生成活性袋,处理后的配体与COX-2的活性口袋对接。对接完成后,根据评分结果,观察配体与COX-2活性位点关键氨基酸残基的相互作用,并分析相互作用类型。
1.8 统计学分析

2 结果与讨论
2.1 目标化合物的合成
通过酰胺反应得到9个白藜芦醇酰胺衍生物,产率为14.6%~96.6%,性质为白色或黄色固体,纯度在95%以上。白藜芦醇酰胺衍生物是苯甲酸类化合物经HATU催化剂活化后与羟基苯胺的氨基发生酰胺反应所得到。HATU是活化苯甲酸活性最高的一种催化剂,比文献中报道的SOCl2毒性低[21],且反应步骤少。反应结束后,采用酸洗碱洗法除去反应原料,重结晶法纯化得到纯品。对获得的衍生物通过1H NMR,13C NMR和MS等手段进行结构表征,再通过文献比对,确定化合物为已知结构[20-23]。
2.2 细胞毒性
当细胞存活率>80%时视为化合物无明显细胞毒性。9个目标化合物对RAW 264.7细胞表现出不同程度的细胞毒性作用。如图4(a)所示,在100 μmol/L浓度下,化合物2—7和白藜芦醇对RAW 264.7细胞均无明显细胞毒性,化合物8—10表现出一定的细胞毒性。降低化合物浓度检测化合物8—10的细胞毒性发现(图4(b)),化合物8和10在50 μmol/L浓度以下对RAW 264.7细胞无明显毒性,化合物9在25 μmol/L浓度时即无明显细胞毒性。本研究后续实验皆在目标化合物无明显细胞毒性的浓度下进行。初步构效关系探讨表明,当A环含有萘环结构时可能会提高化合物的细胞毒性,A环的对位甲基和硝基则对化合物的细胞毒性无明显影响。
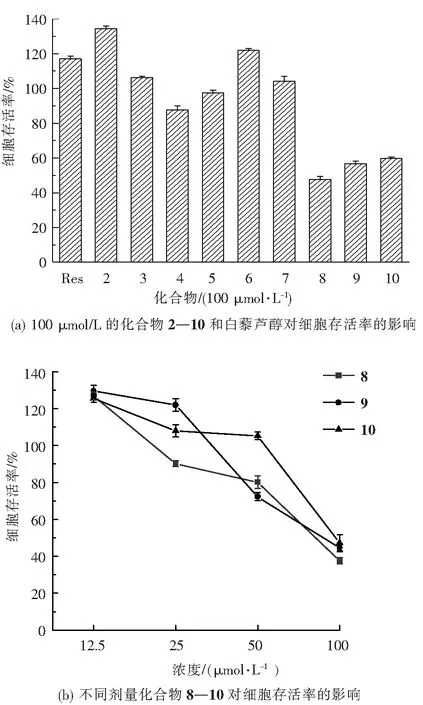
图4 白藜芦醇酰胺衍生物对RAW 264.7 细胞的细胞毒性
2.3 白藜芦醇酰胺衍生物对LPS诱导的NO释放的影响
抑制NO的生成是考察化合物抗炎活性的重要指标[24]。本文研究了白藜芦醇酰胺衍生物对LPS诱导的RAW 264.7细胞释放NO的抑制作用(图5,以100 μmol/L吲哚美辛作为阳性药)。如图5所示,与空白组相比,LPS组的NO含量显著升高,表明诱导炎症造模成功。通过该模型对所有目标化合物进行抗炎活性初步筛选,发现化合物3、4、5、6、9对LPS诱导RAW 264.7细胞释放NO没有显著抑制作用,化合物2、7、8和10在LPS诱导的RAW 264.7 细胞中对NO的产生具有显著抑制作用(图5(a))。
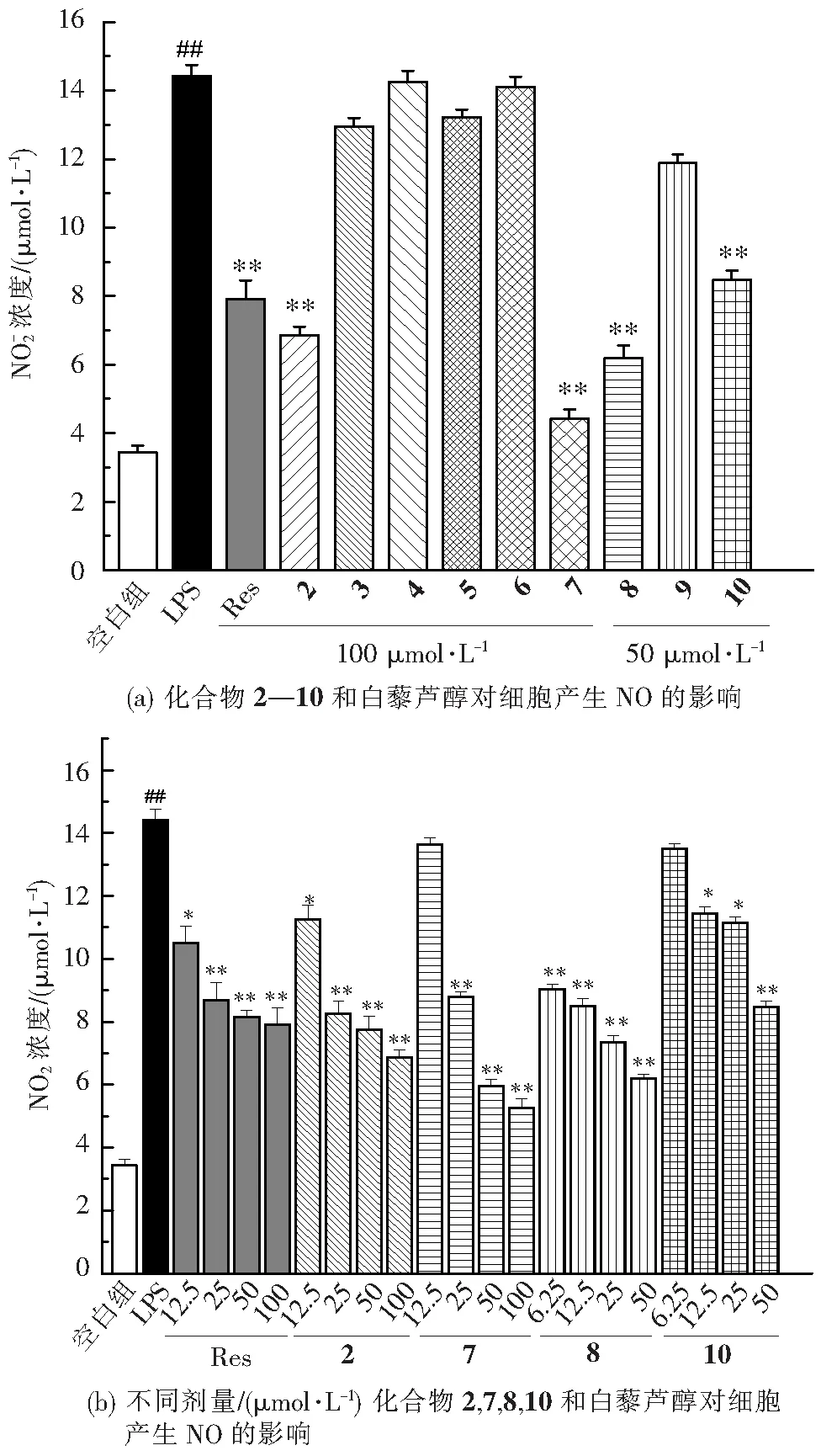
LPS与空白组相比,##P<0.01;给药组与LPS组相比,**P<0.01,*P<0.05。
根据抑制NO生成的初步筛选结果,对化合物2、7、8和10进一步研究(图5(b)),这些白藜芦醇酰胺衍生物皆表现出不同程度的NO抑制活性,并呈现一定剂量依赖关系。其中化合物8抑制活性最强,在6.25 μmol/L时对RAW 264.7 细胞中NO生成的抑制活性优于白藜芦醇,且与100 μmol/L吲哚美辛的抑制活性相当,值得进一步研究;而化合物2在12.5~100 μmol/L时抑制活性与白藜芦醇相当;化合物7和10分别在25和50 μmol/L时的抑制作用与100 μmol/L吲哚美辛相当。
2.4 COX-2抑制活性检测
以塞来昔布为阳性对照,考察了化合物2、7和8对COX-2酶的抑制活性(表1)。结果显示,化合物2和8对COX-2酶的抑制活性均强于白藜芦醇,化合物8活性最强,IC50值为0.09 μmol/L,约为白藜芦醇活性的10倍,与塞来昔布的活性相当。

表1 化合物2、7、8和白藜芦醇体外对COX-2酶的抑制 活性
2.5 分子对接
运用计算机模拟分子对接的方法,探索化合物2和8与COX-2酶之间可能的结合作用模式(图6)。据文献报道,由于COX-2酶在523位独特的Val残基,活性结合位点出现一个侧袋,这个口袋由His90、 Gln192、Leu352、Ser353、Tyr355、Arg513、Ala516、Phe518和Val523组成,主要是二芳基杂环类的COX-2选择性抑制剂的结合位点[25]。如图7,化合物2和8都可进入COX-2酶的活性结合位点,2-萘环结构和A环间位甲基可以插入到COX-2的侧袋中。化合物2(图7(a))与活性位点的结合以疏水相互作用为主。化合物8(图7(b))的B环对位羟基可以与启动环加氧酶反应的关键催化残基Tyr385形成氢键相互作用,此氢键作用有助于化合物8与COX-2酶的稳定结合。图7(b)中虚线为氢键,数值为键长。

图6 COX-2酶蛋白与化合物2和8的相互作用3D图

图7 COX-2酶蛋白与化合物2和8相互作用2D图
3 结 论
本研究对具有抗炎活性的白藜芦醇进行结构修饰,以酰胺键代替白藜芦醇中不稳定的双键结构,合成了9个白藜芦醇酰胺衍生物,均为已知化合物,通过研究其对LPS诱导RAW264.7细胞释放NO的抑制活性和COX-2酶抑制活性来探索白藜芦醇酰胺衍生物的抗炎活性以发现抗炎效果更好的化合物。活性结果显示,化合物2、7和8在LPS诱导的RAW 264.7 细胞中对NO的产生具有显著抑制作用,其中化合物8活性最强,在6.25 μmol/L时活性优于Res,且与100 μmol/L吲哚美辛的活性相当。进一步研究化合物2、7和8的COX-2酶抑制活性发现,化合物2和8与Res相比能显著抑制COX-2酶的活性,化合物8活性最强,IC50值为0.09 μmol/L,是白藜芦醇活性的10倍。以计算机模拟分子对接探索其相互作用,结果显示,化合物8的B环对位羟基可通过与关键残基Tyr385形成氢键与COX-2酶形成稳定结合。初步构效关系显示,B环对位羟基能显著提高白藜芦醇酰胺衍生物对LPS诱导RAW264.7细胞释放NO的抑制活性和COX-2酶的抑制作用。综上所述,对白藜芦醇进行结构修饰可以得到活性更强的衍生物,为进一步研究低毒高效新型抗炎药物提供物质基础。
