乙酰、丁酰胆碱酯酶双靶点抑制剂的设计、合成及活性评价
2022-06-30黄中威戴金莲孙昊鹏刘宗亮
黄中威,田 森,戴金莲,郭 燕,孙昊鹏,刘宗亮
(1.烟台大学药学院,分子药理和药物评价教育部重点实验室(烟台大学),新型制剂与生物技术药物研究山东省高校协同创新中心,山东 烟台 264005;2.中国药科大学药学院,江苏 南京 211198;3.江苏食品药品职业技术学院,江苏 淮安 223003)
阿尔茨海默症(Alzheimer's disease, AD)是一种病理机制复杂的神经退行性疾病,其主要病理机制尚未被完全阐明。AD的主要病症包括记忆丧失、认知功能障碍和精神、行为异常恶化[1-2]。AD不仅严重威胁着人类的生命健康,而且给患者带来沉重的精神和经济负担。目前上市的药物对AD未显示出显著的治疗效果,因此在AD治疗领域存在较大的未满足的临床需求。
现阶段较公认的AD的病理机制主要有胆碱酯能假说[3-4]、β淀粉样蛋白沉积假说[5-6]和Tau蛋白过度磷酸化假说[7-8]。根据胆碱酯能假说,在AD患者的中枢神经系统中,与学习、记忆和行为相关的胆碱酯能的损伤极为常见[9]。乙酰胆碱(acetylcholine, ACh)是一种负责将电信号从一个神经细胞传导到另一个神经细胞的神经递质,最终被乙酰胆碱酯酶(Acetylcholinesterase, AChE)快速水解,其浓度水平直接决定了AD的病程发展[10]。由于胆碱酯能系统在学习和记忆过程中发挥着不可替代的作用,因此现阶段上市的抗AD药物大多数为乙酰胆碱酯酶抑制剂(AChE Inhibitors, AChEIs),这类药物可以通过抑制ACh的水解,提高ACh的浓度水平,增强胆碱酯能作用,改善学习和认知能力,延缓AD的病程。目前经美国食品药品管理局(FDA)批准上市,用于治疗AD的AChEIs主要有他克林[11-12]、多奈哌齐[13-15]、利斯的明[15]和加兰他敏[15],但AChEIs在临床上治疗作用只限于AD轻中度病程[11,16-17]。
基于文献报道,胆碱酯酶主要包括AChE和丁酰胆碱酯酶(butyrylcholinesterase, BChE),两者均是抗AD药物开发的主要靶点[16]。研究表明,AD患者脑内ACh的浓度水平较正常人低10%~15%,AChE作为水解ACh的主要作用酶,利用AChEIs可降低AChE的活性,提升ACh的浓度水平,具有明显缓解轻中度AD患者病程的作用[18-19]。但当AD患者病程发展至中重度或长期使用AChEIs后,AChE的活性降低,进而造成AChEIs的治疗作用下降。此时BChE的活性代偿性升高,起到了主要水解ACh的作用,更进一步降低ACh的浓度水平并加重病情[20-22],此阶段BChEIs (BChE Inhibitors)比AChEIs在提高ACh浓度上更有优势。综上所述,理论上乙酰、丁酰胆碱酯酶双靶点抑制剂在治疗AD患者上将具有比AChEIs更长的响应时间和更优的治疗效果。
基于本课题组之前的研究,发现化合物G801-0274(eeAChE IC50=2.05 μmol/L, eqBChE IC50=0.03 μmol/L)[23]和化合物8i(eeAChE IC50=0.39 μmol/L, eqBChE IC50=0.28 μmol/L)[24]均具有抑制乙酰、丁酰胆碱酯酶双靶点的作用,缺点在于:前者的酶抑制作用缺乏均衡性,虽然针对BChE抑制活性很强但针对AChE的活性较弱;后者的双靶点酶抑制作用较均衡,但总体抑制活性并不理想。本研究通过针对G801-0274和8i的结构改造,合成了5个系列共21个化合物,同时,首先利用电鳗乙酰胆碱酯酶(eeAChE)和马血清丁酰胆碱酯酶(eqBChE)对所合成的化合物进行初步活性筛选,得到了对动物胆碱酯酶抑制活性较好的4a—4e,8a—8d,5a—5d和6d共14个化合物,进一步分别利用人源AChE (huAChE)和BChE (huBChE)进行了体外酶抑制活性测试,发现了一种新型乙酰、丁酰胆碱酯酶双靶点抑制剂5d(huAChE IC50=0.09 μmol/L, huBChE IC50=0.12 μmol/L)(图1),其具有酶抑制活性和均衡性均优于先导化合物的优点,有望进行进一步的研究并为寻找更强更优的乙酰、丁酰胆碱酯酶双靶点抑制剂奠定基础。
1 实验部分
1.1 仪器和试剂
胆碱酯酶eeAChE, eqBChE, huAChE和huBCh,均购自Sigma Aldrich。Mariner型质谱仪(美国Applied Biosystems公司);AV-300或AV-400型核磁共振仪(瑞士Bruker公司);柱层析硅胶采用200~300目(购自青岛海洋化工有限公司);薄层色谱采用硅胶HSGF254预涂板(购自青岛海洋化工有限公司);所有试剂均购自市售,除非另有说明,否则使用时未作任何进一步的纯化。
1.2 化合物设计
如图2所示,以化合物8i作为先导化合物,将其结构分为三部分,分别是苄基苯环(A环)、连接基团和苯并杂环部分(B环)。
针对A环改造的设计思想为:先导化合物G801-0274的构效关系表明,A环为苯并杂环这类大体积结构时,会因位阻排斥力,增大对huBChE的选择性,但未研究单一大体积取代基和取代基电性对酶抑制活性的影响,因此,在苯环不同位置处引入吸电子或给电子基团以考察电性因素对活性的影响;引入不同体积大小的取代基以考察空间位阻因素对活性的影响,以此,在邻、对位分别引入-OCH3、-CF3、-Cl取代基,以总结此区域的构效关系。
连接基团的修饰:为了研究连接基团对胆碱酯酶的影响,分别利用酰胺键与磺酰胺键作为连接基团,两者相较,其中酰胺分子体积相对较小,很有可能利于插入AChE活性结合峡谷中段的狭窄区域,但受N原子孤对电子所在p轨道与羰基形成p-π共轭的影响,C—N键旋转受阻,进而影响与活性口袋结合的优势构象的旋转;而磺酰胺键相对较易发生构象旋转,更易拥有低能量构象且易适应性结合活性位点。除此之外,磺酰胺键存在更多的氢键受体,更易与相应氨基酸残基形成氢键,加强与结合口袋的结合能力。因此,选用酰胺和磺酰胺作为连接基团,以实测活性选取最优连接基团。
针对B环改造的设计思想:先导化合物与胆碱酯酶结合模式结果表明[23],在活性位点结合峡谷底端存在大片疏水区域,因此在B环的结构改造中,利用一系列苯并六元环进行改造,引入疏水性作用力,增强化合物与胆碱酯酶活性位点的π-π堆积作用力和疏水性作用力,以达到增强结合能力的目的;同时,苯并六元环因其芳香性,理论上增加了化合物的脂水分配系数,增强化合物透过血脑屏障的能力,保证脑内化合物浓度。最终决定选用苯并呋喃、2-甲基喹啉、喹啉和萘对先导化合物进行改造。
1.3 化合物合成
如图3所示,本文合成化合物的初始原料均为4-氨甲基哌啶1,将1和三乙胺(Et3N)溶于DCM,在0 ℃下滴加Boc酸酐(Boc anhydride)得到化合物2。然后,将化合物2、化合物3a—3e和NaBH(OAc)3于常温条件下溶于1,2-二氯乙烷(DCE)中,搅拌48 h后用10%碳酸氢钠(sodium bicarbon-ate,NaHCO3)饱和水溶液淬灭,用DCM萃取后,合并收集有机相并在减压下浓缩,将反应残余物溶于DCM-三氟乙酸(TFA)(体积比为1∶1),搅拌2 h后,得到产物4—8,产物不经纯化即可用于下一步。如图3所示,将商业途径购得的化合物9—11、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCI)、1-羟基苯并三唑(HOBt)和4-二甲氨基吡啶(DMAP)溶于DCM或四氢呋喃(THF)中,搅拌30 min后分别加入中间体4—8,常温下继续搅拌6 h后得到目标化合物4a—4c,5a—5c,6a—6c,7a—7c和8a—8c。将化合物4—8分别与Et3N溶于DCM中,0℃下分别滴加配制的化合物12—13的DCM饱和溶液,继续搅拌8 h后得到目标化合物4d—4e,5d,6d,7d和8d。所有目标化合物的结构如图4所示,均经1H-NMR、13C-NMR和HR-MS确证。

图3 目标化合物4a—4e, 5a—5d, 6a—6d, 7a—7d和8a—8d的合成路线

图4 所有化合物的化学结构
N-((1-(2,6-二氯苄基)哌啶-4-基)-2-甲基喹啉-6-甲酰胺(4a)。(1-(2,6-二氯苄基)哌啶-4-基)甲胺 (103 mg, 0.55 mmol), EDCI (159 mg, 0.83 mmol), HOBt (112 mg, 0.83 mmol), DMAP (134 mg, 1.1 mmol), 2-甲基喹啉-6-羧酸 (9) (150 mg, 0.55 mmol)。白色固体, mp 156~158 ℃, 收率76%。1H NMR (400 MHz, Chloroform-d)δ8.24 (s, 1H), 8.09 (s, 1H), 7.99 (d,J=3.8 Hz, 3H), 7.30 (d,J=16.5 Hz, 3H), 7.11 (d,J=9.9 Hz, 1H), 3.75 (s, 2H), 3.37 (s, 2H), 2.97 (d,J=12.5 Hz, 2H), 2.75 (s, 3H), 2.30~2.17 (m, 2H), 1.73 (d,J=12.9 Hz, 3H), 1.37 (d,J=13.8 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ162.74, 137.46, 136.58, 130.15, 129.00, 128.55, 128.17, 127.91, 123.25, 56.80, 55.35, 53.46, 45.32, 36.24, 36.02, 31.21, 30.30, 25.45。 HRMS (ESI): calcd for C24H25Cl2N3O [M+H]+442.144 7, found 442.146 0。
N-((1-(2,6-二氯苄基)哌啶-4-基)甲基)苯并呋喃-5-甲酰胺(4b)。 (1-(2,6-二氯苄基)哌啶-4-基)甲胺 (100 mg, 0.36 mmol), EDCI(105.6 mg, 0.55 mmol), HOBt(74.4 mg, 0.55 mmol), DMAP(89.7 mg, 0.73 mmol), 苯并呋喃-5-羧酸 (10) (59.5 mg, 0.36 mmol)。 淡黄色固体, mp 113~115 ℃, 收率72%。1H NMR (300 MHz, DMSO-d6)δ8.52 (t,J=5.7 Hz, 1H), 8.17~8.05 (m, 2H), 7.83~7.66 (m, 2H), 7.51~7.41 (m, 2H), 7.33 (dd,J=8.8, 7.2 Hz, 1H), 7.03 (dd,J=2.2, 0.9 Hz, 1H), 3.65 (s, 2H), 3.15 (t,J=6.1 Hz, 2H), 2.80 (d,J=11.0 Hz, 2H), 2.13 (dd,J=12.1, 9.8 Hz, 2H), 1.65 (d,J=12.6 Hz, 2H), 1.12 (d,J=12.3 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.56, 154.37, 148.61, 136.57, 134.51,131.43,130.14,130.11,128.96,122.66,121.26,110.68,107.25,56.76,53.43,45.33,36.01,30.29。HRMS (ESI): calcd for C22H22Cl2N2O2[M+H]+417.113 1, found 417.113 7。
N-((1-(2,6-二氯苄基)哌啶-4-基)甲基)喹喔啉-6-甲酰胺 (4c)。 (1-(2,6-二氯苄基)哌啶-4-基)甲胺 (191 mg, 1.1 mmol), EDCI(316 mg, 1.65 mmol), HOBt(222 mg, 1.62 mmol), DMAP(268 mg, 2.2 mmol), 喹喔啉-6-羧酸 (11) (268 mg, 2.2 mmol)。 淡黄色固体, mp 177~179 ℃, 收率80%。1H NMR (300 MHz, Chloroform-d)δ8.96 (s, 2H), 8.50~8.43 (m, 1H), 8.32~8.17 (m, 2H), 7.34 (d,J=7.9 Hz, 2H), 7.23~7.12 (m, 1H), 3.78 (s, 2H), 3.46 (t,J=6.1 Hz, 2H), 3.06~2.96 (m, 2H), 2.28 (dd,J=12.4, 10.1 Hz, 2H), 1.80~1.62 (m, 3H), 1.50~1.25 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ165.69, 147.25, 146.97, 142.07, 136.55, 136.15, 134.50, 130.05, 129.64, 129.10, 128.93, 128.58, 56.75, 53.41, 45.47, 35.96, 30.30。 HRMS (ESI): calcd for C22H22Cl2N4O [M+H]+429.124 3, found 429.124 0。
N-((1-(2,6-二氯苄基)哌啶-4-基)甲基)萘-2-磺酰胺 (4d)。 (1-(2,6-二氯苄基)哌啶-4-基)甲胺 (150 mg, 0.55 mmol), Et3N (100 mg, 0.99 mmol), 萘-2-磺酰氯 (12) (162 mg, 0.715 mmol)。 淡黄色固体, mp 121-123 ℃, 收率89%。1H NMR (300 MHz, Chloroform-d)δ8.47 (d,J=1.8 Hz, 1H), 8.05~7.81 (m, 4H), 7.67 (tt,J=7.0, 5.3 Hz, 2H), 7.33 (d,J=0.9 Hz, 2H), 7.16 (dd,J=8.7, 7.3 Hz, 1H), 3.76 (s, 2H), 3.00~2.82 (m, 4H), 2.20 (t,J=11.4 Hz, 2H), 1.72~1.46 (m, 3H), 1.33~1.18 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ138.12, 136.61, 134.53, 132.19, 130.21, 129.77, 129.59, 129.02, 128.99, 128.25, 127.95, 127.72, 122.76, 56.57, 53.21, 48.37, 35.81, 29.75。 HRMS (ESI): calcd for C23H24Cl2N2O2S [M+H]+463.100 8, found 463.101 9。
N-((1-(2,6-二氯苄基)哌啶-4-基)甲基)-4-甲基苯磺酰胺(4e)。 (1-(2,6-二氯苄基)哌啶-4-基)甲胺 (150 mg, 0.55 mmol), Et3N (100 mg, 0.99 mmol), 4-甲基苯磺酰氯 (13) (136 mg, 0.715 mmol)。 黄色固体, mp 114~116 ℃, 收率90%。1H NMR (300 MHz, Chloroform-d)δ8.47 (d,J=1.8 Hz, 1H), 8.05~7.81 (m, 4H), 7.67 (tt,J=7.0, 5.3 Hz, 2H), 7.33 (d,J=0.9 Hz, 2H), 7.16 (dd,J=8.7, 7.3 Hz, 1H), 3.76 (s, 2H), 3.00~2.82 (m, 4H), 2.20 (t,J=11.4 Hz, 2H), 1.72~1.46 (m, 3H), 1.33~1.18 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ142.86, 138.23, 136.62, 130.01, 129.02, 126.95, 56.62, 53.25, 48.37, 35.77, 29.83, 21.41。HRMS (ESI): calcd for C20H24Cl2N2O2S[M+H]+427.100 8, found 427.101 7。
N-((1-(2-氯苄基)哌啶-4-基)甲基)-2-甲基喹啉-6-甲酰胺 (5a)。 (1-(2-氯苄基)哌啶-4-基)甲胺 (150 mg, 0.63 mmol), EDCI (180 mg, 0.94 mmol), HOBt (127 mg, 0.94 mmol), DMAP (153 mg, 1.26 mmol), 2-甲基喹啉-6-羧酸 (9) (117 mg, 0.63 mmol)。 白色固体, mp 145~146 ℃, 收率72%。1H NMR (400 MHz, Chloroform-d)δ8.30 (d,J=1.9 Hz, 1H), 8.20~8.00 (m, 3H), 7.52 (dd,J=7.4, 2.0 Hz, 1H), 7.43~7.36 (m, 2H), 7.29~7.18 (m, 2H), 3.66 (s, 2H), 3.47 (t,J=6.2 Hz, 2H), 3.00 (d,J=11.3 Hz, 2H), 2.81 (s, 3H), 2.14 (qd,J=13.1, 12.4, 4.5 Hz, 4H), 1.88~1.67 (m, 3H), 1.56~1.36 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.43, 160.82, 137.44, 136.49, 133.64, 132.13, 131.05, 129.60, 128.82, 128.59, 128.19, 127.95, 127.38, 125.80, 123.24, 59.38, 53.58, 45.41, 36.13, 30.36, 25.45。 HRMS (ESI): calcd for C24H26ClN3O [M+H]+408.183 7, found 408.184 2。
N-((1-(2-氯苄基)哌啶-4-基)甲基)苯并呋喃-5-甲酰胺 (5b)。 (1-(2-氯苄基)哌啶-4-基)甲胺 (100 mg, 0.42 mmol), EDCI (120 mg, 0.63 mmol), HOBt (85 mg, 0.63 mmol), DMAP (102 mg, 0.83 mmol), 苯并呋喃-5-羧酸(10) (68 mg, 0.42 mmol)。 淡黄色固体, mp 108~110 ℃, 收率79%。1H NMR (400 MHz, Chloroform-d)δ7.95 (s, 1H), 7.72 (s, 1H), 7.62 (s, 2H), 7.48 (d,J=7.6 Hz, 1H), 7.32 (d,J=7.9 Hz, 1H), 7.20 (d,J=19.3 Hz, 2H), 6.80 (s, 1H), 3.61 (s, 2H), 3.39 (d,J=9.5 Hz, 2H), 2.94 (d,J=11.4 Hz, 2H), 2.10 (t,J=11.6 Hz, 2H), 1.78~1.64 (m, 3H), 1.40 (q,J=13.0, 12.4 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.56, 154.37, 148.65, 136.53, 133.63, 131.44, 131.06, 130.15, 129.61, 128.84, 127.40, 122.67, 121.29, 110.68, 107.27, 59.39, 53.59, 45.39, 36.13, 30.36。 HRMS (ESI): calcd for C22H23ClN2O2[M+H]+383.152 1, found 383.151 9。
N-((1-(2-氯苄基)哌啶-4-基)甲基)喹喔啉-6-甲酰胺 (5c)。 (1-(2-氯苄基)哌啶-4-基)甲胺 (200 mg, 0.84 mmol), EDCI (241 mg, 1.26 mmol), HOBt (170 mg, 1.26 mmol), DMAP (205 mg, 1.68 mmol), 喹喔啉-6-羧酸 (11) (146 mg, 0.84 mmol)。 淡黄色固体, mp 165~166 ℃, 收率76%。1H NMR (400 MHz, Chloroform-d)δ8.90 (s, 2H), 8.41 (s, 1H), 8.20 (s, 2H), 7.40 (d,J=57.3 Hz, 2H), 7.24~7.11 (m, 2H), 3.60 (s, 2H), 3.44 (s, 2H), 2.94 (d,J=9.7 Hz, 2H), 2.10 (d,J=2.4 Hz, 2H), 1.71 (dd,J=42.1, 17.3 Hz, 3H), 1.41 (d,J=15.0 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ165.72, 147.25, 146.97, 142.07, 136.50, 136.16, 133.62, 130.99, 129.65, 129.56, 129.11, 128.76, 128.60, 127.33, 59.38, 53.56, 45.54, 36.06, 30.36。 HRMS (ESI): calcd for C22H23ClN4O [M+H]+395.163 3, found 395.163 4。
N-((1-(2-氯苄基)哌啶-4-基)甲基)萘-2-磺酰胺 (5d)。 (1-(2-氯苄基)哌啶-4-基)甲胺 (150 mg, 0.63 mmol), Et3N (114 mg, 1.13 mmol), 萘-2-磺酰氯 (12) (185 mg, 0.819 mmol)。 淡黄色固体, mp 112~114 ℃, 收率92%。1H NMR (400 MHz, Chloroform-d)δ8.42 (s, 1H), 7.97~7.81 (m, 4H), 7.62 (s, 2H), 7.47 (s, 1H), 7.31 (d,J=8.1 Hz, 1H), 7.23~7.13 (m, 2H), 3.62 (s, 2H), 2.88 (dd,J=17.7, 9.8 Hz, 4H), 2.05 (d,J=14.4 Hz, 2H), 1.66 (d,J=12.9 Hz, 2H), 1.27 (d,J=14.8 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ138.14, 134.55, 133.74, 131.22, 129.78, 129.62, 129.59, 129.03, 128.26, 127.96, 127.73, 127.38, 122.77, 59.11, 53.25, 48.46, 35.88, 29.74。 HRMS (ESI): calcd for C23H25ClN2O2S [M+H]+429.139 8, found 429.139 5。
N-((1-(4-甲氧基苄基)哌啶-4-基)甲基)-2-甲基喹啉-6-甲酰胺 (6a)。 (1-(4-甲氧基苄基)哌啶-4-基)甲胺 (70 mg, 0.3 mmol), EDCI (84 mg, 0.44 mmol), HOBt (59 mg, 0.44 mmol), DMAP (73 mg, 0.6 mmol), 2-甲基喹啉-6-羧酸 (9) (56 mg, 0.3 mmol)。 白色固体, mp 151~153 ℃, 收率72%。1H NMR (300 MHz, DMSO-d6)δ8.69 (t,J=5.7 Hz, 1H), 8.43 (d,J=1.9 Hz, 1H), 8.34 (d,J=8.4 Hz, 1H), 8.11 (dd,J=8.8, 2.0 Hz, 1H), 7.95 (d,J=8.8 Hz, 1H), 7.49 (d,J=8.4 Hz, 1H), 7.19 (d,J=8.5 Hz, 2H), 6.93~6.81 (m, 2H), 3.73 (s, 3H), 3.20 (t,J=6.2 Hz, 2H), 2.80 (d,J=11.2 Hz, 2H), 2.68 (s, 3H), 1.88 (t,J=9.8 Hz, 2H), 1.63 (dd,J=31.2, 10.8 Hz, 3H), 1.28~1.11 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.44, 158.66, 148.75, 137.45, 132.13, 130.60, 130.46, 128.59, 128.19, 127.95, 125.80, 123.24, 113.91, 62.20, 55.39, 53.23, 45.42, 36.21, 30.22, 25.43。 HRMS (ESI): calcd for C25H29N3O2[M+H]+404.233 3, found 404.233 7。
N-((1-(4-甲氧基苄基)哌啶-4-基)甲基)苯并呋喃-5-甲酰胺 (6b)。 (1-(4-甲氧基苄基)哌啶-4-基)甲胺 (100 mg, 0.42 mmol), EDCI (122 mg, 0.64 mmol), HOBt (86 mg, 0.64 mmol), DMAP (102 mg, 0.84 mmol), 苯并呋喃-5-羧酸(10) (69 mg, 0.4 mmol)。 淡黄色固体, mp 113~115 ℃, 收率78%。1H NMR (400 MHz, Chloroform-d)δ8.07 (s, 1H), 7.75 (dd,J=8.1, 1.4 Hz, 1H), 7.67 (d,J=2.2 Hz, 1H), 7.55 (d,J=8.1 Hz, 1H), 7.45 (d,J=8.5 Hz, 2H), 6.86 (d,J=8.7 Hz, 2H), 6.75 (dd,J=2.2, 0.9 Hz, 2H), 4.07 (s, 2H), 3.77 (s, 3H), 3.39 (d,J=22.5 Hz, 3H), 2.90 (d,J=29.7 Hz, 2H), 1.99 (d,J=29.6 Hz, 5H), 1.24 (s, 1H)。13C NMR (75 MHz, DMSO-d6)δ166.73, 160.26, 154.34, 148.72, 133.08, 131.25, 130.24, 122.81, 122.70, 121.33, 114.45, 110.75, 107.29, 55.64, 55.37, 51.13, 44.23, 34.12, 26.97。 HRMS (ESI): calcd for C23H26N2O3[M+H]+379.201 6, found 379.203 4。
N-((1-(4-甲氧基苄基)哌啶-4-基)甲基)喹喔啉-6-甲酰胺(6c)。 (1-(4-甲氧基苄基)哌啶-4-基)甲胺 (70 mg, 0.3 mmol), EDCI (84 mg, 0.44 mmol), HOBt (59 mg, 0.44 mmol), DMAP (73 mg, 0.60 mmol), 喹喔啉-6-羧酸 (11) (52 mg, 0.3 mmol)。 白色固体, mp 161~162 ℃, 收率72%。1H NMR (300 MHz, Chloroform-d)δ8.95 (s, 2H), 8.48 (d,J=1.9 Hz, 1H), 8.32~8.16 (m, 2H), 7.28 (d,J=8.6 Hz, 2H), 6.90 (d,J=8.6 Hz, 2H), 3.84 (s, 3H), 3.57~3.42 (m, 4H), 3.00 (d,J=11.5 Hz, 3H), 2.13~1.98 (m, 2H), 1.90~1.65 (m, 3H), 1.59~1.34 (m, 2H)。13C NMR (75 MHz, DMSO-d6)δ165.74, 158.63, 147.29, 147.01, 142.06, 136.17, 130.58, 130.44, 129.67, 129.11, 128.58, 113.90, 62.19, 55.39, 53.21, 45.52, 36.12, 30.20。 HRMS (ESI): calcd for C23H26N4O2[M+H]+391.212 9, found 391.214 2。
N-((1-(4-甲氧基苄基)哌啶-4-基)甲基)萘-2-磺酰胺 (6d)。 (1-(4-甲氧基苄基)哌啶-4-基)甲胺 (70 mg, 0.3 mmol), Et3N (54 mg, 0.54 mmol), 萘-2-磺酰氯 (12) (86 mg, 0.38 mmol)。 白色固体, mp 120~121 ℃, 收率90%。1H NMR (300 MHz, Chloroform-d)δ8.52~8.44 (m, 1H), 8.06~7.83 (m, 4H), 7.76~7.60 (m, 2H), 7.26 (d,J=8.6 Hz, 3H), 6.94~6.83 (m, 2H), 3.84 (s, 3H), 3.52 (s, 2H), 2.92 (dt,J=12.6, 5.7 Hz, 4H), 1.99 (t,J=11.5 Hz, 2H), 1.70 (d,J=12.8 Hz, 2H), 1.63~1.45 (m,J=27 Hz, 1H), 1.34 (dd,J=21.3, 9.8 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ158.79, 138.11, 134.54, 132.19, 130.69, 129.79, 129.61, 129.07, 128.26, 127.98, 127.72, 122.76, 113.96, 61.78, 55.42, 52.80, 48.43, 35.91, 29.50。 HRMS (ESI): calcd for C24H28N2O3S [M+H]+425.189 3, found 425.190 5。
2-甲基-N-((1-(4-(三氟甲基)苄基)哌啶-4-基)甲基)喹啉-6-甲酰胺 (7a)。 (1-(4-(三氟甲基)苄基)哌啶-4-基)甲胺 (100 mg, 0.36 mmol), EDCI (105 mg, 0.55 mmol), HOBt (74 mg, 0.55 mmol), DMAP (88 mg, 0.72 mmol), 2-甲基喹啉-6-羧酸 (9) (67 mg, 0.36 mmol)。 亮黄色固体, mp 146~147 ℃, 收率82%。1H NMR (300 MHz, Chloroform-d)δ8.30 (d,J=1.9 Hz, 1H), 8.20~7.98 (m, 3H), 7.61 (d,J=8.0 Hz, 2H), 7.44 (dd,J=26.1, 8.2 Hz, 3H), 3.59 (s, 2H), 3.47 (t,J=6.2 Hz, 2H), 2.94 (d,J=11.3 Hz, 2H), 2.82 (s, 3H), 2.05 (td,J=11.6, 2.3 Hz, 2H), 1.86~1.65 (m, 3H), 1.46 (td,J=12.0, 3.8 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.44, 144.20, 137.46, 129.67, 128.58, 128.17, 127.93, 125.80, 125.44, 123.26, 62.11, 53.44, 45.38, 36.11, 30.28, 25.41。 HRMS (ESI): calcd for C23H26N4O2[M+H]+442.210 1, found 442.209 7。
N-((1-(4-(三氟甲基)苄基)哌啶-4-基)甲基)苯并呋喃-5-甲酰胺 (7b)。 (1-(4-(三氟甲基)苄基)哌啶-4-基)甲胺 (100 mg, 0.36 mmol), EDCI (105 mg, 0.55 mmol), HOBt (74 mg, 0.55 mmol), DMAP (88 mg, 0.72 mmol), 苯并呋喃-5-羧酸(10) (59 mg, 0.36 mmol)。 白色固体, mp 110~112 ℃, 收率80%。1H NMR (300 MHz, Chloroform-d)δ8.01 (q,J=1.1 Hz, 1H), 7.77 (d,J=2.2 Hz, 1H), 7.71~7.56 (m, 4H), 7.48 (d,J=8.0 Hz, 2H), 6.86 (dd,J=2.2, 1.0 Hz, 1H), 3.59 (s, 2H), 3.44 (t,J=6.3 Hz, 2H), 2.93 (d,J=11.5 Hz, 2H), 2.05 (td,J=11.6, 2.3 Hz, 2H), 1.80~1.64 (m, 3H), 1.42 (qd,J=11.9, 3.9 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ154.39, 148.64, 144.29, 131.45, 129.65, 125.44, 122.68, 121.28, 110.69, 107.26, 62.14, 53.46, 45.39, 36.13, 30.32。 HRMS (ESI): calcd for C23H23F3N2O2[M+H]+417.178 4, found 417.178 3。
N-((1-(4-(三氟甲基)苄基)哌啶-4-基)甲基)喹喔啉-6-甲酰胺 (7c)。 (1-(4-(三氟甲基)苄基)哌啶-4-基)甲胺 (100 mg, 0.36 mmol), EDCI (105 mg, 0.55 mmol), HOBt (74 mg, 0.55 mmol), DMAP (88 mg, 0.72 mmol), 喹喔啉-6-羧酸 (11) (63 mg, 0.36 mmol)。 白色固体, mp 162~163 ℃, 收率85%。1H NMR (300 MHz, Chloroform-d)δ8.96 (s, 2H), 8.51~8.43 (m, 1H), 8.32~8.18 (m, 2H), 7.61 (d,J=8.1 Hz, 2H), 7.49 (d,J=8.0 Hz, 2H), 3.60 (s, 2H), 3.49 (t,J=6.2 Hz, 2H), 2.95 (d,J=11.0 Hz, 2H), 2.06 (td,J=11.7, 2.3 Hz, 2H), 1.45 (qd,J=11.8, 11.4, 3.8 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ165.71, 147.31, 147.03, 144.27, 142.06, 136.17, 129.64, 129.10, 128.56, 125.40, 62.13, 53.45, 45.51, 36.06, 30.31。 HRMS (ESI): calcd for C23H23F3N4O [M+H]+429.189 7, found 429.189 7。
N-((1-(4-(三氟甲基)苄基)哌啶-4-基)甲基)萘-2-磺酰胺 (7d)。 (1-(4-(三氟甲基)苄基)哌啶-4-基)甲胺 (100 mg, 0.36 mmol), Et3N (65 mg, 0.64 mmol), 萘-2-磺酰氯 (12) (106 mg, 0.47 mmol)。 白色固体, mp 125~127 ℃, 收率88%。1H NMR (400 MHz, Chloroform-d)δ8.43 (s, 1H), 8.02~7.87 (m, 3H), 7.83 (d,J=8.6 Hz, 1H), 7.62 (s, 2H), 7.53 (d,J=7.9 Hz, 2H), 7.40 (d,J=7.9 Hz, 2H), 3.52 (s, 2H), 2.84 (d,J=7.1 Hz, 4H), 1.94 (s, 1H), 1.65 (d,J=12.8 Hz, 2H), 1.49 (s, 1H), 1.23 (d,J=10.1 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ144.12, 138.15, 134.55, 132.21, 129.78, 129.67, 129.03, 128.25, 127.96, 127.73, 125.46, 122.76, 61.96, 53.18, 48.50, 35.98, 29.82。 HRMS (ESI): calcd for C24H25F3N2O2S [M+H]+463.166 2, found 463.165 9。
N-((1-苄基哌啶-4-基)甲基)-2-甲基喹啉-6-甲酰胺 (8a)。 (1-苄基哌啶-4-基)甲胺 (100 mg, 0.49 mmol), EDCI (141 mg, 0.74 mmol), HOBt (100 mg, 0.74 mmol), DMAP (120 mg, 0.98 mmol), 2-甲基喹啉-6-羧酸 (9) (91 mg, 0.49 mmol)。 黄色固体, mp 133~135 ℃, 收率82%。1H NMR (300 MHz, DMSO-d6)δ8.71 (t,J=5.7 Hz, 1H), 8.46 (d,J=2.0 Hz, 1H), 8.36 (d,J=8.4 Hz, 1H), 8.14 (dd,J=8.8, 2.0 Hz, 1H), 7.98 (d,J=8.8 Hz, 1H), 7.51 (d,J=8.5 Hz, 1H), 7.42~7.22 (m, 5H), 3.56 (s, 2H), 3.23 (d,J=6.1 Hz, 2H), 2.95~2.84 (m, 2H), 2.71 (s, 3H), 2.04 (t,J=11.4 Hz, 2H), 1.79~1.56 (m, 3H), 1.27 (q,J=15.3, 13.4 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.48, 160.90, 148.73, 137.47, 132.07, 129.85, 128.72, 128.58, 128.18, 127.96, 127.92, 125.80, 123.29, 61.92, 52.86, 45.08, 35.60, 29.36, 25.43。 HRMS (ESI): calcd for C24H27N3O [M+H]+374.222 7, found 374.222 8。
N-((1-苄基哌啶-4-基)甲基)苯并呋喃-5-甲酰胺 (8b)。 (1-苄基哌啶-4-基)甲胺 (100 mg, 0.49 mmol), EDCI (141 mg, 0.74 mmol), HOBt (100 mg, 0.74 mmol), DMAP (120 mg, 0.98 mmol), 苯并呋喃-5-羧酸(10) (79 mg, 0.49 mmol)。 黄色固体, mp 101~103 ℃, 收率80%。1H NMR (400 MHz, Chloroform-d)δ7.95 (s, 1H), 7.71 (d,J=2.2 Hz, 1H), 7.62 (d,J=1.3 Hz, 1H), 7.61 (s, 1H), 7.37~7.26 (m, 5H), 6.79 (dd,J=2.0, 0.8 Hz, 1H), 3.62 (s, 2H), 3.37 (d,J=6.2 Hz, 2H), 3.00 (d,J=11.5 Hz, 2H), 2.10 (d,J=12.4 Hz, 2H), 1.78 (d,J=13.6 Hz, 3H), 1.51 (t,J=12.4 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ166.65, 154.34, 148.76, 131.29, 131.16, 130.22, 129.22, 129.06, 126.94, 124.56, 122.69, 121.33, 110.72, 110.38, 107.30。 HRMS (ESI): calcd for C22H24N2O2[M+H]+349.191 1, found 349.191 0。
N-((1-苄基哌啶-4-基)甲基)喹喔啉-6-甲酰胺 (8c)。 (1-苄基哌啶-4-基)甲胺 (100 mg, 0.49 mmol), EDCI (141 mg, 0.74 mmol), HOBt (100 mg, 0.74 mmol), DMAP (120 mg, 0.98 mmol), 喹喔啉-6-羧酸 (11) (85 mg, 0.49 mmol)。 白色固体, mp 138~140 ℃, 收率83%。1H NMR (400 MHz, Chloroform-d)δ8.87 (s, 2H), 8.44 (s, 1H), 8.19 (s, 1H), 8.14 (s, 1H), 7.30 (d,J=16.4 Hz, 5H), 3.59 (s, 2H), 3.41 (s, 2H), 3.03~2.87 (m, 2H), 2.08 (t,J=11.7 Hz, 2H), 1.84~1.67 (m, 3H), 1.49 (q,J=12.9 Hz, 2H)。13C NMR (75 MHz, DMSO-d6)δ165.85, 162.76, 147.32, 147.03, 143.74, 134.56, 130.47, 129.69, 129.07, 128.85, 128.61, 128.55, 125.39, 123.81, 118.98, 110.81, 61.01, 52.30, 44.87, 36.20, 34.96, 31.18, 28.46。 HRMS (ESI): calcd for C22H24N4O [M+H]+361.202 3, found 361.202 3。
N-((1-苄基哌啶-4-基)甲基)萘-2-磺酰胺 (8d)。 (1-苄基哌啶-4-基)甲胺 (100 mg, 0.49 mmol), Et3N (95 mg, 0.88 mmol), 萘-2-磺酰氯 (12) (144 mg, 0.63 mmol)。 淡黄色固体, mp 120~122 ℃, 收率95%。1H NMR (400 MHz, Chloroform-d)δ8.43 (s, 1H), 7.97~7.85 (m, 4H), 7.66~7.55 (m, 2H), 7.31 (d,J=25.6 Hz, 5H), 3.83~2.94 (m, 4H), 2.84 (s, 2H), 1.76~1.18 (m, 6H), 0.86 (dd,J=12.8, 5.5 Hz, 1H)。13C NMR (75 MHz, DMSO-d6)δ172.53, 138.00, 134.56, 132.18, 130.52, 129.84, 129.61, 129.12, 128.91, 128.65, 128.28, 128.02, 127.93, 127.73, 124.38, 122.71, 60.84, 60.23, 52.08, 47.87, 34.87, 28.00, 21.55, 14.53。 HRMS (ESI): calcd for C23H26N2O2S [M+H]+395.178 8, found 395.178 8。
1.4 体外酶抑制活性评价
称取13.6 g磷酸二氢钾溶于1 L水,以氢氧化钾调节pH=8.0±0.1于4 ℃温度下保存备用。将受试物溶于DMSO配制成浓度为10-2mol/L的溶液,用MeOH稀释到浓度分别为10-3、10-4、10-5、10-6、10-7、10-8mol/L的溶液备用。将500单位的AChE/BChE溶于1 mL 1%的凝胶溶液中,用水稀释至100 mL,得到浓度为5 U/mL的AChE/BChE溶液,于-30 ℃温度下保存备用。称取0.217 g ATC/0.237 g BTC溶于10 mL水中得到0.075 mol/L ATC/BTC溶液,于-30 ℃温度下保存备用。将0.396 g DTNB及0.15 g碳酸氢钠溶于100 mL水,得到0.01 mol/L DTNB溶液,于-30 ℃温度下保存备用。
将所有用到的溶液升温至室温,酶溶液稀释至2.5单位/mL,DTNB稀释至0.001 5 mol/L,底物溶液稀释至0.15单位/mL。在96孔酶标板中依次加入40 μL缓冲溶液、10 μL受试物、10 μL酶溶液、20 μL DTNB溶液、20 μL底物溶液,由于设置了不同的受试物浓度:0(阴性组,以10 μL MeOH代替10 μL受试物溶液)、10-3、10-4、10-5、10-6、10-7、10-8mol/L共7组反应体系,每种反应体系平行做3个复孔,另设置空白组(20 μL DTNB溶液和80 μL缓冲溶液)。加入底物后,反应迅速进行,约2 min后,在405 nm的波长处测量吸光度并记录测量值,以阴性组的读数为100%,计算受试物在不同浓度下的抑制率,所得抑制率在GraphPad Prism6.0软件中以非线性衰退分析模式进行计算,得到IC50值。
1.5 分子对接
为了进一步研究化合物5d与huAChE和huBChE的结合模式,借助Discovery Studio 2018(DS 2018, Biovia San Diego, CA, USA)软件的CDOCKER功能,研究化合物5d与huAChE(PDB:4EY7)和huBChE(PDB: 4TPK)活性位点的结合模式。huAChE和huBChE的晶体结构均是从结构生物信息学研究协作组织(RCSB)的蛋白质数据库(PDB)获得。文献研究表明[23, 25],AChE的主要结合位点是由Tyr341、Tyr337、His447、Trp86、Glu202、Ser203、Phe295和Trp286环绕而成的哑铃型结合口袋[11];BChE的主要结合位点是由Val288、Leu286、Trp231、Ser198、His438、Trp82和Asp70环绕而成的浅V字型结合口袋[25]。通过DS中的“prepare protein”功能对这三种蛋白质结构进行预处理以提供适合于对接的结构。通过“defined binding site”将上述氨基酸残基确定为活性结合位点(半径为1.2 nm)。小分子配体是通过DS中的“prepare ligand”模块处理所得的最优能量结构,然后用DS 2018中编码的对接程序CDOCKER程序将目标化合物与蛋白活性位点进行对接,运行程序后得到结合模式结果,并通过结合模式结果可以分析出配体与huAChE和huBChE活性位点之间的相互作用方式。
2 结果与讨论
2.1 目标物的合成
关于实验反应条件的探究,针对由化合物1合成化合物2,因为初始化合物含有两个氨基位点可与Boc酸酐反应,所以在Boc保护的基础条件(即碱性条件)下加入Boc酸酐,我们将整个反应体系置于0 ℃的条件下且滴加Boc酸酐,加上伯胺反应活性强于仲胺,最终得到以目标位点Boc保护的化合物为主要产物。在分离过程中,碱性基团与酸性硅胶填充物结合能力较强,故选用碱性Al2O3作为填充材料进行柱层析色谱分离操作。
针对由化合物2合成化合物4—8,使用温和的三乙酰氧基硼氢化钠(Sodium triacetoxyborohydride,NaBH(OAc)3)作为主要反应试剂。由于1, 2-二氯乙烷对NaBH(OAc)3溶解性较好,将其确定为溶剂。初始反应时间分别为24 h、48 h和72 h,同时利用TLC监测反应物浓度,最终确定48 h反应较为完全。
针对由化合物4—8合成化合物4a—4c,5a—5c,6a—6c,7a—7c和8a—8c,酰胺缩合剂的种类繁多,经多次实验,反应缩合剂N,N'-羰基二咪唑(CDI)会在反应完成后产生咪唑类杂质,反应缩合剂二环己基碳二亚胺(DCC)会产生无荧光杂质二环己基脲(DCU),上述两种缩合剂的杂质均不易除去。反应缩合剂2-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)或六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBop)的活性均过强,虽反应较快,但反应杂质过多,不易分离最终产物。最终确定条件为EDCI反应体系,反应后处理简单,反应活性较强,产物易分离。
2.2 体外酶抑制活性与抑制均衡性评价
Ellman法初步评价目标化合物4a—4e,5a—5d,6a—6d,7a—7d和8a—8d对eeAChE和eqBChE的体外酶抑制活性,筛选出了酶抑制活性较好的14个化合物,进一步评价化合物4a—4e,5a—5d,8a—8d与6d对huAChE和huBChE的体外酶抑制活性;利用Chemdraw针对各个化合物的Log P进行预测,初步预测各化合物的脂溶性;利用SI(选择性指数)评价各个化合物对双靶点酶抑制作用的均衡性,所得所有数据如表1所示。化合物5d和8d对huAChE和huBChE均展现出了较优秀的抑制活性,其中5d的抑制活性最强 (huAChE IC50=0.09 μmol/L, huBChE IC50=0.12 μmol/L)。除此之外,4d,5b和6d对BChE的抑制活性,5a和5c对AChE的抑制活性均有较好的表现 (IC50< 0.5 μmol/L),均可作为基础结构骨架进行ChEIs的结构修饰。分析log P预测数值可见,所合成的化合物脂溶性明显优于先导化合物G801-0274,理论上5d可更好地透过血脑屏障,保证脑内的化合物治疗浓度。化合物5d的SI值为0.80,而先导化合物的SI值为152.5,就针对双靶点抑制作用效果而言,化合物5d针对双靶点的抑制均衡性明显优于先导化合物。
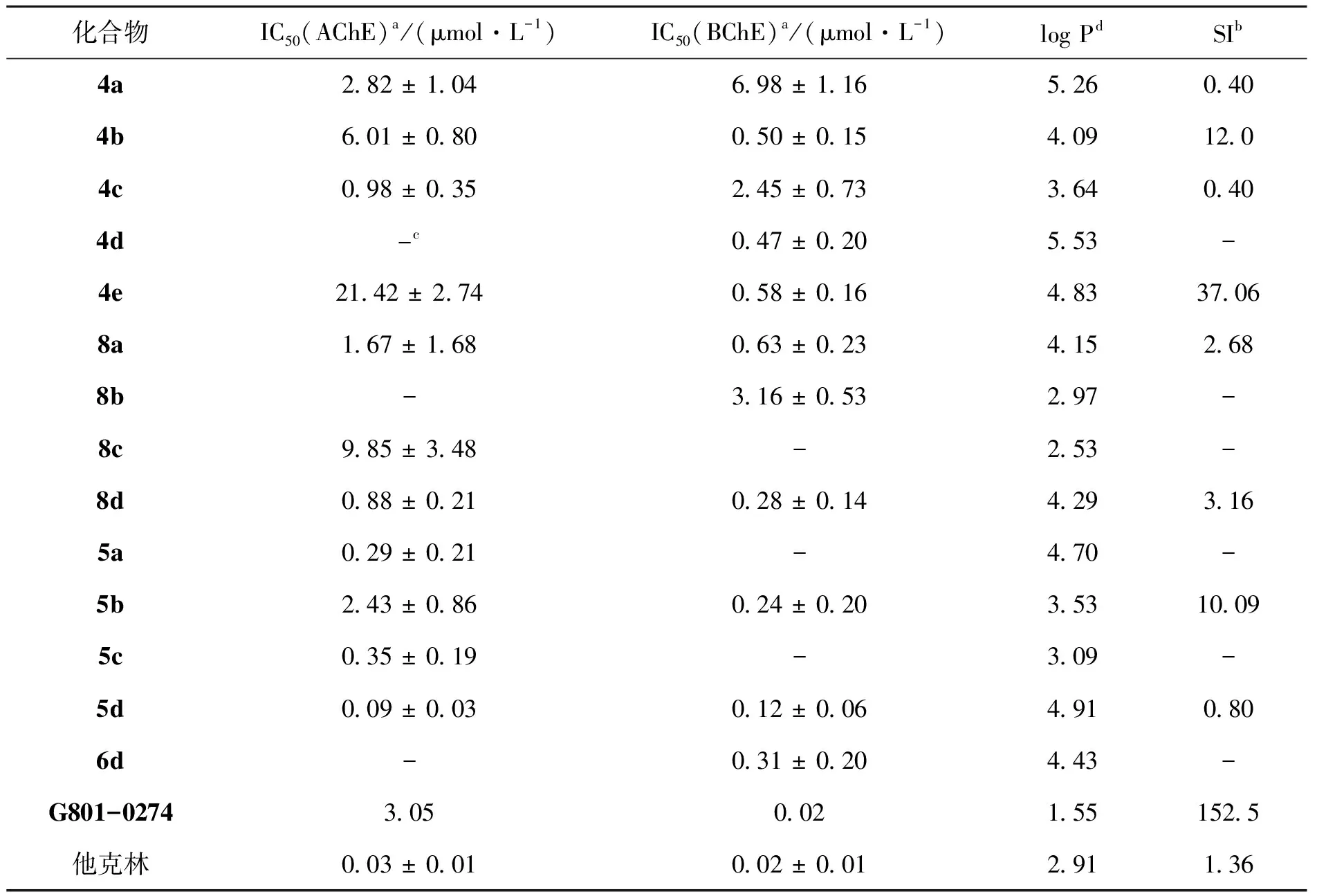
表1 目标化合物对huAChE和huBChE的抑制活性
2.3 初步分子对接结合模式预测
为进一步研究化合物5d与ChEs的结合模式,使用DS 2018进行了分子对接模型预测。化合物5d与AChE的预测结合模式如图5(a)所示。结果表明,5d可与huAChE的活性口袋进行结合,在5d和huAChE的结合模式中,苯环部分可分别与Ser293和Val294形成π-π堆积作用和π-烷基相互作用,哌啶环可与Phe338和Tyr341形成π-烷基相互作用,磺酰胺上的氧原子可与Tyr341和Tyr124形成氢键,Tyr124同样可以与磺酰胺的α-H形成范德华作用力,除此之外,萘环部分可与Trp86形成π-π堆积作用。
化合物5d与huBChE的活性位点的结合模式如图5(b)所示,化合物5d的苯环部分可分别与Leu286和Trp231形成π-烷基相互作用和π-π T折叠作用。哌啶环部分可与His438形成π-烷基相互作用。磺酰胺O原子与Trp82,Cl原子和Ser198均可形成氢键,同时Cl原子可与Trp231形成π-烷基相互作用。萘环可与Tyr332和Ala328分别形成π-π堆积作用和π-烷基相互作用。
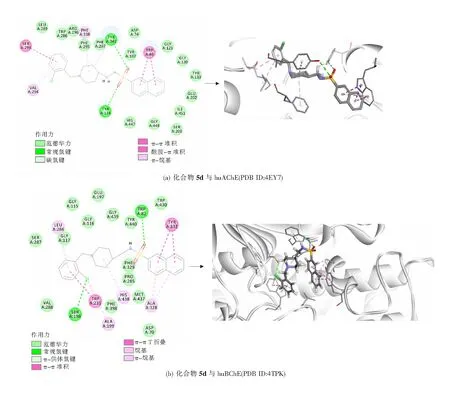
图5 化合物5d与胆碱脂酶的结合模式预测
2.4 初步构效关系讨论
综合体外酶抑制活性评价结果与初步分子对接模型预测数据,对已合成的21个化合物进行了初步构效关系讨论与总结。
首先,分析了A环各个取代基对酶抑制活性的影响,考察了化合物与AChE、BChE的活性口袋结合能力,发现化合物4、5、8系列酶抑制活性明显优于7系列,表明A环上取代基相对较小时,能增大酶抑制活性;发现化合物4、5系列酶抑制活性优于8系列且更明显优于6系列,表明A环上取代基为吸电子取代基时,可增大酶抑制活性。进一步由化合物5d与BChE活性位点的结合模式发现,邻氯可与Ser198形成氢卤键,增强与BChE的结合能力。综上,A环取代基为小体积吸电子取代基时,会极大地增强酶抑制活性;氯原子作为小体积吸电子基,在邻位取代时,可与BChE的活性口袋中特定的氨基酸残基形成氢卤键,增强与活性口袋的结合能力。
其次,纵向分析了不同系列的化合物,以讨论Linker为酰胺键或磺酰胺键时各自的优势,由纵向比较所得,化合物d系列相较于a、c系列在BChE的抑制活性中显示出了一定的选择性,分析原因可能是由于磺酰胺键较酰胺键更易旋转,更易适应性结合BChE活性位点的浅V型口袋;而酰胺键较磺酰胺键体积更小,更适于AChE活性位点的哑铃型口袋。进一步由化合物5d分别与AChE和BChE活性口袋的结合模式发现,磺酰胺键可提供更多的氢键受体位点,因此易于与结合口袋中的氨基酸残基形成氢键,增强结合能力。综上,磺酰胺键作为连接基团时,因其可旋转能力,易于形成优势构象并插入相应的活性口袋,更可与AChE和BChE的活性口袋分别形成氢键,增强其与结合口袋的结合能力,所以磺酰胺键为Linker的较优选择。
最后,在分析不同的B环结构对酶活性的影响时发现,化合物d系列对酶抑制活性优于a、c系列,更优于b系列,分析原因为苯并六元环更易通过π-π堆积作用力增强与AChE、BChE的活性口袋的结合能力,进一步由化合物5d分别与AChE和BChE活性口袋的结合模式确证。同时,d系列化合物因其萘环的芳香性,极大提升了化合物的log P,理论上更易通过血脑屏障,保证脑内化合物浓度及安全性。综上,苯并六元环可能是今后开发乙酰、丁酰胆碱酯酶双靶点抑制剂的更优B环结构。
3 结 论
相较于先导化合物G801-0274,化合物5d显示出了对huAChE和huBChE更均衡的抑制活性,且对AChE的抑制活性是G801-0274的22.7倍。相较于先导化合物8i,化合物5d的酶抑制活性均优于8i,且对AChE的抑制活性是8i的4.3倍,对BChE的酶抑制活性是8i的2.3倍。相较于文献中的AChE和BChE双靶点抑制剂[25],化合物5d的酶抑制活性极优于文献化合物。
本研究设计并合成了5个系列共21个化合物,利用Ellman法评价了所合成的化合物对huAChE和huBChE的酶抑制活性,并利用SI表明化合物的双靶点酶抑制作用能力,结果表明5d优于先导化合物,是其中酶抑制活性最强且较均衡的化合物;通过初步分子结合模式预测,进一步印证了其与huAChE、huBChE具有强结合能力;化合物5d的log P的预测数据表明其具有良好的脂溶性,理论上更利于透过血脑屏障,有利于保证化合物在脑内的浓度水平。综上所述,化合物5d是一个极具研究潜力的化合物。本研究对构效关系的初步总结,将有助于开发长效抗AD的治疗药物。
