布拉氏酵母菌防治儿童抗生素相关性腹泻的效果分析
2022-06-30谭改玲刘玲李微
谭改玲, 刘玲, 李微
[广东医科大学附属第三医院(佛山市顺德区龙江医院) 儿科, 广东 佛山 528318]
抗生素相关性腹泻 (antibiotic-associated diarrhea, AAD)是指应用抗生素后发生的、 与抗生素有关, 且无法用其他原因解释的腹泻[1]。 研究[2]发现有700 多种药物可引起腹泻, 其中抗生素占25%。 随着临床广谱抗生素的广泛应用, AAD 已成为儿科临床的常见并发症, 一般在应用抗生素4 ~5 d 出现,是儿童药源性腹泻的常见类型[3]。 AAD 发生的病因和发病机制至今尚未明确, 临床多认为抗生素的使用破坏了肠道正常菌群, 进而导致肠道菌群失调, 抗生素导致肠道菌群紊乱是AAD发生和发展的基础[4]。 因此, 在应用抗生素的同时服用益生菌制剂成为防治儿童AAD 的重要措施。 研究[5-7]表明, 布拉氏酵母菌制剂在儿科临床的应用越来越广泛, 对抗生素引起的腹泻具有显著的防治作用。 基于此, 本研究进一步探讨布拉氏酵母菌防治儿童抗生素相关性腹泻 (AAD) 的临床效果, 以期为临床应用提供更多参考, 现将结果报道如下。
1 资料与方法
1.1 一般资料选取2019 年6 月至2020 年6 月我院收治的150 例肺炎患儿。 纳入标准: 符合 《诸福棠实用儿科学》 中肺炎的诊断标准[8], 发病前1 个月未使用任何抗生素, 本次应用抗生素后出现腹泻症状; 原发病已好转仍持续腹泻。 排除标准: 入院时或入院前有腹泻症状; 入院前2 周服用益生菌制剂者; 服用具有治疗腹泻作用的药物者; 肠道术后者; 有先天性心脏病史者。 随机将入选患儿分为观察组和对照组各75 例。观察组中男性患儿31 例, 女性患儿44 例; 年龄25 ~36 个月,平均年龄 (29.36 ± 8.72) 个月; 抗生素使用时间5 ~10 d, 平均使用时间 (8.19 ± 3.94) d。 对照组中男性患儿35 例, 女性患儿40 例; 年龄27 ~35 个月, 平均年龄 (30.05 ± 9.86) 个月; 抗生素使用时间5 ~10 d, 平均使用时间 (8.25 ± 2.73)d。 两组患儿的性别、 年龄、 抗生素使用时间等一般资料比较,差异无统计学意义 (P>0.05), 具有可比性。
1.2 治疗方法对照组患儿仅给予静脉注射抗生素抗感染、 止咳、 化痰、 平喘及退热等对症治疗, 观察组患儿在对照组治疗基础上给予布拉氏酵母菌散 (法国百科达制药厂, 进口批准文号JS20150025, 0.25 g/袋) 治疗, 服用剂量为1 袋/次, 1 次/天。 两组均治疗7 d。 治疗期间两组患儿出现腹泻后均给予补液及蒙脱石散 (浙江海力生制药有限公司, 国药准字H19980050, 3 g/袋) 口服治疗, 蒙脱石散用法用量为0.5 袋/次, 3 次/日, 服用至腹泻症状消失。
1.3 观察指标比较两组患儿的AAD 发生率、 腹泻次数、 腹泻持续时间及AAD 治疗效果。 AAD 疗效评价标准如下: 治疗后大便次数<3 次/天, 大便成形, 无呕吐、 发热、 乏力等并发症即为显效; 治疗后大便次数3 ~5 次/天, 大便性状好转, 体温恢复正常, 无呕吐和乏力等并发症即为有效; 治疗后大便次数增多, 大便性状无好转, 体温波动、 呕吐及乏力等并发症无改善或加重即为无效。 总有效率= 显效率+有效率。
1.4 统计学方法采用SPSS 21.0 统计软件处理数据。 计数资料以n (%) 表示, 采用χ2检验; 计量资料以均数± 标准差 (x± s) 表示, 采用t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 AAD 发生率观察组患儿中9 例发生AAD, AAD 发生率为12.00%; 对照组患儿中26 例发生AAD, AAD 发生率为34.67%; 两组患儿的AAD 发生率比较, 差异有统计学意义 (χ2= 10.770,P= 0.001)。
2.2 腹泻次数和腹泻持续时间观察组AAD 患儿的腹泻次数显著少于对照组, 腹泻持续时间显著短于对照组, 差异均有统计学意义 (P<0.05)。 见表1。
表1 两组AAD 患儿的腹泻次数和腹泻持续时间比较 (±s)
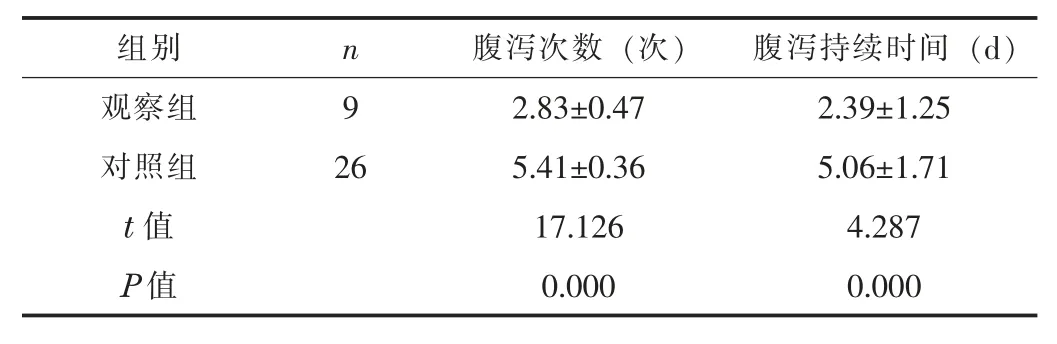
表1 两组AAD 患儿的腹泻次数和腹泻持续时间比较 (±s)
?
2.3 AAD 治疗效果观察组的AAD 治疗总有效率为100.00%,显著高于对照组的65.38%, 差异有统计学意义 (P<0.05)。 见表2。
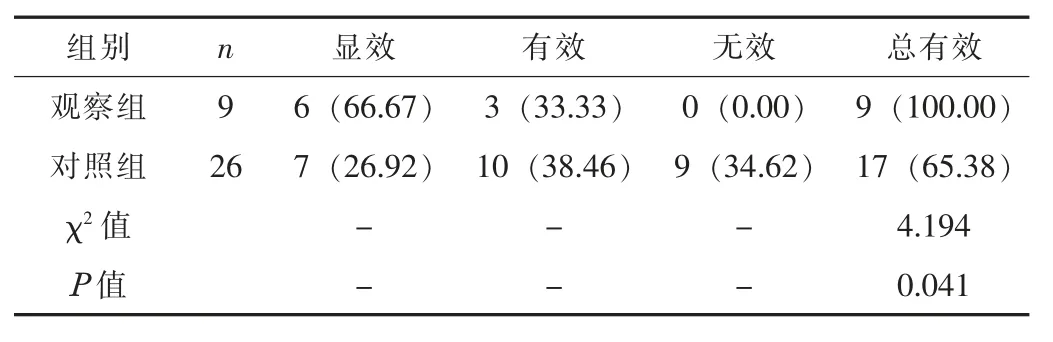
表2 两组的AAD 治疗效果比较 [n (%)]
3 讨论
儿童肺炎是儿科常见疾病, 针对肺炎的治疗以抗生素为主, 50%的肺炎患儿应用抗生素后会出现腹泻情况。 AAD 的发生与抗生素种类、 给药途径、 抗菌谱、 患儿年龄及个体差异等因素相关。 肺炎患儿往往抵抗力较差, 肠道菌群敏感, 易受外界因素影响, 尤其是长时间大量使用广谱抗生素后, 患儿肠道敏感菌被抑制而非敏感菌大量繁殖, 肠道微生态系统被破坏,导致AAD 的发生[9]。 严重AAD 会导致肠道黏膜屏障受损, 影响患儿消化吸收功能[10]。 研究[11]表明, 肠道菌群发生紊乱失调, 可通过引入外来微生态制剂进行调节纠正, 微生态制剂通过分泌抑菌或杀菌物质及增强肠道局部免疫应答等作用, 可有效清除肠道有害病毒和细菌, 缩短腹泻持续时间, 改善腹泻症状。 布拉氏酵母菌对抗生素天然耐药且具有高度的稳定性,该制剂在肠道内不被吸收, 半衰期长, 可通过抗菌、 抗病毒,保护肠黏膜, 调节肠道菌群, 增强肠道免疫, 改善炎症达到治疗腹泻的目的[12]。 本研究结果显示, 观察组的AAD 发生率为12.00%, 显著低于对照组的34.67% (P<0.05), 表明布拉氏酵母菌可有效预防AAD 的发生。 本研究结果还显示, 观察组AAD 患儿的腹泻次数显著少于对照组, 腹泻时间显著短于对照组 (P<0.05), 表明布拉氏酵母菌可明显减少腹泻次数, 缩短腹泻时间。 此外, 本研究结果显示, 观察组的AAD 治疗总有效率显著高于对照组 (P<0.05), 表明布拉氏酵母菌可有效提高AAD 治疗效果。
综上所述, 布拉氏酵母菌可有效预防儿童AAD 的发生,降低AAD 发生率, 减少腹泻次数, 缩短腹泻时间, 提升AAD治疗效果。
