血清外泌体miR-21靶向PTEN激活PI3K/AKT信号通路诱导肺癌细胞的生长和转移的机制分析*
2022-06-29同立宏马红霞
张 茜,同立宏,马红霞
新疆医科大学附属中医医院呼吸与危重症医学科,新疆乌鲁木齐 830002
肺癌是常见且病死率较高的恶性肿瘤,其发病率位居恶性肿瘤之首,根据病理特征可将其分为非小细胞肺癌和小细胞肺癌,肺癌的治疗除了传统的手术和放化疗外,一些针对经典肿瘤靶点的药物及针对免疫检查点类药物的成功研发均为肺癌的治疗提供了帮助,但是肺癌患者5年生存率仍然较低,约为15%[1-3],因此探讨肺癌发生机制,研究新型治疗手段对于肺癌患者至关重要。肿瘤外泌体是一类由肿瘤细胞分泌的纳米级囊泡,可存在于血液、唾液、泪液等体液中,外泌体内含多种遗传物质,包括微小RNA(miRNA)、长链非编码RNA(lncRNA)、DNA、环状RNA(circRNA)等,其中血清外泌体中miRNA与肿瘤的病理机制密切相关,并且具有用于肿瘤诊断和治疗的潜力[4-5]。有研究显示,miR-21在肺癌中高表达[6],亦有学者报道,miR-21可诱导肿瘤相关成纤维细胞的形成而促进肺癌的发展[7],亦可调控蛋白激酶B(AKT)/磷酸化蛋白激酶B(p-AKT)/半胱氨酸蛋白酶3/基质金属蛋白酶(MMP)-2/MMP-9信号通路而促进肺癌的生长和转移[8]。本文探讨了血清外泌体中miR-21的表达水平,以及对肺癌细胞生长和转移的影响及机制。
1 资料与方法
1.1一般资料 收集20例肺癌患者的血液标本以及18例健康志愿者血液标本。肺癌患者纳入标准:经活检标本病理检查确诊为肺癌、未接受过手术、化疗、放疗等治疗,本研究获得本院伦理委员会批准,患者签署知情同意书。人肺癌细胞A549(中国科学院上海细胞库);Transwell小室(购自美国Corning公司);CCK8试剂盒(沈阳万类生物技术有限公司);蛋白酪氨酸磷酸酶基因(PTEN)、磷酸化磷酸酰肌醇3-激酶(p-PI3K)、PI3K、p-AKT、AKT、CD9、CD63、TSG101、甘油醛-3-磷酸脱氢酶(GAPDH)一抗、IgG二抗(武汉三鹰生物技术有限公司),双荧光素酶报告基因试验检测试剂盒(英国Abcam公司),Trans ExoTM Serum/Plasma Exosome Kit(北京全式金科技有限公司),ExoRNeasy Serum/Plasma Midi Kit(德国QIAGEN公司)。
1.2方法
1.2.1细胞培养与分组 A549细胞培养于含10%胎牛血清的RPMI-1640培养基中,分为miR-NC组(转染miR-NC)、miR-21组(转染miR-21 mimic)和miR-21+PTEN组(转染miR-21 mimic后再转染PTEN质粒),Normal exo组(A549细胞与10 μg/mL Normal exo共孵育48 h)、LCA exo组(A549细胞与10 μg/mL LCA exo共孵育48 h)、LCA exo+PTEN组(A549细胞与10 μg/mL LCA exo共孵育48 h后转染PTEN质粒)、PBS组(A549细胞中加入等体积PBS培养48 h)。按照上述分组,使用Lipofectamine 2000试剂进行转染。
1.2.2外泌体提取与鉴定 将20例肺癌患者的血液标本及18例健康志愿者血液标本置于无菌试管中,放置30 min取上层血清,血清外泌体提取使用TransExoTMSerum/Plasma Exosome Kit试剂盒。在透射电镜下观察外泌体的结构,Western blot鉴定外泌体标志蛋白CD9、CD63、TSG101。
1.2.3qRT-PCR 使用ExoRNeasy Serum/Plasma Midi Kit提取血清外泌体miRNA,使用miRNA cDNA Synthesis Kit试剂盒和EvaGreen miRNA qRCR MasterMix试剂盒进行miR-21逆转录反应和qRT-RCR反应,使用2-ΔΔCT法计算miR-21表达。引物序列见表1。
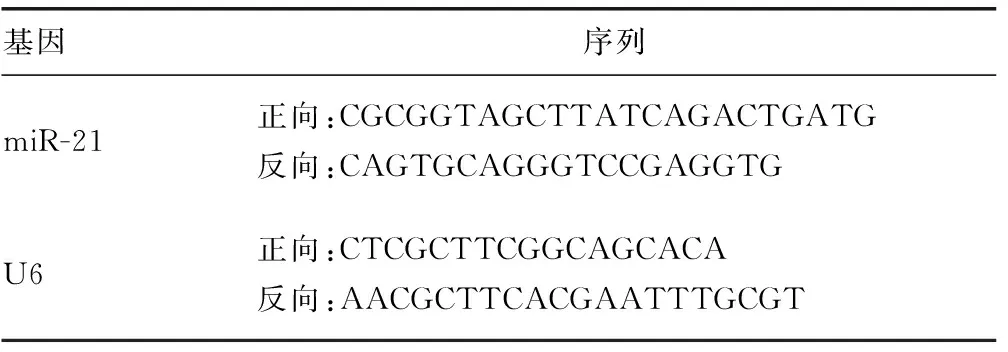
表1 引物序列表
1.2.4双荧光素酶报告基因试验 TargetScan数据库预测miR-21与PTEN结合位点,构建PTEN野生型(pGL3-PTEN WT组)、突变型质粒(pGL3- PTEN MUT组)及空白质粒(pGL3-control组),并使用Lipofectamine 2000转染试剂将上述质粒转染进293T细胞,再用RNA转染试剂将miR-21 mimic和miR-NC转染至上述293T细胞,使用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.2.5CCK8法检测细胞增殖能力 将转染后或者与外泌体孵育后的各组A549细胞接种至96孔板,每孔1 000个/100微升,于细胞培养箱中培养0、24、48、72 h后,取出对应的96孔板,每孔加入10 μL的CCK8溶液,于细胞培养箱中孵育4 h后,用酶标仪检测450 nm处的吸光度值(A值)。
1.2.6Transwell小室法检测细胞迁移和侵袭能力 取各组A549细胞用RPMI-1640空白培养基稀释,然后以10 000个/200微升接种至Transwell小室中(或铺Matrigel胶的Transwell小室),小室置于600 μL含10%胎牛血清的RPMI-1640的24孔板中,然后转移至细胞培养箱中72 h,取出后用PBS清洗小室,底部滴加无水甲醛固定30 min,底部滴加结晶紫溶液染色10 min,清洗小室,晾干,显微镜下观察并拍照。
1.2.7Western blot检测PTEN蛋白表达 取各组A549细胞1×104个加入200 μL RIPA冰上裂解30 min,12 000 r/min,离心15 min,取上清液为细胞总蛋白,BCA试剂盒进行蛋白定量,取10 μg蛋白,SDS-PAGE凝胶电泳分离蛋白,然后转膜,封闭2 h,PVDF膜与PTEN、p-PI3K、PI3K、p-AKT、AKT、CD9、CD63、TSG101抗体4 ℃过夜孵育,TBST洗膜后,二抗室温孵育1.5 h,洗膜后用ECL试剂盒显影,拍照,用Image J软件对曝光结果进行定量分析。
2 结 果
2.1外泌体的鉴定结果 透射电镜观察到Normal exo组和LCA exo组外泌体粒径在30~100 nm,具有双层膜结构,呈“杯托”样,并且表达外泌体标志蛋白CD9、CD63、TSG101。见图1、图2。
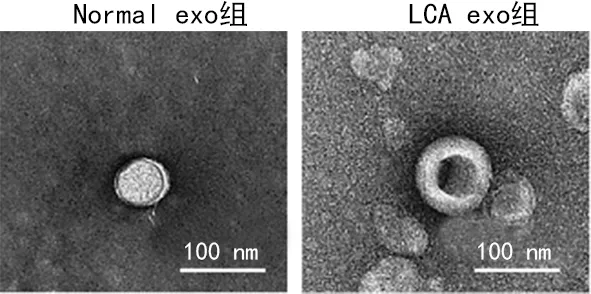
图1 透射电镜鉴定外泌体
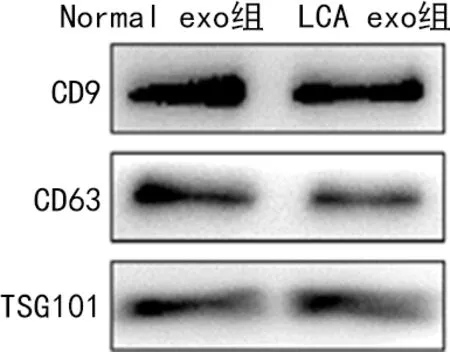
图2 Western blot鉴定外泌体
2.2肺癌患者血清外泌体中miR-21高表达 qRT-PCR检测结果显示,与Normal exo组比较,LCA exo组中miR-21表达上调(P<0.001)。见图3。
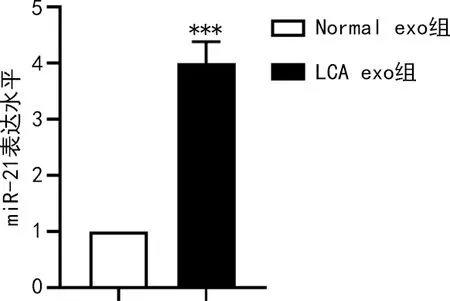
注:***P<0.001。图3 qRT-PCR检测Normal exo组和LCA exo组中miR-21的表达
2.3PTEN为miR-21的靶基因 双荧光素酶报告基因检测结果显示,pGL3-PTEN WT组293T细胞转染miR-21 mimic后相对荧光强度低于转染miR-NC的细胞(P<0.001),而pGL3-PTEN MUT组293T细胞转染miR-NC和miR-21 mimic后相对荧光强度无明显变化。Western blot检测结果显示,相比于miR-NC组,miR-21组A549细胞PTEN表达水平下调(P<0.001)。见图4。
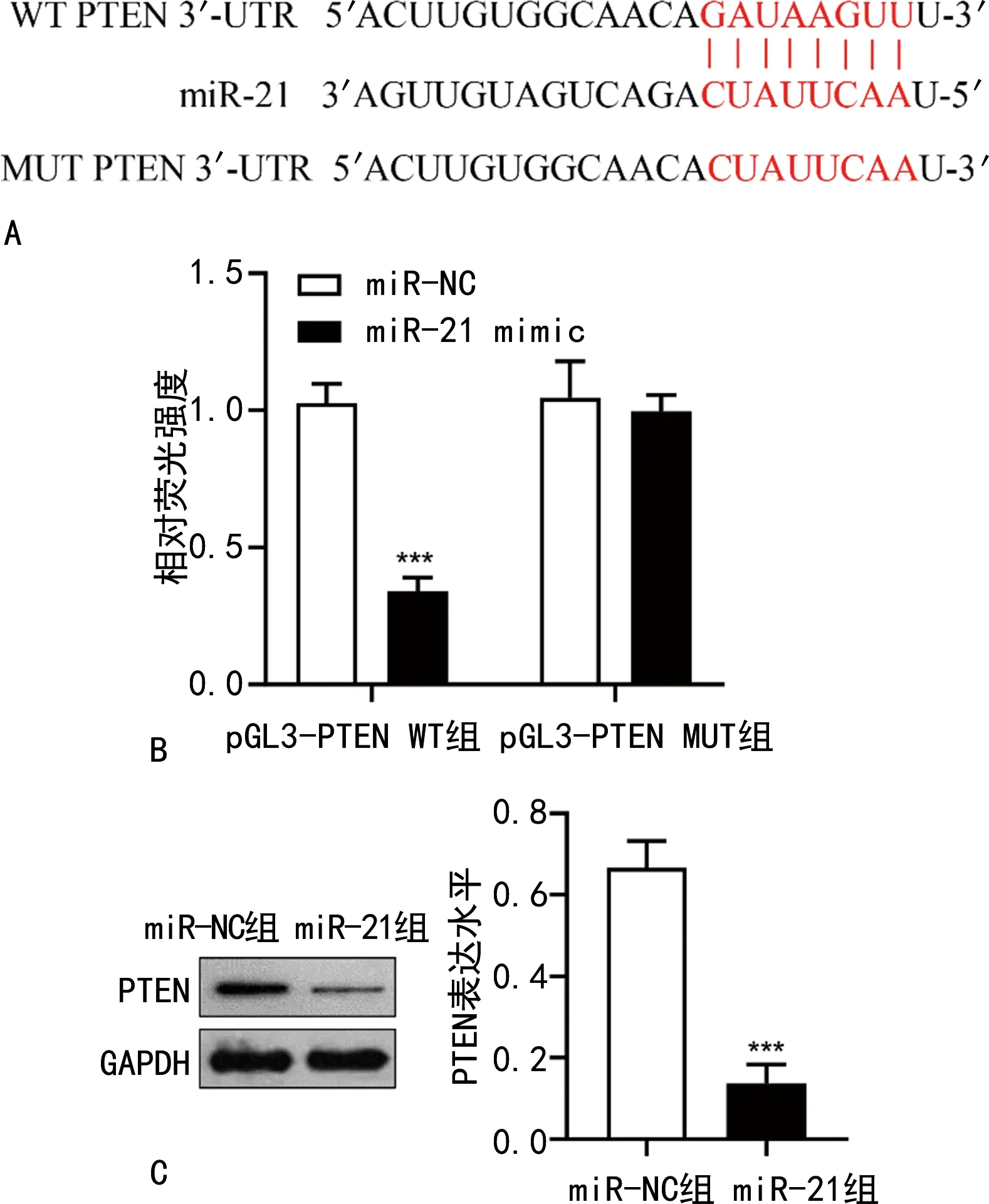
注:A为数据库预测miR-21和PTEN mRNA的靶向结合位点;B为双荧光素酶报告基因试验;C为Western blot检测miR-21对PTEN蛋白表达的影响;与miR-NC组比较,***P<0.001。图4 miR-21靶向抑制PTEN表达
2.4miR-21靶向PTEN促进肺癌细胞的生长和转移能力 CCK8、细胞迁移和侵袭检测结果显示,相比于miR-NC组,miR-21组A549细胞在24、48、72 h的A值显著增加(P<0.05),细胞迁移和侵袭数显著增加(P<0.001);相比于miR-21组,miR-21+PTEN组细胞在48、72 h的A值显著下降(P<0.01),细胞迁移和侵袭数显著减少(P<0.001)。见图5。
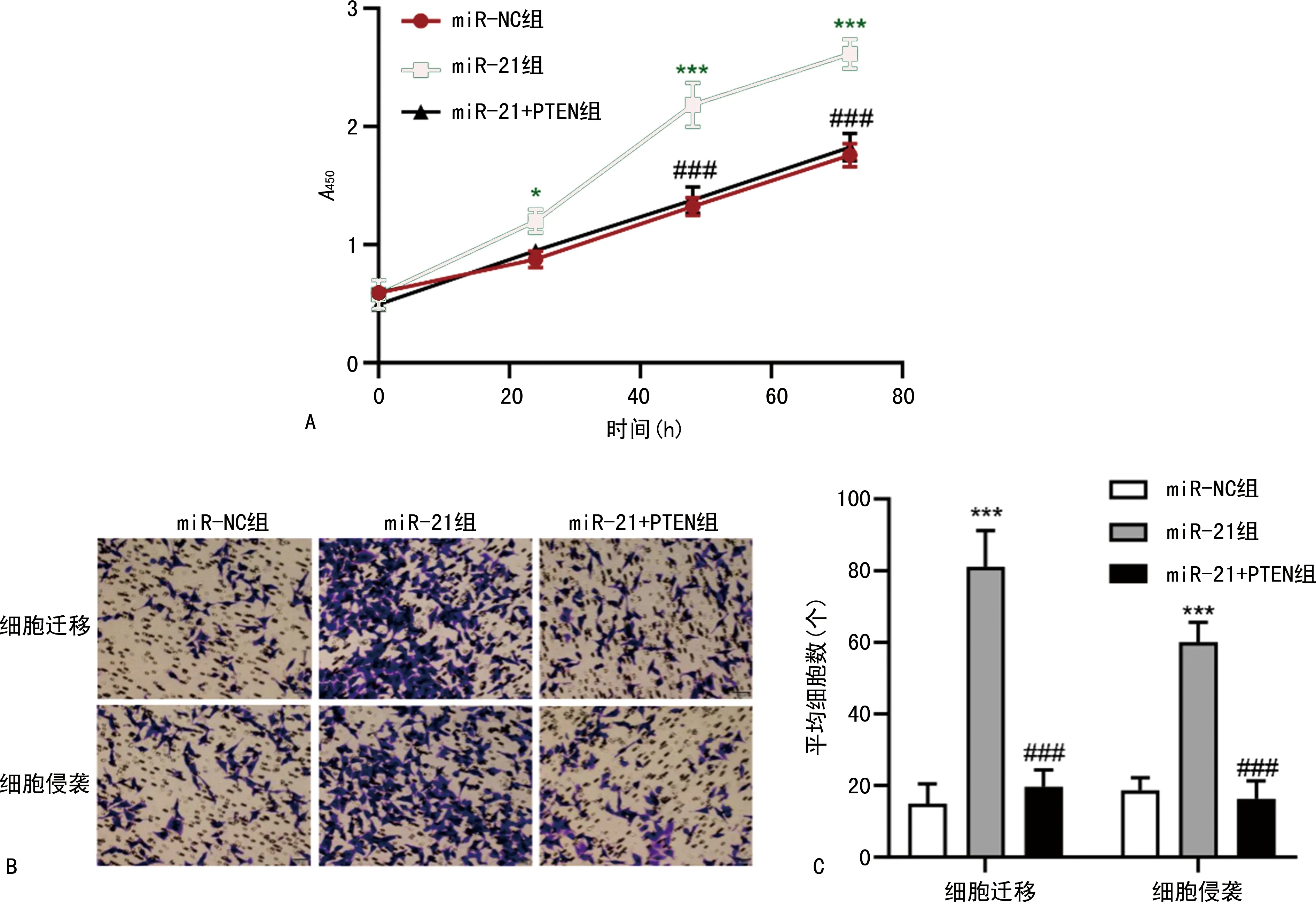
注:A为3组细胞在不同时间点的A值变化情况;B为显微镜观察3组细胞迁移和侵袭情况(×20);C为3组细胞迁移和侵袭数的比较。与miR-NC组比较,***P<0.001;与miR-21组比较,###P<0.001。图5 miR-21靶向PTEN抑制肺癌细胞生长和转移能力
2.5肺癌患者血清外泌体转移miR-21至肺癌细胞情况 qRT-PCR检测结果显示,相比于PBS组,LCA exo组A549细胞中miR-21表达水平显著上调(P<0.001),而Normal exo组A549细胞中miR-21表达水平与PBS组相比,差异无统计学意义(P>0.05),说明肺癌患者血清外泌体可转移miR-21至肺癌细胞中。见图6。
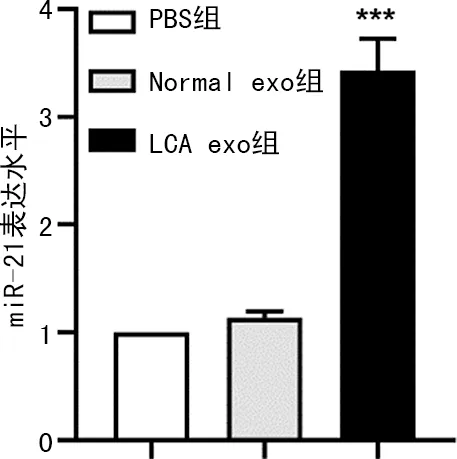
注:与PBS组比较,***P<0.001。图6 qRT-PCR检测各组A549细胞中miR-21表达
2.6血清外泌体传递miR-21调控PTEN表达而促进肺癌的生长和转移能力 CCK8、Transwell及Western blot检测结果显示,与PBS组比较,LCA exo组A549细胞A值在24、48、72 h显著增加(P<0.05),细胞迁移和侵袭数显著增加(P<0.001),PTEN表达水平显著下调(P<0.001),而Normal exo组细胞增殖、迁移、侵袭能力及PTEN表达水平差异无统计学意义(P>0.05)。LCA exo+PTEN组A549细胞PTEN表达上调(P<0.001),A值在24、48、72 h显著低于LCA exo组(P<0.05),细胞迁移和侵袭数显著低于LCA exo组(P<0.001),说明血清外泌体miR-21调控PTEN表达而促进肺癌的生长和转移。见图7。
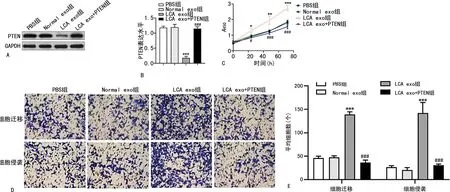
注:A为Western blot检测4组细胞PTEN表达情况;B为4组细胞PTEN相对表达水平的比较;C为4组细胞在不同时间点的A值变化情况;D为显微镜观察4组细胞迁移和侵袭情况(×20);E为4组细胞迁移和侵袭数的比较;与PBS组比较,***P<0.001;与LCA exo组比较,###P<0.001。图7 LCA exo可抑制PTEN表达而促进肺癌细胞的生长和转移
2.7血清外泌体传递miR-21靶向PTEN而激活PI3K/AKT信号通路 与PBS组比较,LCA exo组A549细胞中p-PI3K/PI3K和p-AKT/AKT显著增加(P<0.001),而Normal exo组无显著变化;与LCA exo组比较,LCA exo+PTEN组A549细胞p-PI3K/PI3K和p-AKT/AKT显著降低(P<0.001),提示LCA exo可通过转移miR-21调控A549细胞PTEN表达而激活PI3K/AKT信号通路。见图8。
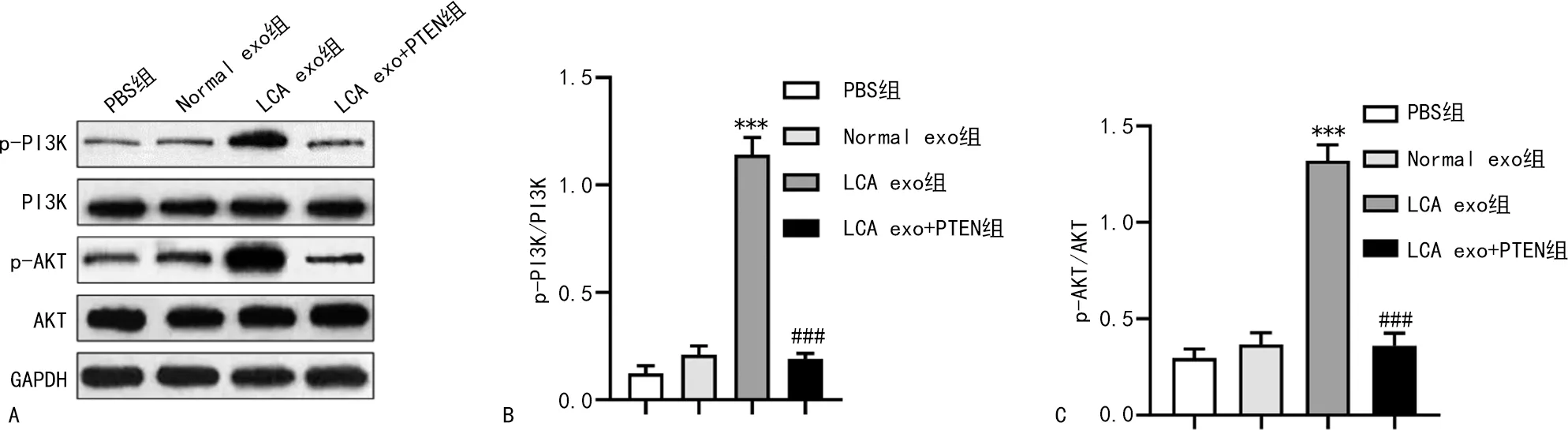
A为Western blot检测4组细胞p-PI3K、PI3K、p-AKT、AKT表达水平;B为4组细胞p-PI3K/PI3K的比较;C为4组细胞p-AKT/AKT的比较;与PBS组比较,***P<0.001;与LCA exo组比较,###P<0.001。图8 LCA exo抑制PTEN激活PI3K/AKT信号通路
3 讨 论
外泌体是一类由多种活细胞分泌的纳米级囊泡,可在生理状态下和病理状态下调控机体的生长发育以及疾病的发生发展,外泌体可存在于血液、脑脊液、腹水、唾液等体液中[9-10]。外泌体内含多种遗传物质,如miRNA、lncRNA、circRNA等。其中,外泌体miRNA在肺癌的发生发展过程中发挥多种生物学调控功能。研究表明,经化疗后的肺癌患者血清外泌体中miR-208a高表达,而抑制P21/AKT/mTOR信号通路,进而促进肺癌细胞的生长和转移及化疗耐受[11]。亦有研究表明,非小细胞肺癌患者血清外泌体中miR-17-5p表达高于健康人血清外泌体,外泌体miR-17-5p具有用于非小细胞肺癌诊断的潜力,将其与传统标志物联合使用,以提高肺癌早期诊断的灵敏度和特异度[12]。
肺癌患者血清外泌体中的miRNA能够作为肺癌诊断和治疗的新型靶点,有研究显示,肺癌患者血清外泌体中miR-96作为预测顺铂耐药的标志物,从而为肺癌患者提供更精准的治疗方案,miR-96的靶向抑制剂可改善肺癌细胞对顺铂的耐药情况[13]。miR-21已经被报道可调控肝癌、卵巢癌、乳腺癌等肿瘤的进展,如肿瘤微环境中外泌体miR-21可诱导早期肝癌的转移,miR-21可靶向PTEN而促进卵巢癌的增殖和迁移,亦可作为乳腺癌诊断的潜在靶点[14-16]。在肺癌中,miR-21可调控脂肪酸的代谢而促进非小细胞肺癌的增殖[17],也可调控 PTEN/AKT/GSK3β信号通路而促进肺癌的生长和上皮间质转化[18]。本研究首先提取并鉴定了来自健康志愿者和肺癌患者血清中的外泌体,然后检测发现肺癌患者血清外泌体中miR-21表达增加,在肺癌细胞A549中转染miR-21 mimic后,细胞增殖、迁移和侵袭能力均显著增加,说明miR-21具有促进肺癌生长和转移的能力。miRNA是一类可调控肿瘤发生发展的RNA,其调控机制在靶向结合与靶基因mRNA的3′UTR区域,而抑制靶基因的翻译[19]。本研究通过双荧光素酶报告基因试验验证了PTEN为miR-21的靶基因,并且发现miR-21可抑制PTEN表达来促进肺癌细胞的生长和转移能力。研究发现,肺癌患者血清外泌体可转移miR-21至A549细胞中而促进A549细胞的增殖、迁移和侵袭能力,但是将与外泌体共孵育的A549细胞转染PTEN质粒后,细胞的增殖迁移和侵袭能力均下降,说明肺癌患者血清外泌体可通过转移miR-21调控PTEN的表达而影响细胞的生长和转移能力。
PI3K/AKT信号通路是调控肺癌的重要信号通路,研究表明,PI3K/AKT/mTOR信号通路可作为非小细胞肺癌的治疗靶点[20],PI3K/AKT信号通路抑制剂可显著抑制肺癌的发生发展[21],亦可诱导肿瘤血管新生而促进肿瘤的生长[22]。PTEN作为PI3K/AKT信号的调控因子,可抑制PI3K和AKT的磷酸化水平而抑制PI3K/AKT信号通路,进而抑制肿瘤的生长[23]。本研究发现肺癌患者血清外泌体和miR-21可显著提高p-PI3K和p-AKT水平,即激活PI3K/AKT信号通路,而过表达PTEN可抑制外泌体对该通路的激活。
综上所述,血清外泌体能够通过传递miR-21而调控PTEN/PI3K/AKT信号通路,进而促进肺癌的生长和转移,但是其在临床诊断和治疗的应用还需进一步探究。
