HMMR预测肝细胞癌预后的生物信息学分析*
2022-06-29吴良银李文丽
吴良银,李文丽,刘 俊
粤北人民医院:1.检验科;2.生殖医学中心,广东韶关 512025;3.汕头大学医学院,广东汕头 515041
肝细胞癌是世界上第五大常见恶性肿瘤,每年全球确诊的新病例超过70万[1]。虽然目前采取了包括一级预防策略、早期筛查诊断以及更先进治疗技术在内的多种诊疗方案,但肝癌的总体发病率和病死率仍持续上升[2]。肝细胞癌是一种高异质性肿瘤,且肝细胞癌的发生和发展是多机制调控、多分子参与的过程[3]。目前,肝细胞癌仍面临着高复发率及晚期低生存率的现状,因此,准确地识别预后生物标志物对预后较差的高危患者进行监测和制订个体化治疗策略,以及防止复发都具有重要的意义。
越来越多的证据表明,分子遗传及拷贝数变异在肝细胞癌的发生、发展中起着重要的作用。隆绍平等[4]研究结果表明,非受体型蛋白酪氨酸磷酸酶12(PTPN12)是预测肝细胞癌患者预后的因素,可能成为肝细胞癌预后的重要生物标志物[4]。相关研究显示,透明质酸介导的运动受体(HMMR)在肝细胞癌中呈显著高表达,并且有一定的预后意义,但其在肝细胞癌中的作用仍有待进一步研究[5]。本研究回顾性分析了癌症基因组图谱计划(TCGA)和国际癌症基因组联合体(ICGC)数据库中的肝细胞癌转录组数据和相对应的临床资料,旨在分析HMMR在肝细胞癌中的表达情况,以及与临床分期的相关性,同时通过单因素生存分析以及多因素COX回归分析HMMR对肝细胞癌预后的预测作用。现报道如下。
1 资料和方法
1.1一般资料 从TCGA数据库下载377例肝细胞癌患者的表达谱数据和临床资料,同时从ICGC数据库下载232例肝细胞癌患者的表达谱数据和临床资料。选取癌旁组织202例、正常组织202例进行比较。609例肝细胞癌患者中男426例,女183例;生存438例,死亡171例;TNM分期T1、T2、T3、T4分别有185、95、80、13例,M0、M1、MX各有272、4、101例,N0、N1、NX各有257、4、115例;Stage分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期各有211、193、157、24例;组织学分级G1、G2、G3、G4级各有55、180、124、13例。
1.2基因富集分析(GSEA) 为了进一步探索HMMR的表达对于肝细胞癌的潜在影响机制,本研究通过GSEA分析来阐明HMMR高低表达组之间差异基因的富集通路。从GSEA官网 (http://software.broadinstitute.org/gsea/index.jsp)下载GSEA (JAVA version,2-2.2.3) 分析软件。GSEA通过标准化的P值和标准化的富集评分来分析富集通路。
1.3统计学处理 使用R3.6.1统计软件进行统计学分析。计数资料采用百分数表示。采用Wilcoxon秩和检验比较HMMR的表达水平在肝细胞癌和正常组织之间以及肝细胞癌和癌旁组织之间的差异。采用Wilcoxon秩和检验、Kruskal-Wallis检验和Logistic回归分析临床特征与HMMR表达水平之间的关系。采用Kaplan-Meier法分析HMMR的表达水平与患者总体生存时间的关系。采用单因素及多因素COX回归分析比较HMMR的表达水平对生存期及其他临床特征的影响。以P<0.05为差异有统计学意义。
2 结 果
2.1HMMR在肝细胞癌组织、正常组织、癌旁组织中的表达水平比较 结果显示,与正常组织比较,HMMR在肝细胞癌组织中表达水平显著升高(P<0.05)。同时,与癌旁组织比较,HMMR在肝细胞癌组织中表达水平显著升高(P<0.05),见图1。
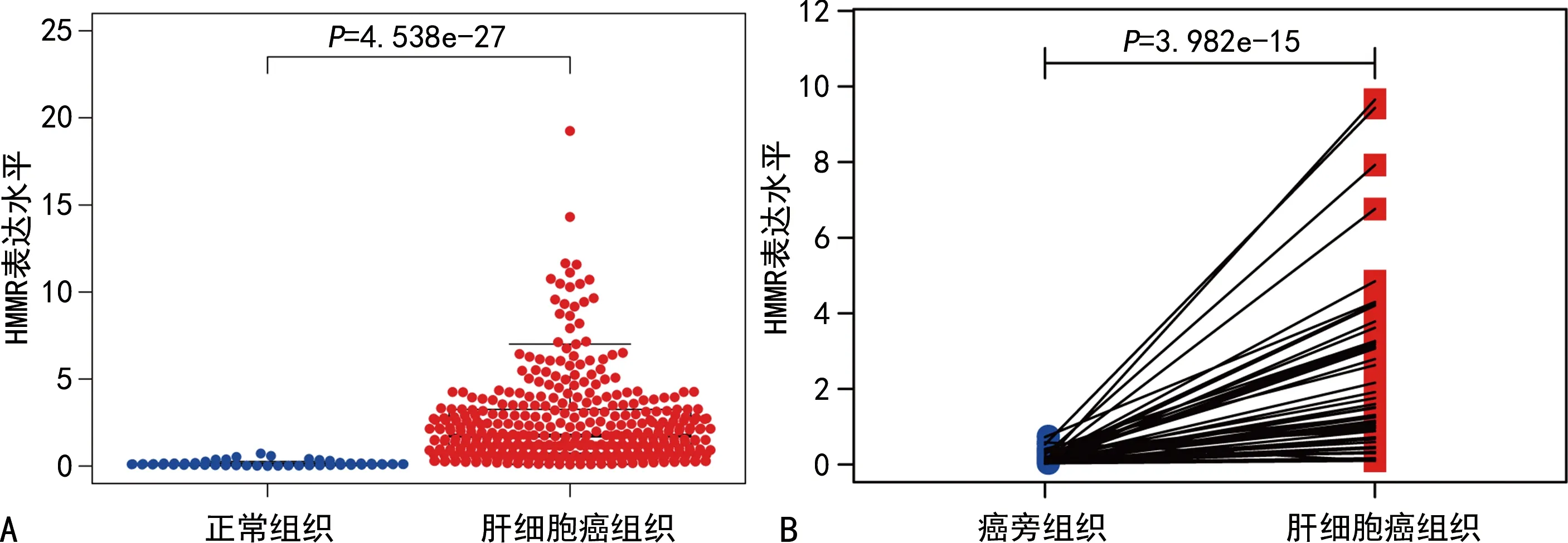
注:A为HMMR在正常组织和肝细胞癌组织中表达水平的比较;B为HMMR在癌旁组织和肝细胞癌组织中的表达水平比较。图1 HMMR在肝细胞癌组织、正常组织、癌旁组织中的表达情况
2.2HMMR在肝细胞癌中的表达水平与临床特征的相关性 本研究分析了TCGA数据库中 HMMR的表达水平与临床特征的关系,结果显示,组织学分级越高,HMMR表达水平越高(P<0.05);Stage分期、T分期越高,HMMR表达水平也更高(P<0.05)。而不同M分期及N分期的患者HMMR表达水平差异无统计学意义(P>0.05)。同时,Logistic回归分析显示,StageⅡ期和StageⅢ期的HMMR表达水平高于StageⅠ期(OR=2.49、2.57;P=0.000 7、0.000 5);T2及T3期的HMMR表达水平高于T1期(OR=2.73、2.31;P=0.000 1、0.002 2);同时,G3期的HMMR表达水平高于G1期(OR=2.92,P=0.001 5)。Kaplan-Meier曲线分析结果显示,HMMR低表达患者生存率高于HMMR高表达者,差异有统计学意义(P<0.001)。见图2。同时,本研究分析了ICGC数据库中HMMR在肝细胞癌组织、正常组织中的表达水平,结果显示,HMMR在肝细胞癌组织中表达水平显著升高(P<0.001);Kaplan-Meier生存分析也表明,HMMR高表达患者在ICGC数据库中的生存率低于HMMR低表达者(P<0.001)。见图3。
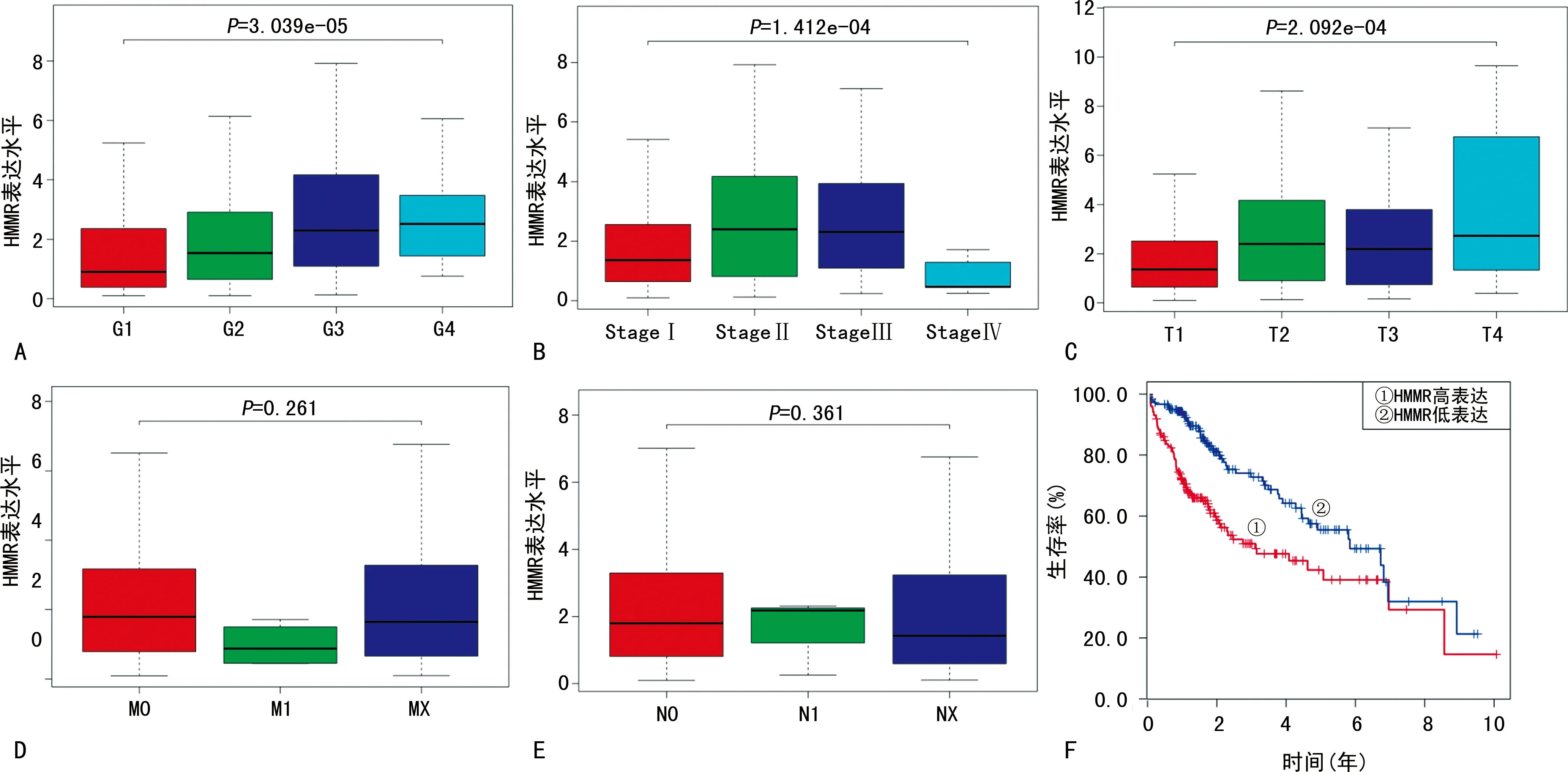
注:A为HMMR表达水平与组织学分级的关系分析;B为HMMR表达水平与肿瘤Stage分期的关系分析;C为HMMR表达水平与T分期的关系分析;D为HMMR表达水平与M分期的关系分析;E为HMMR表达水平与N分期的关系分析;F为不同HMMR表达水平的患者生存率分析。图2 HMMR在肝细胞癌中的表达与临床特征的关系
2.3HMMR是肝细胞癌的独立预后因子 本研究采用单因素及多因素COX回归分析HMMR对预后的预测价值。单因素回归分析结果显示,TCGA和ICGC数据库中HMMR高表达是预后不良的危险因素(HR=1.15、1.19;P<0.001)。多因素回归分析结果显示,TCGA和ICGC数据库中HMMR高表达是预后不良的危险因素(HR=1.80、2.56,P<0.001)。
2.4GSEA 采用GSEA方法,共发现12条通路富集在HMMR高表达患者中,包括RNA 降解、DNA复制、P53信号通路、癌症通路、凋亡通路等,见表1。

表1 HMMR的高、低表达数据集与肝细胞癌发生发展相关的信号通路
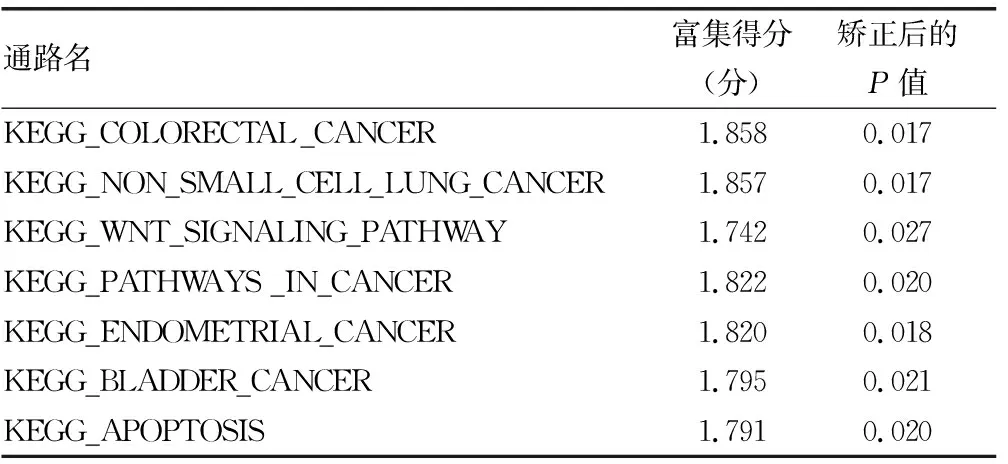
续表1 HMMR的高、低表达数据集与肝细胞癌发生发展相关的信号通路
3 讨 论
肝细胞癌是最常见的恶性肿瘤之一,患者的预后一般较差,在全球癌症相关死亡的主要原因中排名第二[6]。虽然肝细胞癌的治疗在过去几十年里取得了快速的发展,包括从手术和局部治疗到分子靶向治疗以及免疫治疗等,但预后情况一直不乐观[7]。因此,阐明肝细胞癌发生、发展的分子机制,以及发现新的治疗靶点,完善治疗方案势在必行。
随着高通量测序技术的发展,近年来越来越多的研究者运用高通量方法来探索与疾病发生和预后相关的潜在分子标志物[8-9]。毛丽萍等[10]的研究表明,血浆Dickkopf同源物1(DKK1)对肝细胞癌的诊断有一定价值,并可作为甲胎蛋白(AFP)的有效补充。HAN等[11]在3个独立的数据集中验证了SAC3D1在肿瘤组织异常高表达,并且通过生存分析及多因素分析表明其是肝细胞癌的独立预后因子。LIANG等[12]在两个独立的数据集中通过单因素COX回归及最小绝对收缩和选择算法构建了10个基因的预测模型,用于肝细胞癌患者的预后评估。本研究从TCGA和ICGC数据库中获得609例患者的信息来评估HMMR在肝细胞癌中的预后价值,在TCGA和ICGC数据库中,HMMR表达水平在肝细胞癌晚期上升,提示较高的HMMR水平对肝细胞癌的进展有不利影响,并且单因素和多因素COX回归分析表明,HMMR是肝细胞癌的独立预后因子。
有研究表明,HMMR编码的蛋白质是透明质酸介导的运动受体,当透明质酸与HMMR结合时,包括PTK2/FAK1在内的许多蛋白质就会发生磷酸化,HMMR与肿瘤的发生过程相关,是多种肿瘤的易感基因,其在肿瘤进展中的作用通常归因于透明质酸介导的信号传导[13]。HMMR也可能参与细胞转化和转移的形成,以及调节细胞外调节激酶(ERK)的活性。YANG等[14]研究结果表明HMMR可能调控膀胱癌的多个通路,并且其在肿瘤组织中的异常高表达是膀胱癌的无病生存期的特异性预后标志物。本课题组前期结果也表明HMMR在肝细胞癌的发生、发展中具有一定作用,并对预后有影响[5]。
已有研究显示,P53信号通路在维持基因组稳定性和保真度上扮演着重要角色,并且影响着细胞的代谢和衰老,在多种肿瘤的发生和发展中都起着非常重要的作用[15]。Wnt 信号通路是胚胎发育过程中的关键传导通路,并且在调节组织稳态方面也起着重要作用,Wnt 信号通路的异常激活与许多肿瘤的发生相关[16]。本研究通过GSEA分析表明在HMMR高表达患者中,P53信号通路、Wnt信号通路、DNA复制及细胞凋亡通路被显著富集。这些结果说明HMMR可能在肝细胞癌的P53及Wnt信号通路激活中起着重要作用。
综上所述,本研究结果显示,HMMR在肝细胞癌肿瘤组织中显著高表达,且其表达水平与肝细胞癌的疾病进展相关。此外,HMMR在肝细胞癌肿瘤组织中表达水平越高,其预后越差,且HMMR可以独立于其他临床因素作为肝细胞癌的预后因子。
