三亚湾沙滩小型底栖动物时空异质性及影响因素*
2022-06-29李亚男庞富广宋迎春慕芳红
李亚男,庞富广,臧 瑜,张 烨,宋迎春,慕芳红
(中国海洋大学 海洋生命学院,青岛 266003)
引 言
小型底栖动物(meiofauna)一般定义为能够通过500 μm孔径网筛,而被40~64 μm(近年来沙滩研究多用31 μm)孔径网筛截留的后生动物,主要包括自由生活线虫(以下简称线虫类),底栖桡足类(以下简称桡足类),涡虫类等主要类群,还包括大型底栖动物(如多毛类、双壳类)的幼体[1]。小型底栖动物因其种类多、丰度大、生活周期短等特点,在底栖生态系统中发挥重要作用[2-4]。另外,小型底栖动物不仅是底栖小食物网中重要一环,也是高营养级的食物来源,是鱼、虾和贝类幼体阶段的优质饵料,控制着大型经济无脊椎动物幼体的补充[5-9]。
潮间带(intertidal zone)是海洋和陆地之间的过渡地带,其环境(温度、盐度、暴露时间、沉积物粒度分布等)梯度变化明显,生境高度多样化,与人类活动休戚相关。潮间带生态系统的保护和监测,以及潮间带生物资源的利用,一直是海洋生态研究和海岸带管理的主要课题。沙滩是典型的由砂和波浪能等物理因素驱动的潮间带生态系统[10]。砂质滩一度被认为是“生态沙漠”,但实际上它拥有独特的砂间生物群落,栖息着多种多样的底栖动物[11]。当前砂质潮间带面临着人类扰动和全球变化的双重威胁,特别是海平面上升和海岸侵蚀、海洋表层的暖化和酸化,将在大尺度上深刻地改变其生态系统结构、功能和生物多样性[12]。
三亚湾位于我国海南省三亚市天涯区,是三亚最富盛名的海湾之一,是知名的旅游景点,毗邻地区具有完善的工业体系。近些年,随着三亚市社会经济的增长,旅游业的开发和港口运输的发展,三亚湾近岸海域环境质量受到一定的负面影响[13]。现有的三亚湾海洋生物资源调查研究,多关注海域初级生产力、浮游动植物及细菌的分布特征[14-20],或是珊瑚礁[21-24]和红树林[25-29]生态系统相关的资源利用及环境保护方面,对沙滩底栖动物的研究几近空白,小型底栖动物的相关研究目前仅见于Hua等[30]在2011年1月对三亚湾沙滩的一次性调查,缺乏季节动态研究。另外,李亚芳等[31]开展了底质类型对三亚湾潮间带大型底栖动物生态功能的调查研究,未涉及小型底栖动物。
本研究选取三亚湾沙滩带为采样地点,对其环境因子、小型底栖动物的丰度和生物量以及群落结构进行分析,研究小型底栖动物丰度、生物量和群落的时空异质性及其与环境变量的关系,研究结果可为沙滩小型底栖动物的深入生态学研究提供基础数据,也可为全球气候变化背景下沙滩的保护、开发和利用提供科学依据。
1 采样地点、材料与方法
1.1 采样地点
本研究在海南省三亚市三亚湾沙滩(109°29′38″E,18°15′17″N)进行野外调查采样,具体采样地点如图1所示,采用Surfer 15.0软件绘制。

图1 三亚湾沙滩采样点
1.2 采样与分析方法
先后于2015年12月(冬季)和2016年6月(夏季)在三亚湾沙滩进行采样,在所研究的沙滩选取了两个断面,间隔约100 m;在每个断面的高、中、低潮区各设1个采样点,进行小型底栖动物和环境因子样品的采集,并在每个采样点使用多参数水质仪(In-Situ Inc, Smartroll MP)进行间隙水的温度、pH值、盐度和溶解氧含量的原位测定。文中用字母H、M、L分别代表高、中、低潮区,如“H1”表示断面1高潮带,“H1-6”表示2016年6月的断面1高潮带,“H1-12”表示2015年12月的断面1高潮带,此缩写规律在图表中适用。
2015年12月进行的野外采样使用内径4.4 cm的PVC采样管,因PVC管易为砾石破损,2016年6月进行的野外采样均采用内径4.8 cm的不锈钢管。用取样管在每个采样点随机取3个重复芯样用于小型底栖动物的研究,沉积物芯样长20 cm,芯样采出后立即装入500 mL样品瓶中,用5%的甲醛溶液固定,虎红染色。样品分选采用倾上浮液淘洗法,即将上浮液过孔径分别为500 μm和31 μm的两层网筛,共淘洗6次,将31 μm孔径网筛上的生物转移到划线培养皿中,在解剖镜(Motic SMZ-168)下分类计数。每个采样点另采两管20 cm长的沉积物芯样装入塑料封口袋中,-20 ℃冷冻保存,用于含水量、粒度、有机碳含量、叶绿素a(Chl-ɑ)含量等环境因子的测定。其测定按照《海洋调查规范》[32]规定方法进行。
1.3 数据处理与分析
生物量的估算采用各类群丰度值乘以相应类群的平均个体干重经验值的方法,小型底栖动物各类群的平均个体干重参照Juario等[33]、Widbom等[34]和张志南等[35]的研究结果,其中桡足类的平均个体干重按McIntyre[36]的研究结果,具体见表1。
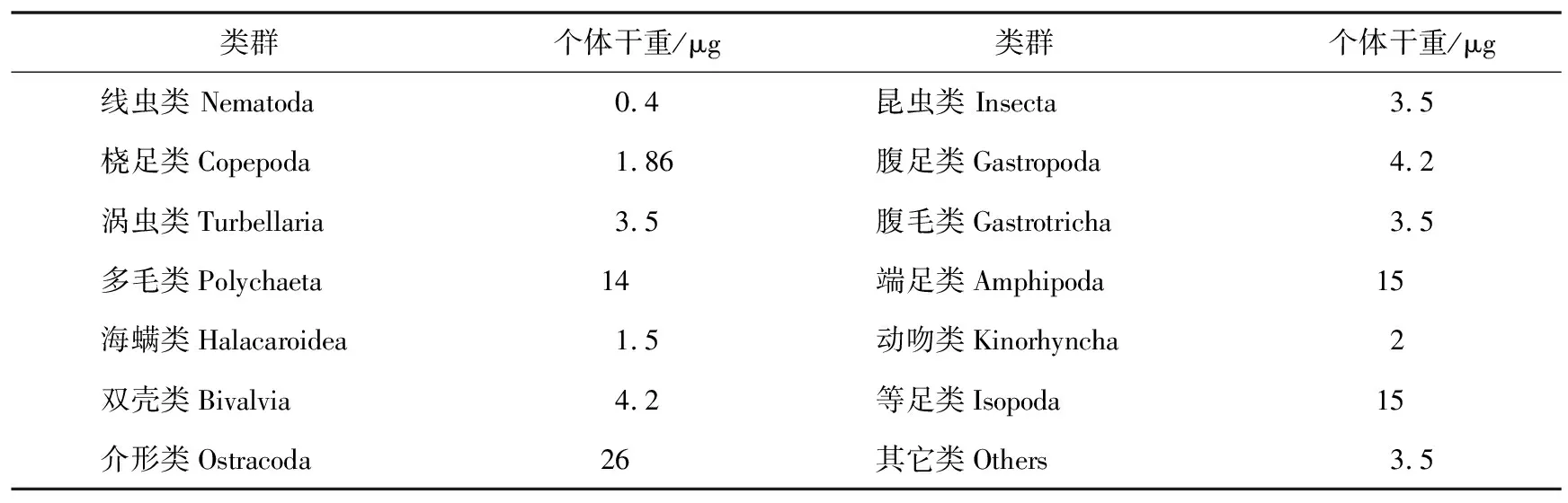
表1 小型底栖动物各类群的平均个体干重
应用SPSS17.0软件对生物数据和环境因子数据进行方差分析和相关性分析,若方差不齐,则采用非参数检验。小型底栖动物群落与环境因子的相关分析使用多元统计分析软件包PRIMER 6。
2 结果与分析
2.1 环境因子
三亚湾沙滩环境因子的测量分析结果详见表2。One-way ANOVA分析结果显示,三亚湾沙滩间隙水温度、pH值、有机碳含量和Chl-ɑ含量均存在极显著季节差异(p<0.01),间隙水温度、pH值表现为夏季高于冬季,有机碳含量冬季低于夏季,Chl-ɑ含量表现为冬季高于夏季;溶氧量在不同潮区间存在极显著差异(p<0.01),表现为高潮带高于中、低潮带;间隙水盐度在不同沙滩、季节、潮区间均无显著差异。

表2 采样点环境因子
三亚湾沙滩间隙水平均温度28.18±2.50 ℃,pH值平均为7.98±0.22;间隙水的盐度在25.3~37.8之间波动;年平均有机碳含量为0.05±0.03%,均低于国家沉积物质量一类标准(2%)。三亚湾沙滩年平均Chl-ɑ含量为0.36±0.30 μg/g;平均溶氧含量为4.33±1.46 mg/L。
三亚湾沙滩以中砂和细砂为主,粉砂及黏土的平均含量不足1%。MDΦ变化范围为2.18~0.46,均为正值;QDΦ平均值为0.78±0.30,变化范围为0.19~1.34;偏态系数SKΦ平均值为0.01±0.33,多数为正偏态。

注:圆心集中的环境因子为pH、有机碳含量、砾、极粗砂、粗砂、中砂等。图2 环境因子PCA分析结果
对三亚湾的环境因子数据进行PCA分析,结果如图2所示。分析结果显示,2个排序轴保留的信息量占总信息量的90.5%;对主成分1贡献较大的变量依次是间隙水盐度、温度、MDΦ、QDΦ、溶氧量等;对主成分2影响较大的变量依次是间隙水温度、盐度、溶氧量、Chl-a含量、间隙水pH等。
对环境因子数据按不同季节进行分组检验,ANOSIM分析显示冬夏两季之间环境因子存在显著差异(R=0.99,p<0.01),进一步的SIMPER分析显示,造成二者差异的主要环境因子为间隙水温度、MDΦ、SKΦ、粉砂及粘土含量等。
2.2 小型底栖动物分布的时空异质性
2.2.1 小型底栖动物的类群组成
本研究共鉴定出12个小型底栖动物类群:线虫类、桡足类、涡虫类、多毛类、腹毛类、寡毛类、缓步类、双壳类、介形类、海螨类、昆虫类以及无节幼体。表3为小型底栖动物主要类群的平均丰度和生物量以及百分比组成。其中,线虫类丰度最高,桡足类次之,丰度依次为186.62±259.05 ind·10 cm-2、19.82±2.62 ind·10 cm-2;线虫类生物量最高,其次为涡虫类,生物量依次为62.72±87.07 μg·dwt·10 cm-2、35.60±42.23 μg·dwt·10 cm-2。
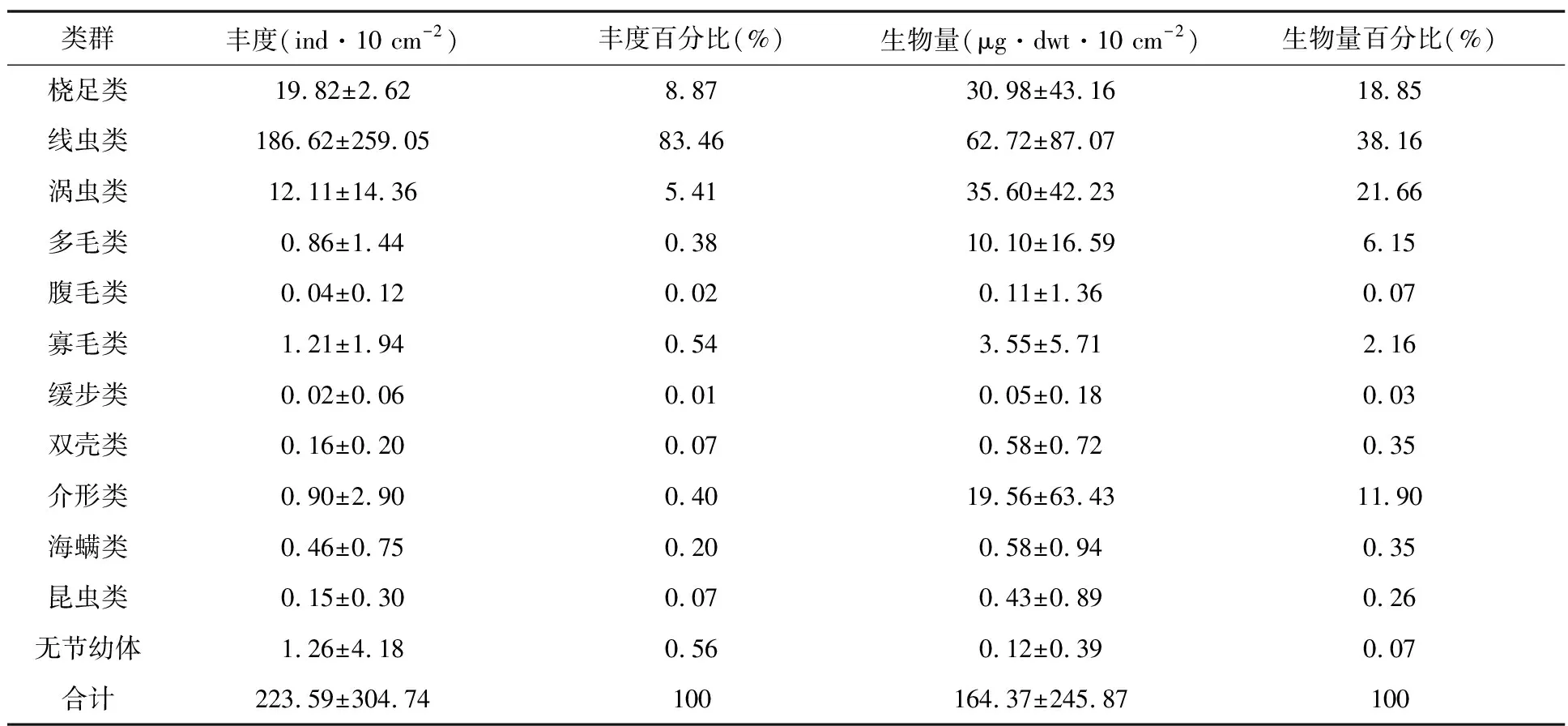
表3 小型底栖动物主要类群的平均丰度和生物量及百分比组成
2.2.2 小型底栖动物的丰度及生物量的时空分布
小型底栖动物的平均丰度为223.59±304.74 ind·10 cm-2,平均生物量为164.37±245.87 μg·dwt·10 cm-2,其丰度和生物量的时空分布见图3。

图3 小型底栖动物丰度和生物量的分布
夏季小型底栖动物平均丰度为75.38±34.07 ind·10 cm-2,最高值出现在中潮带。线虫类相对丰度最高,为66.26%,其次是桡足类和涡虫类,相对丰度分别为19.24%和12.21%。在低潮带桡足类为最优势类群(平均丰度为25.10 ind·10 cm-2;相对丰度为40.32%);在高、中潮带线虫类是最优势类群(高潮带线虫类平均丰度为49.11 ind·10 cm-2,相对丰度为87.69%;中潮带线虫类平均丰度为81.01 ind·10 cm-2,相对丰度为75.11%)。夏季小型底栖动物平均生物量为5.90±11.88 μg·dwt·10 cm-2,各潮区之间差异不显著。
冬季小型底栖动物的平均丰度为371.80±375.02 ind·10 cm-2,最高值也出现在中潮带。线虫类相对丰度也最高,为86.95%,其次是桡足类和涡虫类,相对丰度分别为6.76%和4.04%。线虫类在各潮带均是最优势类群(高潮带线虫类平均丰度为294.64 ind·10 cm-2,相对丰度为92.91%;中潮带线虫类平均丰度为594.66 ind·10 cm-2,相对丰度为83.73%;低潮带线虫类平均丰度为80.57 ind·10 cm-2,相对丰度为91.46%);桡足类丰度在中潮带最高(中潮带平均丰度为58.65 ind·10 cm-2,相对丰度为8.25%);涡虫类丰度在中潮带也最高(中潮带平均丰度为35.07 ind·10 cm-2,相对丰度为4.94%);其他类群的丰度无潮区差异。冬季平均生物量为30.98±127.09 μg·dwt·10 cm-2,各潮区之间差异不显著。
对小型底栖动物丰度和生物量进行非参数检验分析(见表4),结果表明:小型底栖动物丰度在潮区间、断面差异均不显著;在不同季节差异极显著(p<0.01),变化趋势为12月>6月。其生物量在不同断面、不同潮区之间差异均不显著,但在不同季节差异显著(p<0.05),变化趋势为12月>6月。

表4 小型底栖动物丰度和生物量非参数检验分析结果
2.2.3 小型底栖动物的群落结构和多样性分析
对潮区、断面和季节三个因素进行ANOSIM分析,结果显示三潮区间和两断面间均无显著差异,季节间差异显著(R=0.169,p<0.05)。聚类分析结果如图4所示:冬季除了断面2的低潮带,其余都聚为一组;而夏季各采样点未聚为一组,尤其是夏季断面1的低潮带与其他各采样点差别较大。

图4 小型底栖动物类群丰度聚类分析结果
对小型底栖动物类群多样性数据(表5)进行非参数检验分析表明S值在季节间差异不显著,J′值、H′值及Simpson指数1-λ′在不同季节间差异极显著(p<0.01),d值在不同季节间差异显著(p<0.05),变化趋势为6月>12月;多样性指数在不同断面、潮区间差异均不显著。
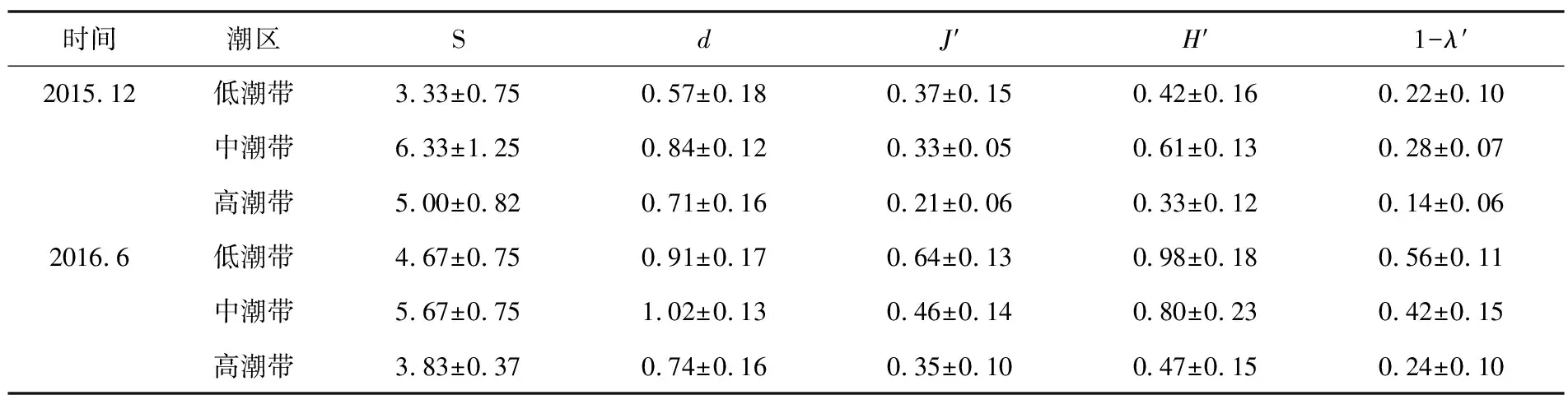
表5 小型底栖动物生物多样性分析结果
2.3 小型底栖动物丰度与环境的关系
小型底栖动物总丰度、线虫类和桡足类丰度与各环境因子的Pearson相关分析结果如表6所示,小型底栖动物丰度与中砂和粉砂-粘土含量显著相关。对生物和环境因子进行BIOENV分析,结果表明间隙水温度、pH值、有机碳含量、分选系数和粗砂含量的环境因子组合能最好的解释三亚湾沙滩小型底栖动物的群落结构,其相关系数为0.471。

表6 小型底栖动物及优势类群丰度与沉积物环境因子的相关分析结果
3 讨论
本论文研究了三亚湾沙滩小型底栖动物丰度、生物量和群落的时空变化及其与环境变量的关系。结果表明小型底栖动物的丰度、生物量、多样性和类群组成存在显著的季节变化,但空间异质性不明显。
小型底栖动物的分布可受物理、化学和生物因素的影响,如沉积物粒度特征、叶绿素含量、水温、盐度、季节以及自身繁殖特点等[37]。本研究结果显示,三亚湾沙滩夏季和冬季的沉积环境存在显著差异,造成差异的主要环境因子为温度和沉积物粒径参数。同时本研究结果也表明所测的诸多环境因子中温度和沉积物粒径等环境因子与小型底栖动物之间的相关性较强。钱振明等[38]认为温度低于15 ℃或高于30 ℃均不利于藻类细胞生长。本次调查中,冬季间隙水温度相对夏季较低(24.90~27.76 ℃),但适于底栖微藻生长,沉积物中Chl-α含量较高,可为小型底栖动物提供较多的食物,因此在冬季小型底栖动物具有较高的丰度;夏季则相反,间隙水温度较高(29.98~30.76 ℃),在30 ℃左右,温度较高可能不利于底栖微藻的生长,沉积物中Chl-α含量较低,小型底栖动物总丰度比冬季低。三亚湾沙滩冬季沉积物粉砂及粘土含量高而粗砂含量低,可能更有利于线虫类的生存。夏季粉砂及粘土含量低而粗砂含量高,其沉积环境较冬季可能更适于桡足类和涡虫类的生存,这两个类群丰度占比均高于冬季,小型底栖动物的类群组成与冬季有明显的区别。
将本研究中小型底栖动物及主要类群丰度与世界上其他热带地区砂质潮间带的研究结果进行比较表明,即使同属热带,不同地区小型底栖动物的丰度存在较大差异(表7)。尽管不同研究地点受人为扰动情况、采样、分选方法的差异等可能对研究结果有一定的影响,但总体上三亚湾沙滩小型底栖动物的丰度处于相对较低的水平。此外,在热带沙滩,桡足类在小型底栖动物群落中的相对丰度都较高,甚至远远超过线虫类。
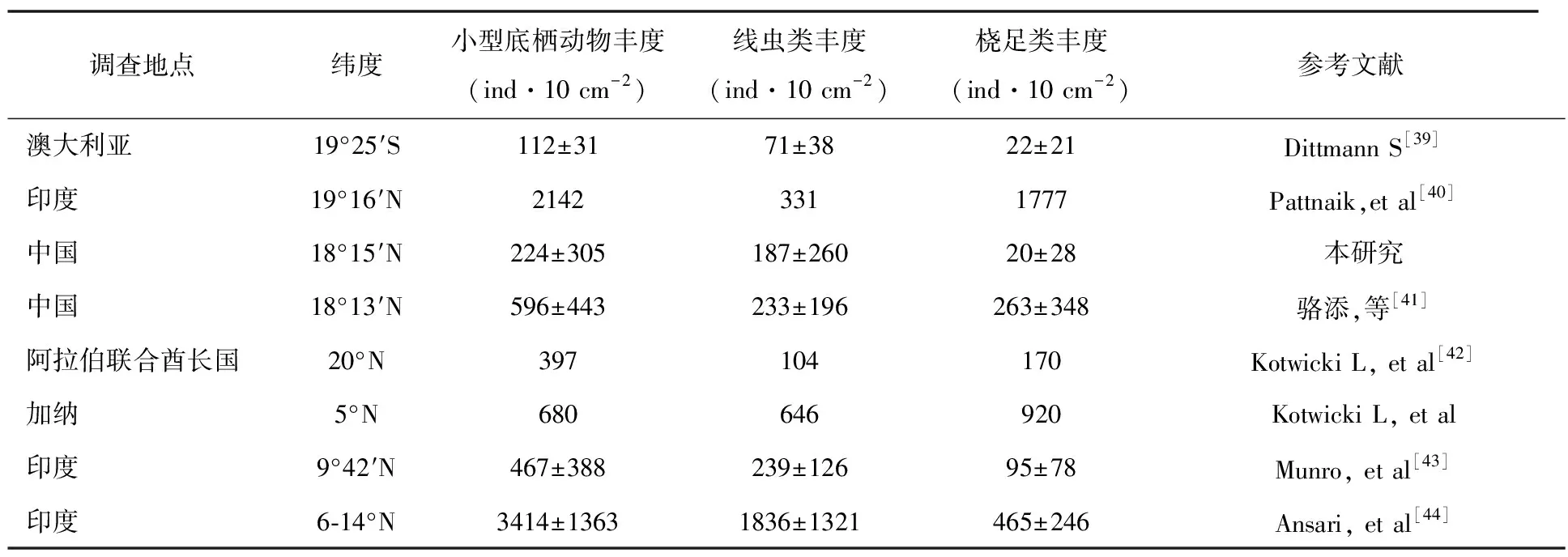
表7 不同潮间带小型底栖动物及主要类群丰度比较
将本研究与世界上其他热带地区砂质潮间带[39-40,42-44]的研究结果进行比较表明:沉积物粒径、食物及间隙水理化因素等环境特征是影响砂质潮间带小型底栖动物丰度差异的主要因素。Dittmann等人[39]于4月在澳大利亚测得沙滩有机碳含量在为1.0%,在9月测得沙滩有机碳含量为1.2%,均明显高于三亚湾有机碳含量;Pattnaik等人[40]在文章中指出,该采样地点沙滩沉积物主要是分选良好的中砂,且沙滩具有一定的排水性,利于小型底栖动物生存;骆添等人[41]在三亚大东海砂质潮间带测量所得叶绿素含量和有机碳含量均高于本研究;Kotwicki等人[42]研究的阿拉伯联合酋长国和加纳采样点相比较于本研究,生境复杂性高(其研究地点为沿海中等水位,而本研究为沙滩)导致丰度差异大;Ansari等人[44]研究结果表明沉积物粒径为粗砂,更适宜桡足类生存(桡足类丰度高于线虫类)。并且该研究中小型底栖动物因为底下水位和食物的因素,导致其分布于沙滩最上层,导致丰度相对较高。另外,人类扰动、采样、分选方法的差异等也可能是影响小型底栖动物丰度的主要因素之一。三亚是著名的旅游城市,相比较于其他热带城市[39-40,42-44]的采样点,受人类扰动较大,从而导致小型底栖动物丰度较低。同时,本研究采样深度为20cm,样品分选先后通过500 μm和31 μm的两层网筛,与其他热带城市略有不同。例如,Dittmann等人[39]在澳大利亚采样的深度虽然也是20 cm,但样品分选是先后通过125 μm、80 μm和65 μm的三层网筛;Kotwicki等人[42]研究样品分选先后通过100μm和38μm的两层网筛;而Munro等人[43]在印度沙滩进行测点采样的深度要明显深于本研究,为30 cm(77号站)和40 cm(87号站)。
将本研究与中国海砂质潮间带小型底栖动物的历史研究数据[45-52]比较发现,三亚湾小型底栖动物的丰度处于相对较低的水平,与Hua等[30]得出的亚热带潮间带小型底栖动物丰度通常低于温带的规律一致。但是,与Hua等2011年1月在三亚湾沙滩调查结果[30]相比,本研究区小型底栖动物的丰度更低,各类群丰度占比情况也有很大不同。将三亚湾沙滩2011年和本次调查的环境因子数据进行比较发现,本研究中沉积物MDΦ值较低,间隙水温度、溶氧量、盐度及沉积物有机碳含量等要高于Hua等的调查结果,且不同潮区的空间变化规律也不尽相同。考虑到两次调查采样点的设置和月份的差异,且两次调查时间间隔较长等因素,尚不能推测造成两次调查结果差异的具体因素。受全球气候变化的影响,以及近年来三亚湾周边开发和旅游强度的不断增加,人类的污染和扰动有可能是造成两次调查差异的可能原因之一。未来工作中,应加强对典型沙滩生态系统的长期的系统监测,为全球气候变化背景下沙滩的保护、开发和利用提供科学依据。
