水稻种子成熟后期高湿环境下种子休眠相关基因的表达
2022-06-29董袁袁王伏林顾娜娜
董袁袁,徐 恒,张 华,张 恒,王伏林,顾娜娜,朱 英,*
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004; 2.浙江省农业科学院 病毒学与生物技术研究所,农产品质量安全危害因子与风险防控省部共建国家重点实验室,浙江 杭州 310021)
种子萌发是植物生命周期的第一个关键步骤,种子萌发从种子吸胀开始,到种皮出现胚根时结束。穗发芽(pre-harvest sprouting,PHS)是水稻、玉米、小麦等农作物在种子成熟后期遇到连续阴雨天气,导致种子在穗子上萌发的现象。由于农业生产上栽培的水稻品种休眠较短或者不明显,如果在灌浆后期遇到高温多雨天气,更易出现穗发芽的现象。穗发芽使农业生产遭受了严重损失,全球每年因穗发芽造成的损失超过10亿美元。在我国南方地区,因为夏季连续的高温阴雨天气较多,穗发芽更是水稻生产上的一个非常严重的问题。另外,杂交稻在制种过程为解决不育系包颈问题,大量使用赤霉素,穗发芽现象就更为严重。其次,穗发芽的谷物具有较高的氧化还原酶和水解酶活性,导致种子中的储藏物质提前分解,非常容易造成水稻品质变劣。穗发芽不但影响水稻产量,还严重危害稻米品质。因此,穗发芽问题迫切需要加以遏制。
穗发芽的调控机制非常复杂,受到多种遗传因素和环境因素控制。遗传因素主要包括种子成熟度、α-淀粉水解酶活性、内源激素平衡、可溶性糖含量等,环境因素主要有温度、湿度和光照等。种子休眠受多种植物激素的调控,脱落酸(abscisic acid,ABA)和赤霉素(gibberellin,GA)是其中最重要的2个激素。ABA和GA在种子成熟、休眠和萌发过程中存在相互拮抗作用,ABA可以抑制种子萌发,诱导种子进入休眠状态;而GA则通过打破种子休眠,进而促进种子萌发。除了ABA和GA外,近年来,人们发现其他植物激素,例如乙烯(ethylene,ETH)、油菜素内酯(epibrassinolide,BR)、细胞分裂素(cytokinin,CTK)和生长素(Auxin,IAA)等也参与调控种子休眠。α-淀粉酶活性和后熟时间也可以反映穗发芽的水平。穗发芽谷物的籽粒中α-淀粉酶活性通常较高,且后熟时间较早。当α-淀粉酶活性提高时,籽粒内部的淀粉会提前分解,进而使种子内可溶性糖等物质的含量增加,促进种子萌发。光照、温度和湿度等环境因素也是控制种子休眠与萌发的重要因素。红光通过光受体光敏色素可促进拟南芥种子萌发,而蓝光通过光受体隐花色素抑制大麦种子的萌发,绿光可以通过隐色素抑制大麦种子萌发。种子发育期间温度的变化强烈影响种子成熟时休眠的深度。温度主要在谷类作物的成熟阶段和萌发阶段影响穗发芽。近年来,极端天气的频繁发生,导致水稻在成熟季节经常出现间歇性的高温或者低温。一般来说,籽粒成熟后期温度越高,休眠期就越短,高温下(>26 ℃)发育的小麦籽粒休眠程度低或者无休眠;而低温则会导致谷物休眠加剧。湿度对种子休眠也有一定的影响,在成熟期低休眠或者无休眠的种子,如果空气湿度较大(相对湿度70%以上),籽粒就会在穗上长出胚根胚芽,从而形成穗发芽。
目前,大部分的研究都是关于高温多雨的环境导致穗发芽,而关于多雨潮湿影响穗发芽的分子机制却很少有研究。本研究在水稻成熟后期,通过高湿处理模拟持续阴雨条件,研究高湿条件下种子休眠相关基因的表达调控,为后续研究水稻穗发芽提供标记基因,为研究水稻种子休眠和萌发的分子调控机制提供参考。
1 材料与方法
1.1 材料
以粳稻(L.)DongJin(DJ)为材料。水稻材料种植在浙江省农业科学院试验田。
1.2 处理方法
在孕穗期选取60株长势一致的植株,带泥挖取,避免伤根,移入方桶中,每桶栽2株,在人工气候室中培养。生长条件:12 h光照/28 ℃,12 h黑暗/22 ℃,相对湿度为60%,光量子通量密度为600 μmol·m·s。将开花后水稻进行标记,并分别选取开花后26、28、30、32 d(分别标记为DAP26、DAP28、DAP30、DAP32)的水稻植株,用透气不透水的无纺布袋包裹水稻植株防止水分挥发,每3 h喷水1次,每桶水稻喷水500 mL,共处理5 d。观察穗发芽情况。
1.3 RNA提取与cDNA获得
选取开花后30 d的水稻种子进行高湿处理,分别在处理后1、6、12、24、48、72、96、120 h取材,每个时间点取标记好的籽粒30粒,每个时间点设置3个独立的生物学重复。
水稻种子总RNA的提取使用通用植物RNA提取试剂盒(BioTeke,China),提取的总RNA用TURBO DNA-free kit(Invitrogen,USA)消化残留的基因组DNA。采用Beckman DU730分光光度计(Beckman,USA)测定RNA质量和浓度,并用1%琼脂糖凝胶电泳检测RNA的完整性。第一链cDNA合成使用Goscript Reverse Transcription system反转录试剂盒(Promega,USA)。
1.4 实时荧光定量PCR(qRT-PCR)
qRT-PCR使用FastStart通用SYBR Green Master(Roc he Switzerland)在QuantStudio 12k Flex RealTime PCR系统(Applied Biosystems,USA)上进行。qRT-PCR反应体系:0.5 μL cDNA,4 μL RNase-free water,5 μL 2×FastStart Universal SYBR Green Master mix,上下游引物(10 μmol·L)各0.25 μL,总体系共10 μL。反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 60 s,40个循环。qRT-PCR均设置3次生物学重复和3个技术重复。以水稻10为内参基因,基因相对表达量采用2法计算。qRT-PCR使用引物信息见表1。

表1 qRT-PCR所用引物
2 结果与分析
2.1 高湿环境中种子穗发芽表型
为了研究水稻种子成熟度与穗发芽的关系,对开花后不同时间(DAP26、DAP28、DAP30、DAP32)的粳稻(Dongjin以下简称DJ)种子进行人工高湿处理(图1-A)。从图1-B可以看出,对于DJ种子来说,虽然胚在开花后20 d左右已经成熟,但是最早在开花后28 d进行高湿处理种子才能有少量萌发,开花后30 d及以上的种子经过高湿处理才能诱发明显的穗发芽,而开花后26 d的种子即使在高湿处理下也基本不萌发,说明种子的成熟度是诱发种子穗上发芽的一个关键因素。

A,高湿处理的水稻;B,高湿处理后种子萌发情况。
2.2 高湿处理对ABA合成代谢基因的影响
从图2可以看出,对于ABA合成过程中的限速酶基因来说,高湿处理1 h,1、2和3开始受到明显抑制,抑制作用一直持续到72 h;而4基因的表达在高湿处理早期没有明显规律;4个基因在高湿处理后期(72 h或96 h以后)表达量都开始快速上升。高湿处理能迅速并持续诱导ABA降解基因的表达,尤其是81和83基因,它们在高湿处理1 h开始诱导表达,表达量分别是对照组的4.3倍和2.2倍,到96 h这2个基因的表达量是对照组的89倍和30倍。82基因表达与其他2个8基因相比,没有明显的变化规律,推测其受高湿环境影响较小。以上结果表明,高湿处理早期能迅速诱导ABA降解途径基因(81和83)的表达,并抑制ABA合成基因(1、2和3)的表达。
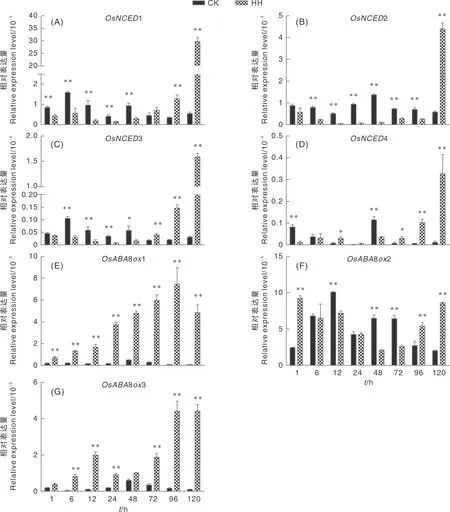
CK,对照组;HH,高湿处理。采用非配对t检验确定差异显著性,*表示P<0.05,**表示P<0.01。下同。
2.3 高湿处理对GA合成基因表达的影响
对于20基因来说,201基因表达量明显高于对照组,201基因表达在高湿处理1 h就受到诱导,在96 h表达量达到最高,是对照组的30倍以上(图3-A)。202基因的表达在高湿处理早期没有明显变化,直到处理72 h才上升(图3-B)。32基因在高湿处理12 h开始上升,并在96 h达到最高值,为对照组的800倍左右;而31基因表达在整个处理过程与其他GA合成基因的表达相比,变化相对较小,仅为对照组2倍左右(图3-C、D)。以上结果表明,高湿处理能明显诱导GA合成相关基因的表达,并且不同GA合成基因的响应速度和响应强度有差异,201和32能快速响应高湿环境,且其表达量受到强烈诱导。
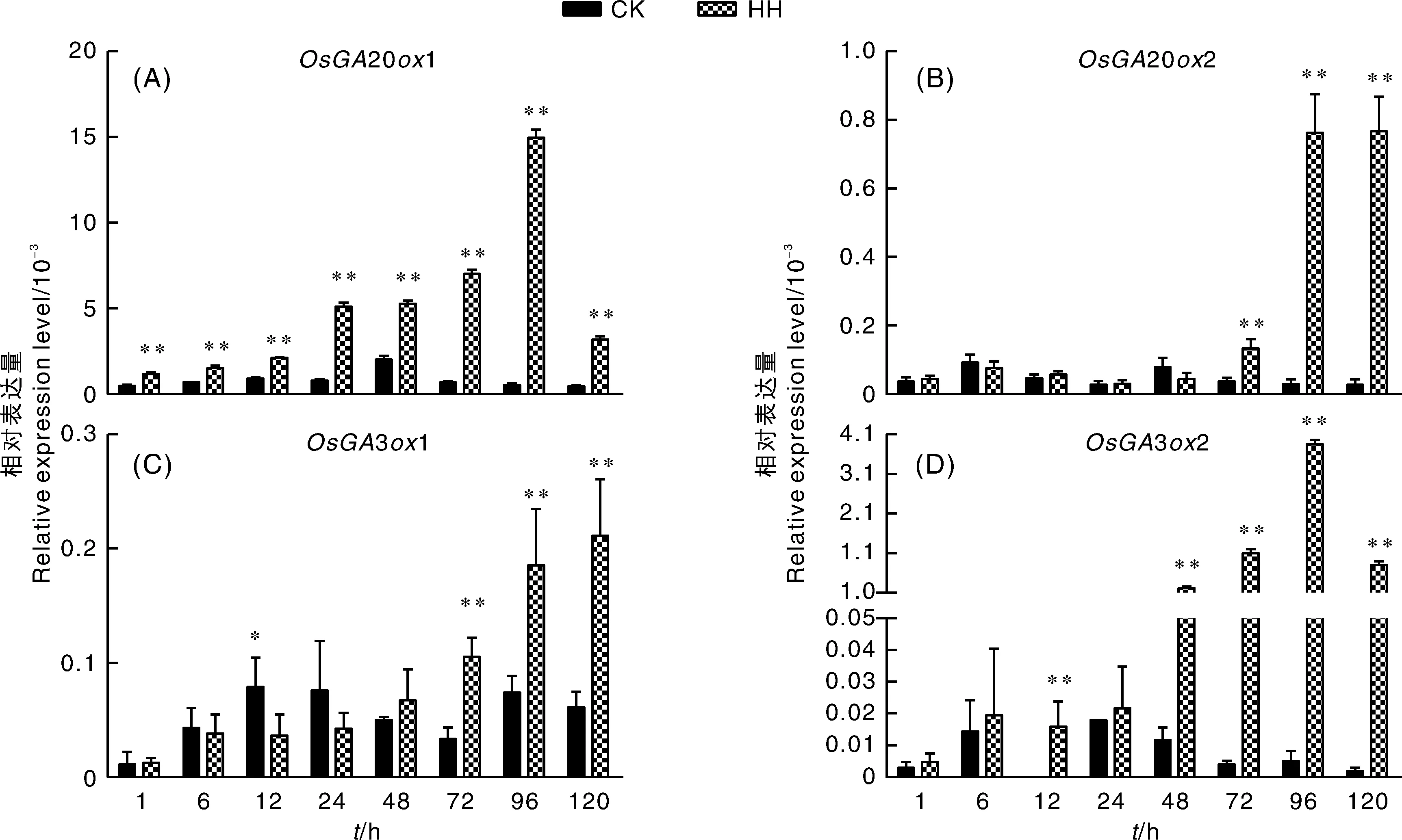
图3 高湿处理水稻种子中GA合成基因的相对表达量
2.4 ABA和GA前体合成基因在高湿处理下的表达模式
由图4可知,ABA前体合成基因、和的表达量在高湿处理前期变化较小,在高湿处理72 h后表达量才明显上升。2和1是GA前体合成基因,2与ABA前体合成基因具有相同的表达模式,即在高湿处理前期表达量变化不大,在高湿处理72 h明显上升。而1基因则在高湿处理前期受到抑制,在高湿处理96 h明显上升。因此,高湿处理前期对GA和ABA前体合成基因的表达影响较少,主要是在处理后期(72 h后)影响这些基因表达。而高湿处理72 h这一时间点,种子的萌发已基本完成,幼苗的生长即将开始,推测激素前体合成基因的表达与这些激素开始重新合成有关。

图4 高湿处理水稻种子中ABA和GA前体合成基因的相对表达量
2.5 ABA和GA响应基因在高湿处理下的表达模式
3、4和5基因的表达量在高湿处理前期变化不大,在高湿处理48 h开始缓慢上升,到96~120 h上升为对照组的4~7倍(图5)。ABA响应基因3和16的表达量在高湿处理早期(1 h和6 h)没有明显变化,12 h后开始明显下降,96 h后又开始上升,到120 h上升至对照组的5倍左右。GA信号响应基因和1的表达在高湿处理前期变化较小,处理24 h后表达量开始上升,96~120 h表达量可达到对照组的10倍以上。
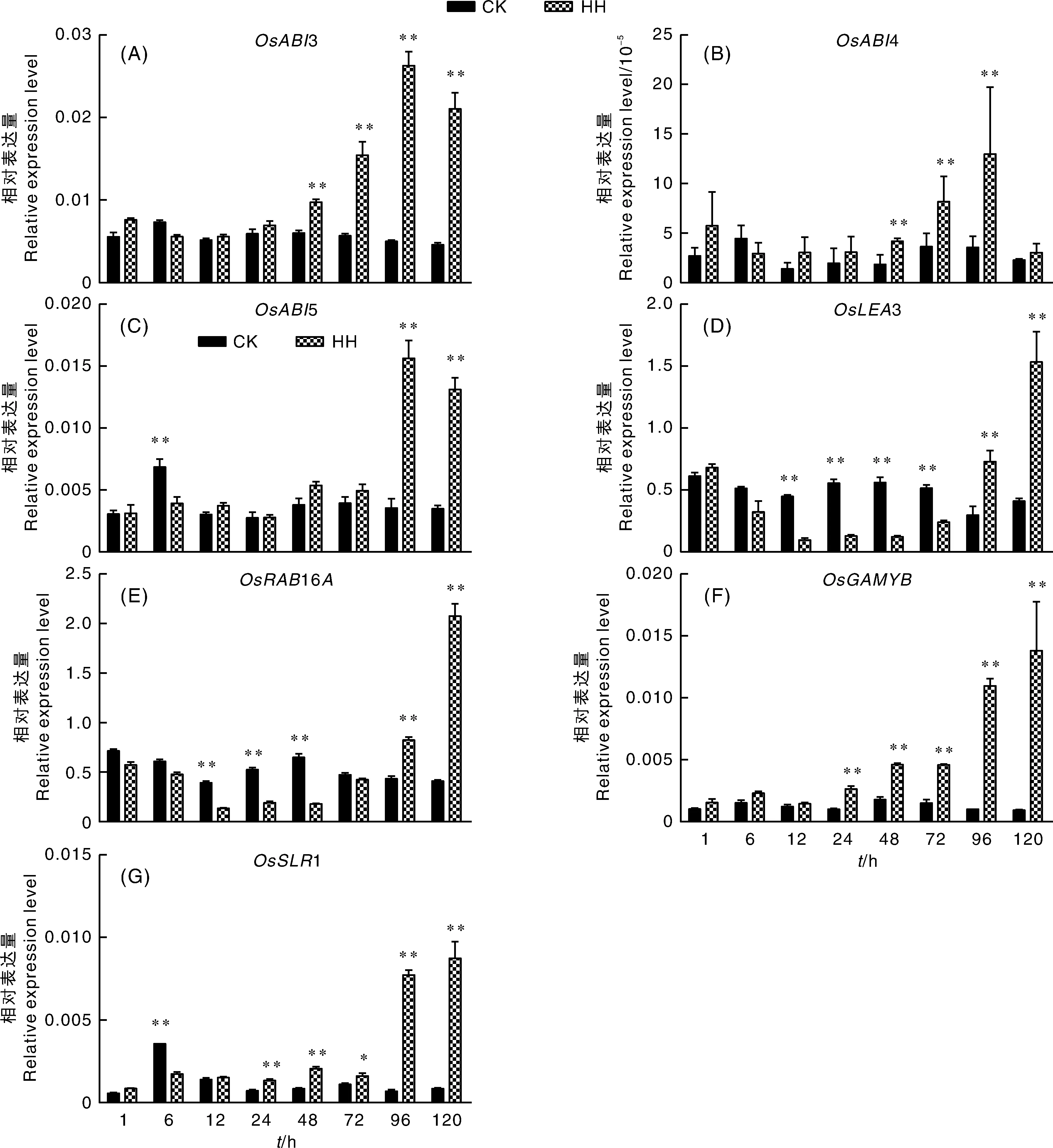
图5 高湿处理水稻种子中ABA和GA响应基因的相对表达量
2.6 淀粉水解酶基因在高湿处理下的表达模式
为了进一步研究高湿处理如何影响α-淀粉水解酶基因表达,检测了α-淀粉水解酶基因1、2、3、3、3、3和3在高湿处理下的表达模式。结果(图6)显示,1、3、3和3基因的表达量在高湿处理前期(1、6、12、24 h)没有明显的变化规律,在高湿处理中后期(72 h后)表达量急剧升高,为对照组的30倍以上。有意思的是,3是整个种子发育时期表达丰度最高的α-淀粉水解酶基因,但它在高湿处理前期的表达量先上升后下降,到72 h后表达量再次开始上升,是对照组的2倍左右,相对来说受高湿处理的影响较小。2基因表达量与上述1等4个淀粉水解酶基因相比,受高湿处理影响较小。3在高湿条件下的表达模式与其他α-淀粉水解酶基因均不同,它的表达受到高湿处理的抑制。
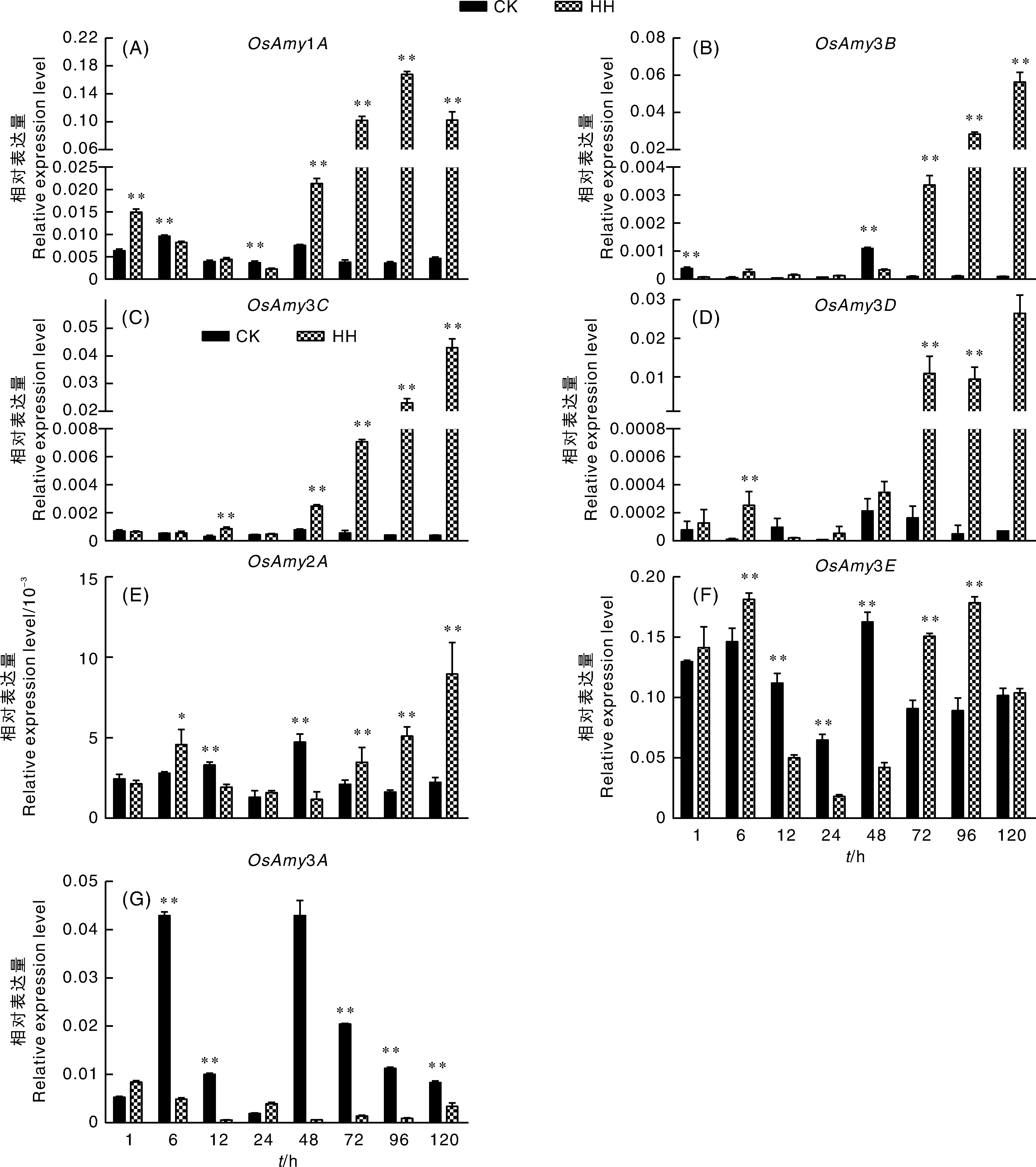
图6 高湿处理水稻种子中淀粉水解酶基因的相对表达量
α-淀粉水解酶基因在高湿处理下的表达模式可以大致分为3种模式,一种是高湿处理前期没有明显变化,而在高湿处理中后期(高湿处理48 h或72 h)表达量急速上升,例如1、3、3和3;一种是总体上高湿处理对其表达影响较小,例如2、3;最后一种是高湿处理下表达受到持续抑制,例如3。以上结果表明,1、3、3和3基因能快速相响应高湿处理,可能是在水稻种子穗发芽中起主要作用的α-淀粉水解酶基因。
3 讨论
水稻穗发芽一直是研究的热点话题。水稻穗发芽具有作物种子萌发的特征,但又区别于种子萌发,其过程更为复杂。ABA和GA在调控种子休眠过程中存在相互拮抗作用,并且种子中ABA和GA的比例是决定种子休眠还是萌发的关键因素,而ABA和GA比例的变化可以归因于关键激素代谢基因的差异表达。NCED是ABA生物合成过程中的限速酶,ABA8ox是ABA失活过程中的关键酶。本研究结果显示,高湿处理可以迅速促进ABA代谢基因8表达,并抑制ABA合成过程限速酶基因的表达。高湿处理能迅速并持续诱导ABA降解酶基因(81和83)的表达,相对来说,82基因表达量变化不大。另外1、2和3在高湿处理的早期和中期都受到明显抑制,而4的表达没有明显规律。这表明ABA降解途径基因(81、83)和ABA合成途径基因(1、2、3)能够快速响应高湿环境并参与调控穗发芽。
前人研究表明,水稻种子在吸胀萌发过程中,ABA降解途径基因8和ABA合成基因均快速上升,6 h达到最大,随后迅速下降;拟南芥中也发现类似现象;但本研究中ABA降解途径基因81和83基因能够快速并持续响应高湿处理,在高湿处理后期它们表达量也没有下降。另外,高湿条件下ABA合成基因表达受到快速抑制,72 h后才开始迅速上升,这与种子吸胀过程中表达模式也明显不同。这表明ABA合成代谢基因在持续阴雨导致的穗发芽与种子吸胀萌发过程中表达模式具有明显差异。因此,以往针对种子萌发过程中相关基因表达模式的研究并不适用于穗发芽过程。
对于ABA响应的下游基因3和16来说,其对高湿处理的响应慢于ABA合成代谢基因,高湿处理12 h它们表达量才迅速下降。因此,高湿处理能够迅速促进ABA降解途径基因并抑制ABA合成基因的表达,从而导致ABA含量迅速下降,然后抑制ABA响应基因的表达。ABA合成、代谢与响应基因在高湿处理后期(72 h或96 h后)表达量迅速上升可能是由于这个时期种子已经萌发进入幼苗生长阶段,开始重新合成ABA。
GA通过拮抗ABA促进种子萌发。GA合成基因(201、202和32)也能响应高湿处理,但是它们响应速度有所差别。201基因响应高湿处理速度最快,高湿处理1 h它的表达量就上升;其次是32,在高湿处理48 h时其表达量明显上升;最后是202基因,其表达量直到处理72 h才明显上升。与其他几个GA合成基因相比,31基因受高湿处理影响较小。本研究中,201除了能最快响应高湿处理,其表达丰度也最高,所以201可能是参与调控水稻穗发芽的最主要的GA合成基因。
f-胡萝卜素去饱和酶()、番茄红素去饱和酶()和类胡萝卜素异构酶()是ABA前体合成类胡萝卜素的关键基因。水稻中分离的与穗发芽有关的基因大多也是参与ABA前体合成类胡萝卜素生物合成途径的基因。内根-贝壳杉烯合成酶()、内根-贝壳杉烯氧化酶()是GA前体合成关键基因,催化GA合成的关键步骤。本研究中,对GA和ABA前体合成基因来说,在高湿处理早期,他们的表达模式比较类似,即在高湿处理前期相对于GA和ABA合成代谢基因的表达变化来说,它们表达变化相对较小,而在中后期才明显上升,这表明高湿处理首先是直接影响ABA和GA合成代谢基因的表达而不是它们的前体合成基因,这样才能迅速改变ABA和GA的含量,从而促进萌发。GA和ABA前体合成基因中后期才明显上升可能是由于高湿处理后期种子已经萌发,处于幼苗开始生长阶段,这些激素开始重新合成代谢。
在禾本科作物种子中,GA可以诱导α-淀粉水解酶基因的表达,ABA可能通过拮抗GA的作用从而抑制α-淀粉酶基因的表达。水稻中,α-淀粉水解酶将胚乳中淀粉水解为可溶性糖,为幼苗生长提供物质和能量。本研究中1、3、3和3基因在中后期(48 h或72 h)响应高湿处理,并且它们表达量迅速上升,因此,这4个α-淀粉水解酶基因可能是调控水稻穗发芽的重要基因。而2、3和3这3个α-淀粉水解酶基因与其他4个α-淀粉水解酶基因相比,受高湿影响较小或受高湿抑制,推测它们可能不参与穗发芽过程。另外,淀粉水解酶基因响应高湿处理要晚于ABA和GA合成代谢基因,ABA和GA合成代谢基因的表达量在处理1 h就迅速上调,而α-淀粉水解酶基因的表达量在处理48 h后才迅速上调,推测高湿处理首先迅速影响ABA和GA合成代谢基因表达,改变ABA和GA含量,随后通过提高GA/ABA比例,促进α-淀粉水解酶基因表达,最终水解淀粉,为种子萌发提供能量。
综上所述,高湿处理后,首先ABA降解途径基因(81和83)和GA合成基因(201和32)表达量迅速升高,同时ABA合成途径中关键基因(1、2和3)的表达受到抑制,导致种子中ABA含量大幅度降低,GA含量增加,ABA/GA下降,进而促进α-淀粉水解酶基因(1、3、3和3)的表达,从而促进种子萌发。本研究为环境因子(高湿)诱导的水稻穗发芽机制研究提供了一定的理论基础,挖掘的这些高湿响应基因可以作为水稻穗发芽研究的标记基因。
