非酒精性脂肪性肝病严重程度与氧化应激、SAA、CRP和脑动脉硬化的相关性研究*
2022-06-29杨跃青寇少杰
脂肪肝分为酒精性脂肪性肝病和非酒精性脂肪性肝病,NAFLD是指脂肪细胞在肝脏处积聚而发展为脂肪肝、脂肪性肝炎、肝硬化和肝纤维化甚至到癌变的过程
。目前NAFLD患者已经超过乙型肝炎患者,成为了我国第一大肝病。NAFLD与2型糖尿病、血脂异常、高血压和代谢类疾病的高发密切相关,且与心脑血管疾病的危险升高具有一定的相关性
。氧化应激是由于刺激而引起的氧化和抗氧化失衡的一系列反应状态
。肝细胞氧化应激、线粒体功能障碍、丙二醛(MDA)等过氧化物增多,可以导致肝细胞出现炎症、坏死甚至是纤维化
。同时氧化应激能够激活信号通路,介导血管壁发生一系列变化,影响了血管的正常结构和功能,从而促使动脉粥样硬化的发生和发展
。血清淀粉样蛋白A(SAA)和C-反应蛋白(CRP)是肝脏合成的急性反应蛋白,大量炎症因子的分泌能够启动肝细胞中的SAA 和CRP分泌,可以反应局部炎症的程度
。但目前仍未出现过NAFLD病情严重程度与氧化应激、SAA、CRP水平、脑动脉硬化相关性的报道。所以本研究观察不同程度NAFLD患者血清中的氧化应激,并分析氧化应激、SAA、CRP表达与脑动脉硬化的关系,旨在为脑动脉硬化的预防以及治疗提供参考。
1 资料和方法
1.1 研究对象 选取2018年1月到2020年1月消化内科诊断为NAFLD的患者227例,其中轻度NAFLD患者116例,中度NAFLD患者74例,重度NAFLD患者37例,并选49例为健康对照组,年龄为(50.88±8.94)岁。
现阶段在泰煤家园改造中居民参与有效性不高:主要表现为一是居民参与主体缺乏组织性;二是居民参与领域信息不对称;三是居民参与方式较为被动。
1.2 纳入标准 ①经CT检测确认为NAFLD患者(即符合规定CT诊断脂肪肝的依据为肝脏密度普遍降低,肝/脾CT值之比小于1.0),并依据《2017年美国肝病学会非酒精性脂肪性肝病诊疗指导》标准
及《非酒精性脂肪性肝病防治指南(2018更新版)》标准
,符合规定CT检测:肝/脾CT比值小于1.0但大于0.7者为轻度,<0.7但大于0.5者为中度,0.5者为重度NAFLD。
1.3 排除标准 ①男性摄入酒精量每周≥140 g,女性摄入酒精量每周≥70 g;②病毒性和酒精性肝炎以及自身免疫性肝病等;③严重的心脏、肺部疾病、肾功能不全患者;④恶性肿瘤、代谢类疾病和精神疾病患者。本研究已通过我院伦理委员会伦理审查及批准,患者以及家属签字确认同意。
(二)营业总成本。1—8月,国有企业营业总成本355739.5亿元,增长9.7%,其中销售费用、管理费用和财务费用分别增长7.1%、9.6%和14%。中央企业205109.8亿元,增长9.9%,其中销售费用、管理费用和财务费用分别增长6.5%、9.2%和9.3%。地方国有企业150629.7亿元,增长9.3%,其中销售费用、管理费用和财务费用分别增长7.9%、10%和18.2%。
1.4.2 血样采集 所有对象入院1 d后无高脂饮食,空腹10 h以上,清晨抽血静脉血10 ml,检测糖化血红蛋白(HbA1c)、空腹血糖(FBG)、TG、TC、LDL-C、HDL-C、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(GGT),采用迈瑞BS-280全自动生化分析仪测定TG、TC、LDL-C、HDL-C、ALT、AST、GGT。
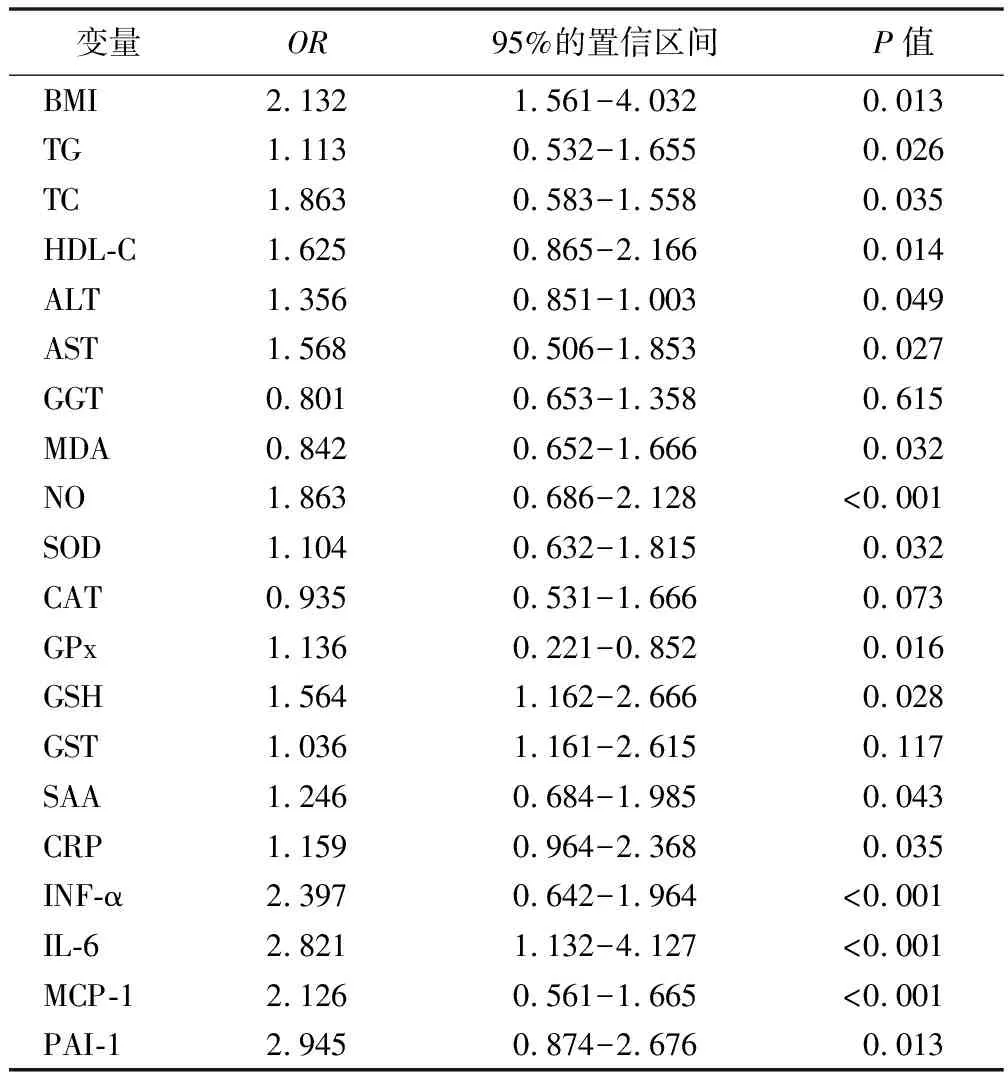
2.4 脂肪肝严重程度和脑动脉硬化的相关危险因素分析 见表4。健康对照组、轻度、中度、重度NAFLD组患者脑动脉硬化的发生率分别为0%、0%、9.46%和24.32%;在多变量logistic回归分析中发现,不同程度脂肪肝患者的BMI、脂质代谢指标(TG、TC、HDL-C、ALT、AST)、氧化应激相关指标(MDA、NO、SOD、GPx、GSH)、炎性因子(SAA、CRP、INF-a、IL-6、MCP-1和PAI-1)是脑动脉硬化发生的危险因素,具有相关性(
<0.05),不同程度NAFLD患者的氧化应激GGT、CAT、GST与脑动脉硬化无相关性(
>0.05)。
1.4 研究方法
1.4.3 氧化应激标记物检测 血液样本经过离心处理,离心率为3 000r/min,离心时间20 min,分离出血浆,化学比色法检测丙二醛(MDA)和超氧化物歧化酶(SOD)的活性,采用α-萘氨显色法检测血浆中一氧化氮(NO)的含量,采用过氧化氢与乙酸-重铬酸钾反应显色比色法检测过氧化氢酶(CAT)活性,用改良Hafeman氏比色法检测谷胱甘肽过氧化物酶(GPx)活性,用DTNB显色法检测谷胱甘肽(GSH)活性,用谷胱甘肽-氯二硝基苯显色法谷胱甘肽S转移酶(GST)活性, 所有试剂盒均有由南京建成生物工程研究所提供。
维修决策的优化目标是使全周期期望维修费率最低。本节计算全周期期望维修费率,并寻求使其最低的最优参数m*和N*。
1.4.4 炎症因子检测 血液样本经过离心处理,离心率为2 000 r/min,离心时间30 min,取血清,使用免疫定时散色比浊法测定SAA,采用ELISA法肿瘤坏死因子(INF-a)、白介素-6(IL-6)、纤溶酶原激活抑制物-1(PAI-1)、单核细胞趋化蛋白-1(MCP-1)水平,采用散射比浊法检测CRP。试剂盒均由北京福瑞生物工程公司提供,按照试剂盒说明书进行严格操作。
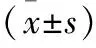
2 结果
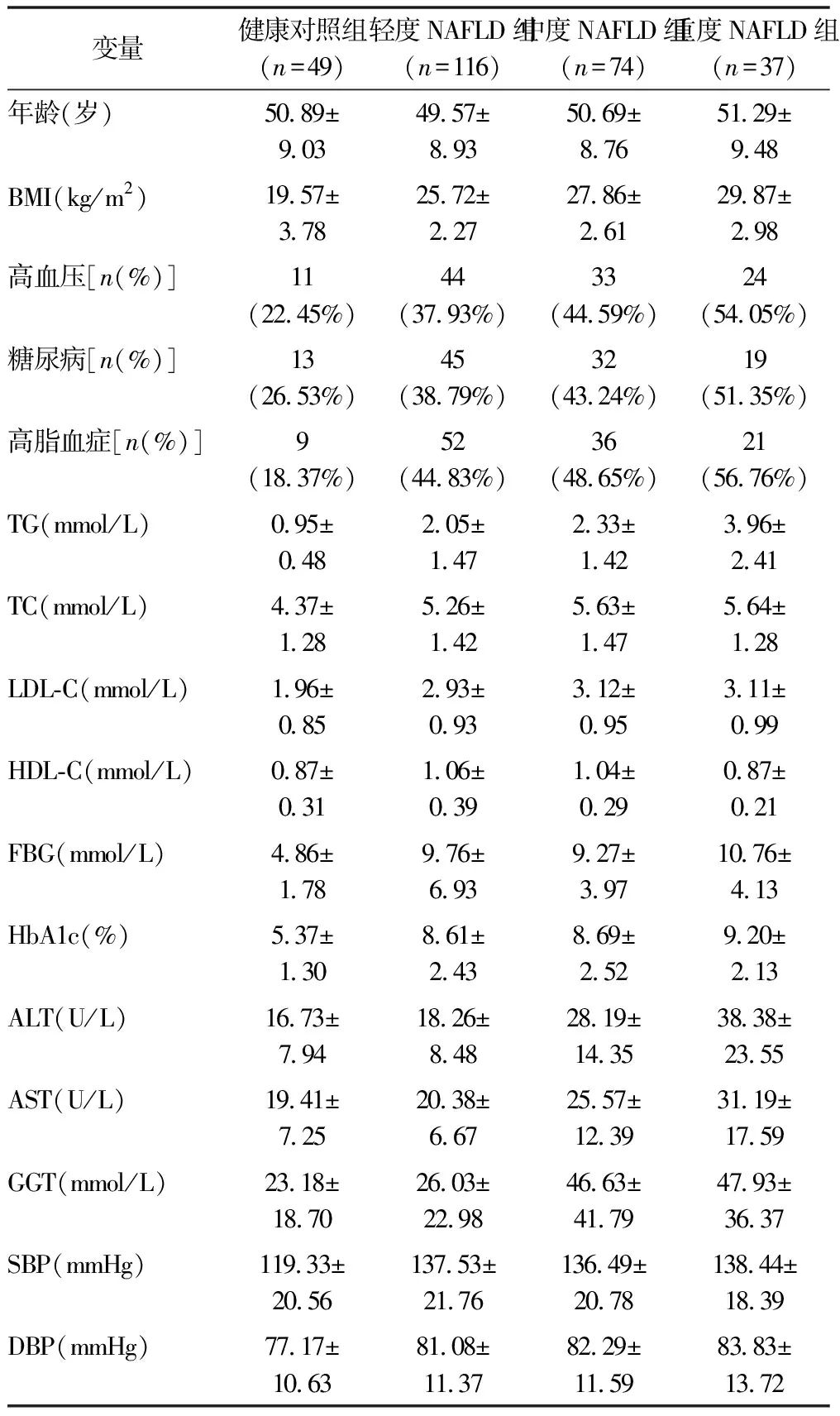
2.2 血清中氧化应激标记物的表达 见表2。轻度、中度、重度NAFLD组患者的MDA、NO的水平较健康对照组显著升高(
<0.05),且三组NAFLD患者之间比较具有显著性差异(
<0.05),而轻度、中度、重度NAFLD患者的SOD、CAT、GPx、GSH、GST水平较健康对照组明显降低(
<0.05),且三组NAFLD患者之间比较具有显著性差异。
改革开放40年,印刷产业引进先进的技术、设备、管理,得以跨越式发展,这正是我们常说的“后发优势”。当打开国门,看到工业化国家的自然环境,要求我们现实发展中的环境要对标今天的现代化国家,这就是“后发劣势”。
2.1 一般资料 见表1。四组患者年龄、ALT、AST比较无显著性差异(
>0.05),轻、中度NAFLD组患者BMI、高血压、糖尿病、高脂血症、TG、TC、LDL-C、FBG、HbA1c、GGT、SBP、DBP与健康对照组比较有著性差异(
<0.05),均高于健康对照组患者,轻、中、重度NAFLD三组患者的年龄、高血压、糖尿病、高脂血症、TC、LDL-C、FBG、HbA1c、SBP、DBP比较无显著性差异(
>0.05),中度NAFLD患者的BMI、TG、HDL-C、ALT、AST、GGT水平高于轻度NAFLD组患者(
<0.05),重度NAFLD组患者高于中度NAFLD,三组之间具有显著性差异(
<0.05)。
肝脏代谢障碍有很多原因,脂质代谢就是其中一种,脂质代谢动态失衡会促使脂肪在肝内堆积,当肝的质量超过肝内脂肪含量的5%以上时,称为脂肪肝。NAFLD一般是指没有过量饮酒史的脂肪肝,它的发病原因比较复杂,比如糖尿病、肥胖、多囊卵巢病和高血脂症等
,糖尿病、肥胖、高血脂症是NAFLD患者疾病发展的危险因素,同时也是脑动脉硬化形成的诱发因素,所以脂肪肝和脑动脉硬化存在一定的相关性
。
1.4.1 病史采集 以调查问卷的方式对患者的病史资料进行采集,病史资料包括年龄、高血压、糖尿病、高脂血症,体脂数(BMI)、收缩压(SBP)和舒张压(DBP)入院时由医生计算和测量。
3 讨论
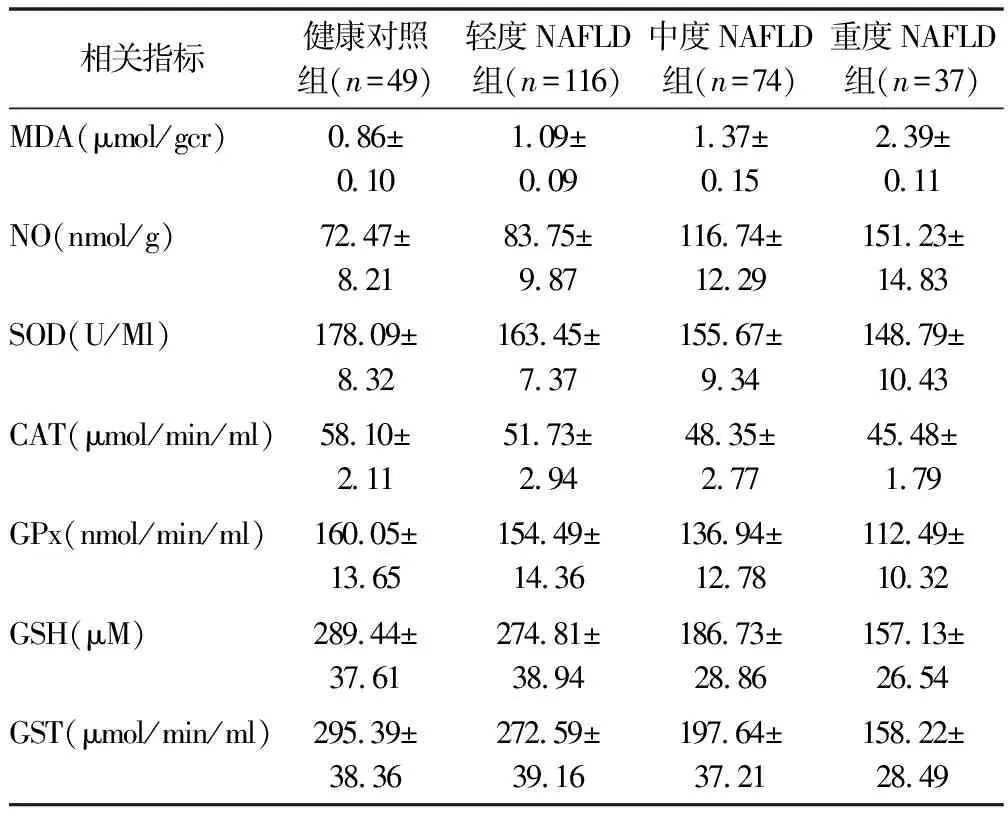
2.3 血清中炎症因子的表达 见表3。轻度、中度、重度NAFLD组患者SAA、CRP、INF-a、IL-6、MCP-1和PAI-1水平较健康对照组显著升高(
<0.05),且三组NAFLD患者之间比较水平明显升高(
<0.05)。
至于佛经、煨桑等等细节,更是《江格尔》及其他蒙古史诗中习见的情节,虽属佛教文化内容,但若只凭这些细节判定佛教思想为该史诗的贯穿线索,显然难以成立。
脂质代谢紊乱在NAFLD疾病中比较常见。相关研究表明,脂质代谢出现紊乱的患者大约有将近一半的患者伴有脂肪肝
。本研究对患者的一般资料进行对比分析发现,三组患者的BMI、TG、HDL-C、ALT、AST、GGT水平中度NAFLD高于轻度NAFLD,重度NAFLD高于中度NAFLD,随着NAFLD疾病程度的发展,BMI、TG、HDL-C、ALT、AST、GGT指标就越恶劣。相关文献报道,严重的高TG血症患者脂肪肝的发病率是普通人的5~6倍
。饮食和脂肪的不断增加,肝脏摄取的脂肪酸就不断的增加,线粒体β中脂肪酸的氧化降低,导致极低密度脂蛋白的分泌降低,致使TG转运障碍,从而出现高TG血症
。高TG血症会触发其他脂蛋白代谢异常,比如LDL颗粒改变 ,低HDL-C血症等。多项研究表明,HDL-C是脑血管疾病的危险因素,HDL-C水平每升高1 mg/dl,心脑血管疾病的风险就会降低2%左右
,且LDL颗粒改变也是脑动脉硬化的必然条件。
肝脏是活性氧(ROS)的主要场所,也是ROS攻击的主要靶器官,当机体受到损害时,ROS增多产生氧化应激,导致线粒体和内质网损伤
,从而对肝脏造成一定的损害。当脂质代谢混乱时,脂肪堆积过剩,给ROS毒性和脂质氧化提供了基石
。ROS大量生成,脂质过氧作用增强,肝脏脂质过氧化水平升高。血浆中的抗氧化能力降低,从而氧化和抗氧化失衡,导致血管新生与内皮损伤, 动脉斑块的形成受到了影响。本研究结果表明,轻度、中度、重度NAFLD患者的MDA、NO的水平显著升高,SOD、GPx、GSH水平明显降低。SOD、GPx、GSH是抗氧化酶系统抵抗自由自的第一道防线,通过有毒反应物代谢有效清除自由基,一般是把有害的物质转化为水或者双原子氧,SOD、GPx、GSH水平表达降低表明机体受损,抵抗自由基,把有害物质转变为无害物质
。MDA是氧化应激的生物标志物,能够反映氧化损伤的程度。随着MDA水平的升高,脂肪肝的氧化损伤能力越强。相关研究报道,NO水平与脑卒中的发生具有一定的联系,NO在动脉粥样硬化中起着一定的作用
。NO是一种新型的细胞信使因子,可以促进血管的扩张,增加血流量。轻度、中度、重度NAFLD患者NO的水平增加会刺激内皮细胞的产生,刺激机体产生大量的内皮素,内皮素具有收缩血管的作用,所以导致血液粘稠度不断的增加,诱发脑动脉硬化,加重了大脑的损伤。所以说明NAFLD患者的应激氧化应激标记物可能是脑动脉硬化的诱因。
细胞因子在NAFLD 中越来越受到研究者们的关注,从肝细胞脂肪变到肝炎、再到肝纤维化和肝硬化的发展,细胞因子起着重要的作用,细胞因子包括的炎性因子有PAI-1、MCP-1、IL-6、INF-α,INF-α属于前期的炎症因子,可以拮抗脂联素,诱导NO合成和氧化应激反应并加剧动脉硬化,CRP形成的主要刺激因子为IL-6,在炎症反应中起着主要的作用。相关研究报道,随着IL-6水平的升高,CRP也逐渐升高,CRP能够促进动脉硬化的形成
。MCP-1可导致NO合成超氧化物歧化酶,加剧动脉硬化的状态。PAI-1能够阻止纤维蛋白溶解,在不稳定粥样斑块的形成中起着主要作用,本研究结果表明,轻度、中度、重度NAFLD患者SAA、CRP、INF-α、IL-6、MCP-1和PAI-1水平明显升高,不同程度脂肪肝患者的INF-α、IL-6、MCP-1和PAI-1是脑动脉硬化发生的危险因素,具有相关性,与上述论证具有一致性。
综合上述,不同程度脂肪肝患者的炎症因子INF-α、IL-6、MCP-1和PAI-1是脑动脉硬化发生的危险因素,具有相关性,不同程度脂肪肝患者的氧化应激MDA、NO、SOD、GPx、GSH活性与脑动脉硬化也具有一定的相关性。所以当患者诊断为NAFLD 时,应当对肝脏疾病进行积极的治疗,对其脑动脉硬化的相关危险性进行合理性的评估,降低脑动脉硬化绝对的风险发生。
[1] Mantovani A, Gatti D, Zoppini G,
.Association between nonalcoholic fatty liver disease and reduced bone mineral density in children: A Meta-Analysis[J]. Hepatology, 2019, 70(3):812-823.
[2] Rinella ME. Nonalcoholic fatty liver disease:a systemic revi-ew[J]. JAMA,2015,313(22):2263-2272.
[3] Diehl AM,Day C. Cause,pathogenesis,and treatment of nonalcoholic steatohepatitis[J]. N Engl J Med 2017,377(21):2063-2073.
[4] 苟小军,陈月,张顺宵,等.糖尿病合并非酒精性脂肪性肝病患者尿代谢组学研究[J]. 中国医院药学杂志,2021,12(4):1-11.
[5] 栾雨婷,黄钟鸣,沈文娟等.非酒精性脂肪性肝病代谢组学研究进展[J].临床肝胆病杂志,2021,37(4):1-11.
[6] 姜晓娜, 宫钦季,刘林. 脂肪肝与颈动脉粥样硬化斑块的关系[J]. 山西医药杂志,2018,47(11):1323-1325.
[7] 黄如,安胜选,王禹婷,等. Keap1-Nrf2-ARE信号通路与酒精性肝病氧化应激损伤研究进展[J]. 广东化工,2021,48(1):132-133,140.
[8] 阮雄中,陈压西.代谢性炎症与非酒精性脂肪性肝病的发生与发展[J]. 中华消化杂志,2020,1(9):581-584.
[9] Guo K,Zhang L,Lu J,
.Non-alcoholic fatty liver disease is associated with late but not early atherosclerotic lesions in Chinese inpatients with type 2 diabetes[J]. J Diabetes Complicat, 2016, 31(1):80-85.
[10] 梁健, 张欢, 张颖等. 从肝论治动脉粥样硬化相关讨论[J]. 辽宁中医药大学学报, 2018, 20(9):153-155.
[11] Zeb I,Li D,Budoff M J,
.Nonalcoholic fatty liver disease and incident cardiac events: The multi-ethnic study of atherosclero-sis[J]. J Am Coll Cardiol, 2016, 67(16):1965-1966.
[12] 郭泽淇,王倩怡, 祁兴顺, 等. 《2017年美国肝病学会非酒精性脂肪性肝病诊疗指导》摘译[J]. 临床肝胆病杂志, 2017, 33(12):2275-2277.
[13] 中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会,等. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 实用肝脏病杂志,2018,2:177-186.
[14] Pham DD, Bruelle C, Thi Do H,
.Caspase-2 and p75 neurotrophin receptor (p75NTR) are involved in the regulation of SREBP and lipid genes in hepatocyte cells[J]. Cell Death Dis, 2019, 10(7):537.
[15] Masarone M, Rosato V, Dallio M,
.Role of oxidative stress in pathophysiology of nonalcoholic fatty liver disease[J].Oxid Med Cell Longev, 2018,2018:9547613.
[16] Kim J,Lee D Y,Park S E,
.Increased risk for development of coronary artery calcification in subjects with non-alcoholic fatty liver disease and systemic inflammation[J]. plos One, 2017,12(7):e0180118.
[17] Jaruvongvanich V,Wirunsawanya K,Sanguankeo A,
.Nonalcoholic fatty liver disease is associated with coronary artery calcification: A systematic review and meta-analysis[J]. Digest Liv Dis, 2016, 48(12) :1410-1417.
[18] Zhou JM,Wang HM,Lv YZ,
.Anti-atherosclerotic effect of Longxuetongluo Capsule in high cholesterol diet induced atherosclerosis model rats[J]. Biomedicine & amp, 2018, 18(97):793-801.
[19] Virtue A,Johnson C,Lopez-Pastraa J,
.MicroRNAa-155 deficiency leads to decreased atherosclerosis, increased white adipose tissue obesity and nonalcoholic fatty liver disease: A novel mouse model of obesity paradox[J]. J Biol Chem, 2016, 292(4):1267-1287.
[20] Baharvand-Ahmadi B,Sharifi K,Namdari M.Prevalence of non-alcoholic fatty liver disease in patients with coronary artery disea-se[J]. Arya Atheroscler, 2016, 12(4):201-205.
[21] Lee JE,Lee YJ,Chung SY,
.Severity of nonalcoholic fatty liver disease is associated with subclinical cerebro-cardiovascular atherosclerosis risk in Korean men[J].PLoS One,2018,13(3):e0193191.
[22] Kim HJ,Park HB,Suh Y,
.Comparison of carotid intima-media thickness and coronary artery calcium score for estimating subclinical atherosclerosis in patients with fatty liver disease[J]. Cardiovasc J AFR, 2017, 29(2):93-97.
[23] Caserta CA,Mele A,Surace P,
.Association of non-alcoholic fatty liver disease and cardiometabolic risk factors with early atherosclerosis in an adult population in Southern Italy[J]. Ann Super I Sanita, 2017, 53(1):77-81.
[24] Kim HJ,Lim CW,Lee JH,
.Gender-based differences in the relationship between fatty liver disease and atherosclerosis[J]. Cardiovasc J AFR, 2016, 27(5):281-286.
