伴营养不良风险的原发性肝癌患者临床特征及预后因素分析*
2022-06-29袁鹤立张亚丽马向明
原发性肝癌(PLC)是最常见的恶性肿瘤疾病之一,按病理类型主要分为肝细胞癌(HCC)、胆管细胞癌及混合性肝癌。肝细胞癌是最常见的原发性肝癌
。PLC具有独特的发病机制,主要病因有肝炎病毒感染、过度饮酒、黄曲霉毒素及合并非酒精性脂肪性肝病,5年生存率仅15%
,因此,PLC成为全球死于癌症疾病的第2位死亡原因
。2019年国家癌症中心相关数据表明,我国PLC发病率居于第4位,死亡率高居第2位,且在消化道系统恶性肿瘤性疾病中,PLC死亡率是最高的。PLC治疗主要包括手术、局部治疗和全身治疗
。目前,对于中晚期PLC患者,其治疗方法主要有经皮微波消融术(MWA)、肝动脉化疗栓塞术(TACE)治疗、靶向药、生物免疫治疗及体外放疗
。恶性肿瘤患者出现营养不良的发生率很高,甚至影响着肿瘤患者的生活质量、并发症的出现、预后情况及病死率等
。2017年中华医学会肠外肠内营养学会(CSPEN)发布了《肿瘤患者营养支持指南》
,但国内外针对PLC患者如何提供合理、有效、经济的营养支持治疗仍需要进一步研究。本研究拟分析伴营养不良风险的PLC患者病理学特征及预后情况,以期为临床诊疗提供参考。
1 资料与方法
1.1 临床资料 选取2016年1月至2018年1月在我院既往接受肝癌切除术(非腹腔镜),术后出现肿瘤复发,需要住院行TACE联合MWA的PLC患者,并获取其临床资料。伦理审查遵照赫尔辛基宣言及《涉及人的生物医学研究伦理审查办法》,方案获得开滦总医院伦理委员会批准并全过程跟踪。
通过在Qt Creater环境中新建一个Qt Widgets Application应用程序,并新建一个继承于QMainWindow类的MainWindow窗口类,设计一个主界面,方便用户添加学生信息,管理学生信息功能的选择,其中管理学生信息包括了对学生信息的浏览,查询,修改,删除等功能,如图1所示。
1.2 纳入及排除标准 纳入标准:①年龄为35~75岁,符合《原发性肝癌诊治规范》的诊断标准
,确诊为PLC;②同意我院TACE治疗中的肝肿瘤局部化疗方案;③接受靶向药或联合PD-1治疗;④预计TACE联合MWA治疗后生存期至少1年;⑤学历/文化社会背景职业等无特殊限制;⑥签署知情同意书。排除标准:①治疗中接受全身化疗者;②合并其他组织起源的恶性肿瘤者;③合并严重肝肾功能障碍、造血系统疾病、自身免疫性疾病者;④术后不能耐受化疗或肠内营养治疗方案者;⑤巴塞罗那临床分期 (BCLC) D期者;⑥肝功能Child-Pugh分级C者。
1940年,浙江大学流徙到遵义,校长竺可桢邀请费巩担任训导长。接受职位之后,费巩说:“吾不要训导长的薪俸,仍要教授原俸,一年可省出四五千元来,可拿这笔省出的钱用在学生物质生活的改善上面。”费巩上任后,就在后勤方面下大力气。他亲自动手烧开水为学生杀臭虫。学生宿舍灯光太暗,他花费许多精力设计出一种亮度大烟气小的植物油灯,并拿自己的工资购买玻璃、铅皮等材料,制作了800多盏分发到学生宿舍。在费巩看来,训导长代表着一个学校的道德形象,他想以此举告诉学生:学校是真心地爱着学生的,不论他的家境是否富裕,也不管他的才华是否出类拔萃,以后是不是一定会做耀人眼目的“路灯”。
激光测径仪采用扫描测径法,经由激光发射器内部的光学系统处理后,产生扫描光束,由接收器接受扫描光束。当工件置于其光幕范围内时(图3),就会产生遮挡,由接收器进行处理,可获得工件尺寸数据[8]。本文使用ZMIKE4025G型激光测径仪,其测量精度可达0.5 μm,量程为25.4 mm。
1.5 测量肿瘤大小及其最优截点的选择 将入选患者术后2年内生存或者死亡为金标准,根据测量肿瘤最大直径行ROC曲线进行分析,得出临床最优截点4.95 cm,AUC=0.745。为便于研究,将采用5 cm为临床近似值。故将患者分为≤5 cm和>5 cm两组,见图1。

2.3 两组患者术后2年生存率比较 观察组患者术后2年生存率显著低于对照组[65.31% (32/49)
82.35%(42/51),χ
=4.439,
=0.035],见图2。患者主要死亡原因是全身器官衰竭(21/26)、恶病质(20/26)、肝衰竭(15/26)。
1.3 治疗方法 两组患者术前均经过化验、影像学检查及既往手术病理确诊为PLC,术前碘过敏试验阴性。两组患者均行TACE联合 MWA治疗,术中单化疗药:注射用洛铂(生产厂家:海南长安国际制药有限公司,10 mg/支),剂量按照50 mg/m
;碘化油注射液(生产厂家:烟台鲁银药业有限公司,10 ml/支),且均为同一组手术医师手术,两组患者术后均早期给予静脉营养及肠内营养治疗,两组研究对象在一般临床资料比较上,差异无统计学意义(
>0.05),组间具有可比性。
2.1 两组患者肝功能功能指标比较 见表1。

1.6 随访 纳入患者109例,TACE联合MWA术后随访至少2年,2020年12月1日截止,失访9例,失访率8.25%,统计记录两组患者术后的生存时间。
严苛的“入门标准”之外,成立理财子公司对于各家商业银行来说仍然有很多问题和挑战需要面对。各家银行的理财子公司还处于筹备阶段,眼下急需明确与解决的是人员调整和存量业务的转移交接问题。
本研究共纳入PLC患者109例,失访9例,依据TACE联合MWA治疗前有无营养风险,结合营养风险筛查2002评分(NRS2002),将全部患者分为观察组49例(总分≥3分)和对照组51例(总分<3分)。两组患者一般资料比较未见显著差异(
>0.05)。
1.4 观察指标 收集两组患者一般状况,包括性别、年龄、体重指数(BMI)、NRS2002、吸烟史、饮酒史、肿瘤大小、淋巴结转移、肿瘤分化程度、门静脉癌栓BCLC分期及Child-Pugh分级等。将肿瘤平铺桌面,用测量肿瘤边缘的最大直径即肿瘤大小。
2 结果
由图2可知,实体煤和支架控顶作用明显,顶板下沉量小,受充实率的影响小。充填体控顶作用受充实率影响明显,顶板下沉量随着充实率的增大而降低,当充实率为 60%,70%,80%,90%,95%,100%时,待充区工作 面 顶 板 下 沉 量 分 别 为 1m,0.78m,0.55m,0.33m,0.20m,0.11m。充实率受材料特性、工艺等因素影响,一般充实率达到90%以上可以满足工作面所能承受顶板下沉量的要求。
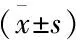
2.2 两组患者临床病理组织学比较 见表2。

抽取两组患者术前、后两组空腹静脉血10 ml,采用全自动生化检测仪测定两组患者肝功能指标:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、间接胆红素(IBil)、白蛋白(Alb)、直接胆红素(DBil)、胆碱酯酶(CHE)。

2.4 多因素Cox回归模型分析 多因素分析结果显示,BCLC分期、伴营养不良风险是影响PLC患者预后的独立危险因素(
<0.05),而术后靶向药或联合PD-1是其保护因素(HR=0.823,95%
=0.753~0.894),见表3。

2.5 单因素分析 对两组患者整体生存率利用单因素分析结果显示:肿瘤大小、BCLC分期、伴营养不良风险、年龄、术后靶向药或联合PD-1均显著影响两组患者的生存预后(
<0.05),见表4。

3 讨论
恶性肿瘤的患者机体常处于高代谢状态,其营养不良原因多是由于机体能量消耗增高所致
。肿瘤患者炎细胞因子升高和分解代谢激素分泌是出现营养不良的病理特征
。肝脏肿瘤代谢与其他部位肿瘤的营养代谢特点有着明显区别,因此PLC患者的营养疗尤为重要
。PLC患者的代谢较为复杂涉及较多的营养代谢通路及分子。PLC患者的营养风险及营养不良发生率较高,尤其以合并慢性乙型、丙型肝炎或肝硬变等基础肝病的PLC患者发生营养不良的危险性更高,主要影响因素是慢性肝功能损害、肿瘤本身及抗肿瘤治疗
。目前,TACE联合MWA治疗中晚期PLL患者的安全性及有效性已经充分得到证实
,重复多次治疗可明显提高恶性肿瘤缓解率,并延长患者总生存期
,但TACE联合MWA治疗可以导致患者术后出现肝损害,需要重视术后保肝治疗
。
本研究数据显示,两组患者术前肝功能无明显差异,但术后观察组患者Alb、CHE显著低于对照组,而AST、ALT及DBil水平显著高于对照组。这一结果提示伴营养风险的PLC患者在TACE联合MWA治疗后存在较重的肝功能损伤,导致肝脏合成储备功能下降。Alb具有维护血管内皮细胞的完整性、参与机体能量物质运输合成及抗氧化的功能
。Alb作为协助临床判断肝脏损害程度和贮备功能,有研究显示低白蛋白是肝切除术后患者并发全身炎症反应综合征的危险因素,而炎症可以持续性抑制白蛋白的合成
。CHE是一种非特异性酯酶,全部由肝脏自身合成,半衰期为10 d,当患者肝功能出现障碍时,体内CHE合成水平将显著下降,所以人体内CHE水平可以较好地反映出肝细胞合成功能情况,与肝细胞损害程度呈正比
。本研究中,与观察组相比,对照组患者Alb、CHE明显下降,而AST、ALT及DBil较高水平,说明伴有营养不良风险的PLC患者在TACE联合MWA术后的肝脏合成功能差,肝损害更为严重。进一步分析对比了两组PLC患者临床病理学特征发现,观察组患者中肿瘤>5 cm及BCLC分期高的患者均显著高于对照组。根据术后2年累积生存率结果显示,观察组患者生存率显著低于对照组,提示伴营养不良风险的PLC患者肿瘤进展程度可能更快,预后更差。为进一步明确伴营养不良风险是否为影响PLC患者预后的独立影响因素,分别对全部患者进行了单因素分析及多因素分析,单因素分析结果显示,肿瘤大小、BCLC分期、术前伴营养风险、年龄、术后靶向药或联合PD-1可能是影响患者预后的因素。为避免上述因素之间的交互效应,故进一步利用多因素分析,结果显示BCLC分期、伴营养不良风险是影响PLC患者术后预后的独立危险因素,术后是否靶向药或联合PD-1是影响PLC患者术后预后的保护性因素。与本研究结果不同,相关研究显示门静脉癌栓是PLC患者预后的独立危险因素
;亦有研究显示,PLC的预后很大程度上受肝功能分级及肿瘤大小的影响
。有研究发现肿瘤复发转移是影响PLC患者远期预后的重要因素,而乙型肝炎、肝硬化、肿瘤大小、包膜完整与否、分化程度、多结节融合及血管癌栓,是影响PLC患者术后复发转移的独立危险因素
。此外,还有研究发现甲胎蛋白的变化是影响PLC患者生存率的独立预后因素
。造成差异的原因可能与本研究符合筛选条件的样本量有限、患者入组标准及随访时间较短等有关。
综上所述,伴营养不良风险是影响PLC患者预后的独立危险因素,伴营养不良风险的PLC患者在行TACE联合MWA治疗后存在肝损害恢复差,肝脏合成功能障碍,其肿瘤进展更快,预后更差。但本文章为回顾性研究,有关结论尚需要时间观察进一步研究。
[1] Di PC,He S,Varghese RS,
.Identification of race-associated metabolite biomarkers for hepatocellular carcinoma in patients with liver cirrhosis and hepatitis C virus infection [J].PLoS One,2018,13(3):e0192748.
[2] Mittal S,Kanwal F,Ying J,
.Effectiveness of surveillance for hepatocellular carcinoma in clinical practice:A United States coho-rt [J].J Hepatol,2016,65(6):1148-1154.
[3] Lepage C,Bossard N,Dejardin O,
.Trends in net survival from rectal cancer in six European Latin countries:results from the SUDCAN population-based study [J].Eur J Cancer Prev,2017,26:s48-s55.
[4] Forner A,Gilabert M,Bruix J,
.Treatment of intermediate-stage hepatocellular carcinoma [J].Nat Rev Clin Oncol,2014,11:525-535.
[5] Bruix J,Han KH,Gores G,
.Liver cancer:Approaching a personalized care [J].J Hepatol,2015,62:s144-s156.
[6] Llovet JM,Real MI,Montana X,
.Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma:a randomised controlled tri-al [J].Lancet,2002,359:1734-1739.
[7] National Comprehensive Cancer Network (NCCN) .Clinical practice guidelines in oncology[M].Hepatobiliary Cancers,Version 2.2018.
[8] 王新颖,黎介寿.癌性恶病质的代谢改变和营养干预策略[J].肠外与肠内营养,2017,24(1):4-9.
[9] Gyan E,Raynard B,Durand JP,
.Malnutrition in Patients With Cancer[J].JPEN J Parenter Enteral Nutr,2017:148607116688881.
[10] 中华医学会肠外肠内营养学分会.肿瘤患者营养支持指南[J].中华外科杂志,2017,55(11):801-829.
[11] 吴孟超,汤钊猷,刘允怡,等.原发性肝癌诊疗规范(2019年版)[J].中国实用外科杂志,2020(2):121-138.
[12] Jones SA,Schell J,Rose-John S.Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling [J].J Clin Invest,2011,121(9):3375-3383.
[13] Matthew D.Barber.Cancer cachexia and its treatment with fish-oil-enriched nutritional supplementation [J].Nutrition,2001,17(9):751-755.
[14] 赵文昊,刘雪莲,李宏伟,等.原发性肝癌的营养代谢特点及意义[J].临床肝胆病杂志,2019,35(4):905-907.
[15] 翟茂东,杨俊,贾震易,等.肝胆胰外科患者营养风险筛查与临床结局分析[J].肝胆胰外科杂志,2012,24(3):179-182.
[16] 李猛,陆荫英,董景辉,等.经肝动脉化疗栓塞术联合微波消融治疗中晚期原发性肝癌的效果分析[J].临床肝胆病杂志,2020,36(12):2720-2724.
[17] Lo CM,Ngan H,Tso WK,
.Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma[J].Hepatology,2002,35(5):1164-1171.
[18] 何晓俊,郭小鹏.TACE序贯MWA或RFA治疗原发性肝癌的疗效及安全性比较[J].现代肿瘤医学,2020,28(16):2841-2845.
[19] 胥栋.血清前白蛋白、胆碱酯酶和总胆汁酸指标在乙肝进展及原发性肝癌诊断及预后中的意义[J].中国实验诊断学,2014,18(12):2043-2045.
[20] 李权林,李敬东,徐威,等.肝癌肝切除术后持续低蛋白血症的相关因素分析[J].中华消化外科杂志,2012,11(2):151-154.
[21] Muntoni S,Rojkind M,Muntoni S.Colchicine reduces procollagen Ⅲ and increases pseudocholinesterase in chronic liver disease[J].World J Gastroenterol,2010,16(23):2889-2894.
[22] 李一帆,顾俊鹏,纪卫政,等.TACE联合RFA治疗BCLC中晚期肝癌患者预后的影响因素分析[J].中华肝脏外科手术学电子杂志,2020,9(6):557-561.
[23] 司安锋,黄鑫,雷正清,等.微血管侵犯对肝癌肝移植患者预后的影响[J].临床肿瘤学杂志,2020,25(4):316-321.
[24] 刘金明,张克勤,李涛.肝癌多次TACE术后的肝硬化分级及预后因素分析[J].实用癌症杂志,2014,29(1):68-71.
[25] 王伟,葛瑞良,胡雷,等.原发性肝癌患者手术治疗远期疗效的影响因素[J].实用癌症杂志,2014,29(6):678-680.
[26] 褚志强,吴向未,杨宏强,等.原发性肝癌手术治疗的生存率分析及影响因素研究[J].实用医学杂志,2013,29(5):787-789.
[27] 孙玉,张洪海,生守鹏,等.经肝动脉化疗栓塞术联合射频消融治疗巴塞罗那B期原发性肝癌的效果及预后影响因素分析[J].临床肝胆病杂志,2019,35(4):818-824.
