αB-晶状体蛋白在糖尿病视网膜病变患者晶状体上皮细胞中的表达△
2022-06-28胡昕滢
胡昕滢 曹 丽 缪 晟 高 烨
糖尿病视网膜病变(DR)是糖尿病微血管并发症中最常见病变之一,是人类致盲的主要原因[1-2]。DR特征性病理变化是视网膜缺血缺氧导致眼内新生血管形成。有证据表明,新生血管的形成是由于血管生成刺激因子与抑制因子的失衡引起的[3]。血管内皮生长因子(VEGF)是新生血管形成和引起血管渗漏的强效诱导因子,可由多种细胞分泌,是刺激新生血管生长的最重要因素[4-5],已成为现今大多数抗VEGF治疗的靶标。然而,反复玻璃体内注射抗VEGF药物仍无法避免后期新生血管复发[6]。
αA-晶状体蛋白和αB-晶状体蛋白是哺乳动物晶状体中的主要蛋白质成分,αB-晶状体蛋白是小分子热休克蛋白,能保护其他蛋白免受应激诱导的损伤[7]。αB-晶状体蛋白与新生血管性眼病的发生发展有密切关系。体外研究提示[8],理论上可以利用αB-晶状体蛋白的分子伴侣功能来调节病理性新生血管形成和局部缺血组织中VEGF的分泌,从而改善DR[9]。然而目前尚无研究从临床角度验证αB-晶状体蛋白与DR的关系。人晶状体上皮细胞(LEC)能够表达αB-晶状体蛋白[10]。本研究目的旨在探究不同阶段DR患者LEC中αB-晶状体蛋白的表达及其与DR的关系,试图从临床角度补充说明αB-晶状体蛋白与DR等新生血管性眼病的关系。
1 材料与方法
1.1 研究对象选取东南大学附属中大医院眼科2018年5月至2019年4月收治的年龄相关性白内障和糖尿病并发性白内障患者98例(98眼),均进行超声乳化白内障吸除联合人工晶状体植入术(由同一术者进行),术中搜集晶状体前囊膜。根据Emery核硬度分级标准[11],入选的患者晶状体核硬度均为III度。纳入标本需排除先天性、继发性白内障以及合并青光眼、葡萄膜炎、眼外伤、内眼手术史或其他非糖尿病眼底病变的患者,此外,存在晶状体前囊膜混浊或特殊晶状体混浊形态的白内障患者亦排除在外。以空腹血糖≥7.0 mmol·L-1和(或)餐后2 h血糖≥11.1 mmol·L-1为诊断糖尿病的标准[12],将入院接受白内障手术患者分为非糖尿病(NDM)组25例(25眼)、糖尿病组73例(73眼)。糖尿病组患者通过眼底镜、荧光素眼底血管造影检查[13],再分为非糖尿病视网膜病变(NDR)组24例、非增生型糖尿病视网膜病变(NPDR)组24例和增生型糖尿病视网膜病变(PDR)组25例。本研究经东南大学中大医院伦理委员会批准(批件号:2018ZDSYLL047-P01),所有患者在招募前均知情同意且临床资料完整。
1.2 方法术前患眼常规局部麻醉并消毒铺巾,术中连续环形撕囊获取直径5.0~5.5 mm的中央区晶状体前囊膜样本。显微组织剪剪取一个象限晶状体前囊膜样本,立即浸泡于40 g·L-1多聚甲醛中固定,用于免疫荧光染色检测;余样本即刻置消毒干燥EP管中,-80 ℃冰箱保存备用,用于Western blot检测。
1.2.1 免疫荧光染色检测由于晶状体前囊膜样本中,中央区LEC多呈规则的单层立方上皮且贴附于晶状体前囊内表面,故对本研究所取样本进行铺片染色。将固定好的晶状体前囊膜样本取出后用PBS洗涤,采用Triton X-l00溶液室温打孔10 min。将打孔完毕的样本再次洗涤后封闭非特异性抗原2 h。配制抗αB-晶状体蛋白鼠抗人单克隆抗体(一抗,11000,美国Abcam公司),将封闭后的样本洗涤后放入一抗溶液中,然后将其置入湿房,4 ℃孵育过夜,PBS溶液代替一抗作为自发荧光对照。配制混合FITC标记的山羊抗鼠抗体(二抗,1500,美国Jackson公司)与细胞核染色剂DAPI (11000,美国Abcam公司)的溶液,将样本从一抗溶液中取出,洗涤后放入含荧光标记的二抗和DAPI溶液中,置避光暗盒中,室温放置2 h。最后将样本从二抗和DAPI的混合溶液中取出,洗涤完毕后平铺贴附于多聚赖氨酸防脱载玻片上,滴加适量荧光封片剂于晶状体前囊膜组织上,盖上盖玻片,即刻用共聚焦显微镜观察铺片结果,检测患者LEC中αB-晶状体蛋白阳性表达量。
1.2.2 Western blot检测实验开始前将样本置于4 ℃冰箱解冻,随后加入适量预冷的细胞裂解液,并通过涡旋实现细胞裂解来制备总蛋白提取物。采用BCA法进行蛋白浓度测定。每个样本取40 μg蛋白并标记组别,100 ℃沸水煮5 min,冷却至室温后分别加入聚丙烯酰胺凝胶的上样孔内进行电泳分离蛋白。60 V电泳,待溴酚蓝指示剂移至分界线时将电压改为120 V,电泳时间为1.5~2.0 h。电泳结束后,将分离的蛋白转移至PVDF膜上。PVDF膜洗涤后置于含50 g·L-1脱脂奶粉的封闭液中室温封闭1 h。然后用封闭液稀释抗体,目的一抗(抗αβ-晶状体蛋白鼠抗人单克隆抗体)稀释度为15000,二抗(山羊抗鼠抗体)稀释度为12000,内参蛋白(GAPDH)稀释度为15000。将PVDF膜与一抗孵育,4 ℃ 摇床过夜。次日取出PVDF膜,洗涤后与二抗孵育2 h。充分洗涤后,通过增强化学发光法使免疫反应条带可视化,采用凝胶图像处理系统观察、拍照。检测患者LEC中αB-晶状体蛋白表达,每个样本重复测3次,取平均值。
1.2.3 观察指标αB-晶状体蛋白在细胞中表现为绿色团块样或颗粒样染色物质,每张铺片随机取10个视野,评价其染色强度以及阳性细胞比例,染色强度根据无着色、淡绿色、绿色、深绿色分为0分、1分、2分、3分,阳性细胞比例根据≤5%、>5%~25%、>25%~50%、>50%~75%、>75%分别定义为0分、1分、2分、3分、4分;两项评估总分≥3分为阳性表达。对于Western blot检测结果,通过ImageJ软件量化相对条带强度,αB-晶状体蛋白条带与GAPDH条带的光密度比值为目标蛋白相对表达量。
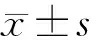
2 结果
2.1 一般情况98例患者中男44例,女54例。纳入研究对象基本情况见表1。NDM组25例(25.51%),NDR组24例(24.49)%,NPDR组24例(24.49)%,PDR组25例(25.51%),四组患者间年龄、性别、术前最佳矫正视力(BCVA)差异均无统计学意义(均为P>0.05)。所有患者术中、术后均无并发症发生。
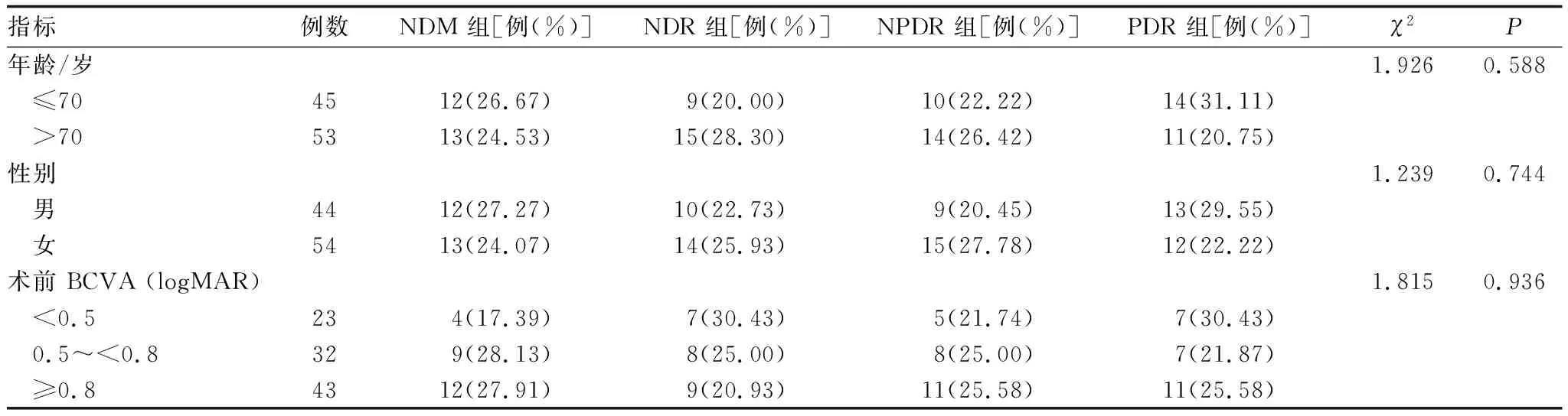
表1 纳入研究对象基本情况
2.2 患者LEC中αB-晶状体蛋白阳性表达率FITC绿色荧光表示αB-晶状体蛋白的免疫活性,DAPI蓝色荧光特异性地表示细胞核。免疫荧光染色结果显示,αB-晶状体蛋白在整个细胞(细胞核、细胞质)中均呈现弥漫的绿色荧光,说明LEC中存在αB-晶状体蛋白的表达,而且可同时表达于细胞核和细胞质内。NDM组、NDR组、NPDR组、PDR组患者LEC中αB-晶状体蛋白的阳性表达率逐渐升高(P<0.001);与NDM组相比,NPDR组、PDR组患者LEC中αB-晶状体蛋白的阳性表达率均显著升高(均为P<0.05);PDR组患者LEC中αB-晶状体蛋白的阳性表达率高于NDR组,差异有统计学意义(P<0.05);而NDR组与NDM组、NPDR组与PDR组、NPDR组与NDR组患者LEC中αB-晶状体蛋白的阳性表达率差异均无统计学意义(均为P>0.05)(图1、表2)。
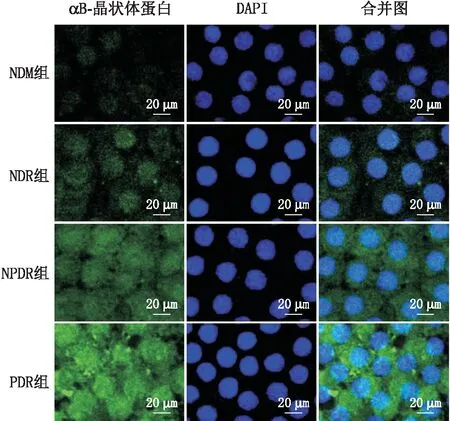
图1 免疫荧光染色检测各组患者LEC中αB-晶状体蛋白表达(×400)
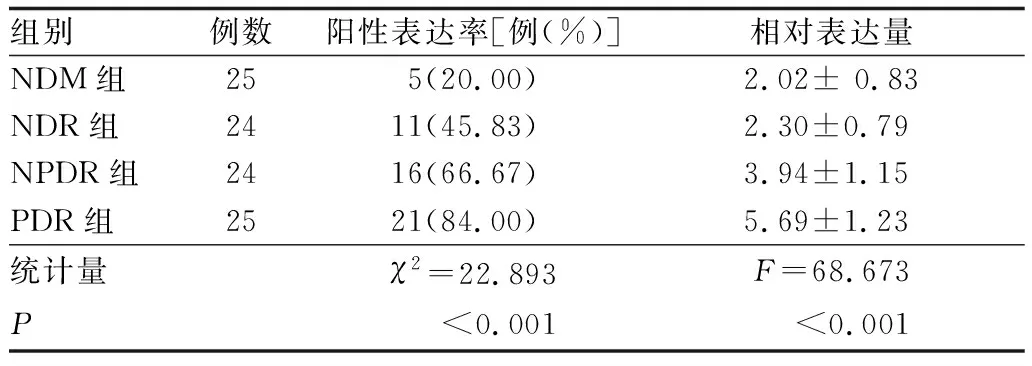
表2 四组患者LEC中αB-晶状体蛋白表达比较
2.3 患者LEC中αB-晶状体蛋白的相对表达量患者晶状体前囊膜LEC中均存在不同程度的αB-晶状体蛋白表达,显示为相对分子质量约22 000处的单一反应条带(图2)。Western blot检测结果显示,NDM组、NDR组、NPDR组、PDR组患者LEC中αB-晶状体蛋白的相对表达量差异有统计学意义(P<0.001)。NDR组与NDM组患者LEC中αB-晶状体蛋白的相对表达量差异无统计学意义(P>0.05);与NDM组、NDR组相比,NPDR组和PDR组患者LEC中αB-晶状体蛋白的相对表达量均显著升高,NPDR组患者LEC中αB-晶状体蛋白的相对表达量均明显高于NDM组和NDR组(t=-6.725,-5.785,均为P<0.05);而PDR组患者LEC中αB-晶状体蛋白的相对表达量均高于NDM组、NDR组、NPDR组,差异均有统计学意义(t=-12.348,-11.431,-5.130,均为P<0.05)(表2)。
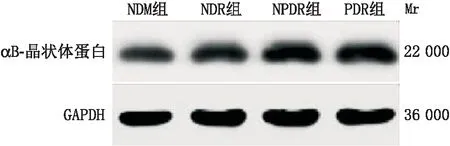
图2 Western blot检测各组患者LEC中αB-晶状体蛋白表达
3 讨论
VEGF是目前所知最强的内皮细胞选择性促有丝分裂因子和血管生成因子,与DR新生血管形成联系最紧密[1,14-15]。VEGF表达增加促使血管内皮细胞增生,增加血管通透性,促进新生血管形成[16]。临床上广泛应用抗VEGF药物来抑制新生血管形成,从而改善DR或减缓其病程进展[6]。然而,抗VEGF药物给患者带来显著疗效的同时,亦给患者造成了极大的经济负担和精神压力,且最终无法避免患者永久性视力损失。αB-晶状体蛋白是晶状体中主要的蛋白成分之一,有体外研究发现其与眼内新生血管形成有关[17-20],然而尚未从临床角度验证αB-晶状体蛋白与DR的关联。故本研究通过检测αB-晶状体蛋白在不同阶段DR患者LEC中的表达,探究其与DR的关系,试图从临床角度补充说明αB-晶状体蛋白与视网膜脉络膜新生血管的关联。
本研究探讨了LEC中αB-晶状体蛋白的表达与DR进展相关性。免疫荧光染色结果显示,αB-晶状体蛋白的免疫活性表达于整个LEC(细胞核和细胞质)中,且两者的荧光表达强度随DR的加重显著增强。但由于免疫荧光染色检测技术的量化稳定性欠佳,只可作为定性、定位的证据,所以我们并不能确定各组患者之间LEC中αB-晶状体蛋白表达水平是否存在差异。进一步的Western blot检测了各组患者LEC中αB-晶状体蛋白的相对表达量。结果表明,相较于NDM组和NDR组,NPDR组和PDR组患者LEC中αB-晶状体蛋白的表达均显著升高,且在PDR组患者LEC中表达保持较高水平(表2)。本研究发现,随着DR的出现和进展,患者LEC中αB-晶状体蛋白表达上调,其作为VEGF的分子伴侣能更好地保护未折叠和聚合的VEGF,增强VEGF的作用,从而正反馈刺激血管内皮细胞增生,促使眼内新生血管生长,加速DR的发展。Kase等[19]利用氧诱导视网膜病变和脉络膜新生血管的动物模型来研究αB-晶状体蛋白在视网膜新生血管中的作用,结果显示,与对照组相比,αB-晶状体蛋白基因敲除小鼠眼内血管生成减少53%。此外,有研究在低氧环境下培养的视网膜色素上皮细胞中的细胞质和内质网发现,αB-晶状体蛋白和VEGF共定位,αB-晶状体蛋白具有与VEGF强烈相互作用的序列(ACD),对ACD序列进行分析,证实αB-晶状体蛋白保护未折叠和聚合的VEGF就是通过此序列完成的[18]。由此可见,本研究与先前学者体外研究得出的结果基本一致。
本研究结果表明,患者LEC中αB-晶状体蛋白的表达与DR的发生和发展密切相关,随着DR的出现和进展,患者LEC中αB-晶状体蛋白的表达增加。推测αB-晶状体蛋白可能参与眼内新生血管的形成,对DR的发生发展起促进作用。本研究从患者体内取晶状体囊膜,探究不同阶段DR患者LEC中αB-晶状体蛋白的表达,国内外尚无类似研究。然而,本研究结论只能说明αB-晶状体蛋白与DR的关系,而不能解释αB-晶状体蛋白参与新生血管形成的机制,因此未来需要更多的体外实验来验证。
