基于深度学习的视网膜毛细血管无灌注区智能识别定量分析系统在CRVO缺血分型诊断中的应用△
2022-06-28侯军军张喜梅张光华
侯军军 张喜梅 陈 松 孙 斌 张光华 谢 娟 马 非 刘 汉
视网膜中央静脉阻塞(CRVO)是临床上常见的视网膜血管性疾病[1],根据阻塞后视网膜缺血状态,可分为缺血型CRVO和非缺血型CRVO。虽然非缺血型CRVO占70%左右,但缺血型预后更差,对视力的损伤也更严重[2]。因此,临床实践中CRVO缺血类型的判断对于制定个性化治疗方案、随访策略及预后评估均有重要意义。关于CRVO缺血分型目前虽无统一标准,但视网膜毛细血管无灌注区(NPA)面积仍是最常用的经典的分型指标。近年来,随着人工智能(AI)技术的进步及其在医学影像方面强大的处理能力使得AI辅助诊断已成为现实。AI在处理图像的效率及准确性方面有明显优势。本研究探讨一种基于深度学习的NPA智能识别定量分析系统在CRVO缺血分型诊断中的应用价值,现将结果报告如下。
1 资料与方法
1.1 一般资料回顾性病例系列研究。选取2017年1月至2018年12月经山西省眼科医院门诊确诊为CRVO并且行荧光素眼底血管造影(FFA)检查的343例(343眼)患者作为研究对象。其中,男181例,女162例,年龄21~87(58.1±13.2)岁。随访并记录纳入患者自发病起1年内是否发生新生血管并发症。排除标准:(1)患者随访时间不足1年;(2)合并视网膜动脉阻塞者;(3)合并其他视网膜及视神经病变者;(4)因屈光介质混浊等原因导致FFA影像质量不佳者;(5)行眼内糖皮质激素或视网膜激光光凝治疗者;(6)最后一次抗VEGF治疗后随访时间不足6个月者。所有FFA影像均由海德堡Spectralis HRA眼底血管造影仪55°镜头拍摄,以患者影像资料中黄斑为中心的55°视野范围FFA静脉早期影像图片为目标影像。本研究通过医院伦理委员会审批,遵循《赫尔辛基宣言》所要求的伦理学原则,患者均签署知情同意书。
1.2 方法本研究团队开发了一种基于深度学习算法的NPA智能识别定量分析系统[3-4],该系统框架基于U-net网络实现图像分割,构建完成后测试集中NPA预测范围与人工标注范围交集并集比为90.9%。利用该图像分析系统对目标FFA影像进行NPA自动识别定量,即为AI预测值。同时每一幅FFA影像均由同一名专业眼底病医师对NPA累及范围进行人工标注,标注结果由另一位眼底病医师独立审核。对有异议的标注影像,则与团队中其他眼底病医师讨论决定如何标注。所有的人工标注影像均经本团队开发的AI系统按照医师标注范围自动定量运算NPA面积,即为人工标注值。分析CRVO患者后极部55°视野范围内NPA面积与其发病后1年内发生新生血管性青光眼或视网膜新生血管并发症的相关性。
1.3 统计学方法采用SPSS 17.0统计学软件进行统计分析。由于数据不符合正态分布,NPA面积采用均值与95%置信区间(CI)表示。NPA面积人工标注值与AI预测值组间比较采用两相关样本秩和检验,发生新生血管并发症者与未发生者NPA面积人工标注值与AI预测值组间比较采用两独立样本秩和检验。通过受试者工作特征(ROC)曲线分析NPA面积对CRVO患者发生新生血管并发症的诊断价值。
2 结果
343眼CRVO患者中有26眼出现新生血管并发症,发病率为7.58%;其中25眼为新生血管性青光眼,1眼为视盘及视网膜新生血管(图1)。统计各类患者NPA面积发现,新生血管并发症患者中NPA面积人工标注值为47.695个视盘面积(DA)(95%CI:36.669~58.722),无并发症患者人工标注值为3.574 DA(95%CI:2.275~4.872)(Z=8.522,P<0.001)(图2)。新生血管并发症患者NPA面积AI预测值为48.834 DA(95%CI:41.274~56.393),无并发症患者AI预测值为6.983 DA(95%CI:5.505~8.460)(Z=7.759,P<0.001)。343眼CRVO患者NPA面积AI预测值与人工标注值组间配对比较差异有统计学意义(Z=8.011,P<0.001);其中26眼新生血管并发症患者间比较差异无统计学意义(Z=0.114,P=0.909),317眼无并发症患者间比较差异有统计学意义(Z=9.182,P<0.001)。
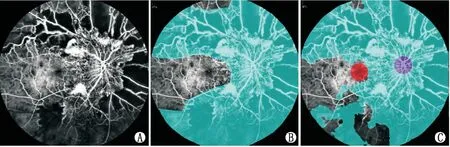
图1 1例缺血型CRVO患者FFA影像 A:经脱敏处理后原图;B:人工标注图;C:AI预测图。
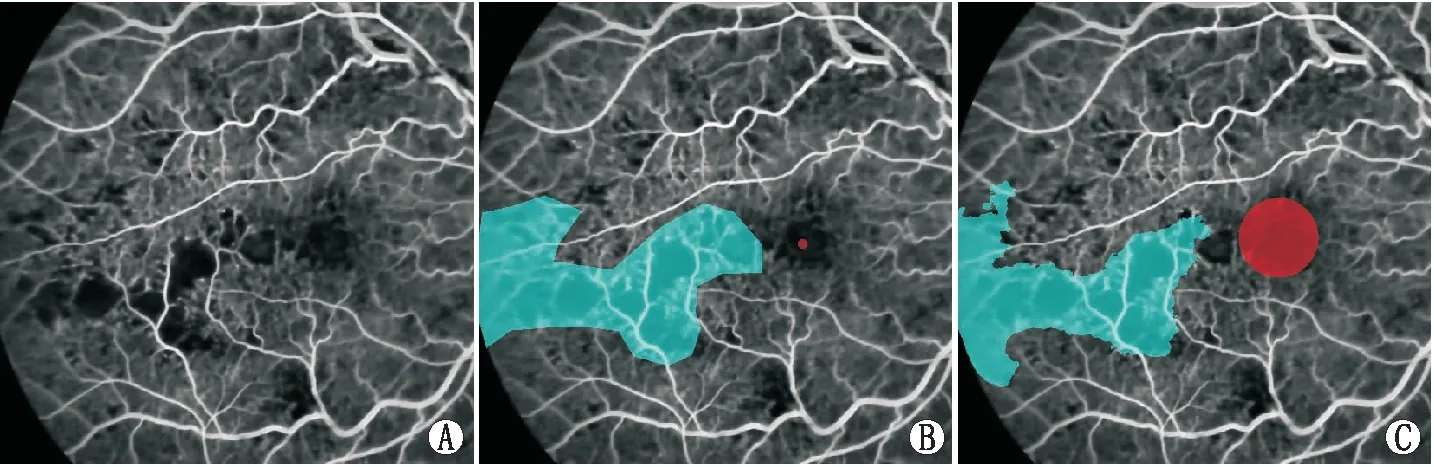
图2 1例非缺血型CRVO患者FFA影像 A:经脱敏处理后原图;B:人工标注图;C:AI预测图。
ROC曲线显示:依据NPA面积判断CRVO患者是否发生新生血管并发症的曲线下面积为0.889(95%CI:0.799~0.978,P<0.001)。最佳截断值为20.997 DA,灵敏度为0.808,26眼新生血管并发症患者中有21眼NPA值大于该值;特异度为0.946,317眼无并发症患者中有300眼NPA值小于该值(图3)。
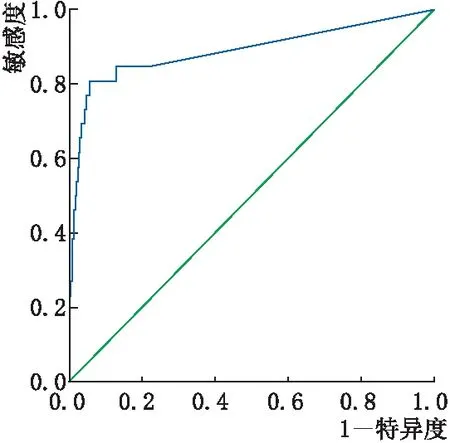
图3 依据NPA面积判断CRVO患者是否发生新生血管并发症的ROC曲线
3 讨论
视网膜中央静脉阻塞研究组对缺血型CRVO的定义为30°视野镜头下标准7视野FFA影像上NPA≥10 DA。他们指出在此分型标准下,缺血型CRVO患者3年自然病程中发生前节新生血管并发症的风险为35%[5]。若照此标准进行并发症预防则意味着65%所谓的缺血型CRVO患者会被过度随访或接受预防性视网膜光凝治疗。Hayreh等[6]提出的分型标准涉及参数较多,临床中不便于快速诊断。Magargal等[7]所报道的利用NPA计算缺血指数的分型方法仍需人工测量NPA,并且目前并无公认的缺血指数分型标准。因此,对CRVO缺血分型标准的研究仍需深入探讨。
抗VEGF治疗是目前针对CRVO引起的黄斑水肿及新生血管并发症的一线治疗方法[8-9]。已有多项临床研究发现,抗VEGF治疗将推迟CRVO患者新生血管并发症的出现时间。DeCroos等[10]指出,CRVO患者经抗VEGF治疗后新生血管并发症出现的时间会延后(6.2±7.3)个月。Brown等[11]研究表明,抗VEGF治疗虽然会延迟新生血管出现的时间,但不能阻止其发生。Bradshaw等[12]在其研究中提出抗VEGF治疗对缺血型CRVO患者新生血管并发症的预防没有意义。这可能是由于抗VEGF治疗仅暂时降低玻璃体内VEGF浓度,并未能从根本上解决VEGF的产生。因此,研究抗VEGF治疗下真实世界CRVO患者新生血管并发症的发病情况,有助于鉴别其缺血类型及制定诊疗策略。Hayreh等[13]指出,大部分缺血型CRVO患者出现新生血管并发症的时间为发病后7~8个月。而且,最新美国眼科学会的指南[9]中指出,停用抗VEGF治疗后6个月内为患者发生新生血管并发症的高危期。
目前关于CRVO缺血分型的报道大多未考虑NPA位置。Nicholson等[14]提出NPA发生的位置非常关键,后极部NPA≥10 DA则CRVO患者新生血管并发症发生率为84.6%,若周边NPA>10 DA但后极部无NPA则只有7.7%的患者发生新生血管并发症。Khayat等[15]指出,NPA发生在后极部还是周边部造成的视力损伤程度及并发症发生的风险有明显差别。这可能和周边视网膜感光细胞分布密度相对低,代谢相对不活跃,并且周边部视网膜相对薄,视网膜缺血组织可部分由脉络膜血管代偿供血有关[16-17],所以与后极部相比,周边部缺血造成的影响相对较小。我们的智能识别定量分析系统可自动识别后极部55°视野范围FFA影像,但无法对后极部及周边部图像进行自动拼接。
本研究结果表明,CRVO发生新生血管并发症的NPA最佳截断值为20.997 DA,为方便临床应用取其整数20 DA作为CRVO缺血分型阈值。该结论提示,CRVO患者后极部55°视野范围内NPA超过20 DA时,患者发生新生血管并发症的风险非常大。目前,RVO指南[8-9]已经不推荐采取预防性视网膜光凝治疗CRVO,建议在随访过程中患者出现新生血管并发症后再行全视网膜激光光凝术(PRP)。由于抗VEGF药物半衰期短,且仅为对症治疗,单纯抗VEGF治疗并不能从根本上解决缺血型CRVO患者VEGF的产生,所以不能阻止新生血管并发症的发生[11], PRP仍是公认的预防新生血管并发症最有效的方法[2,18]。Tultseva等[19]指出,抗VEGF与PRP联合治疗不仅能减少玻璃体内注药次数,而且可降低新生血管并发症发生率。根据本研究结果我们建议,患者如果后极部NPA已超过20 DA,则需立即联合预防性PRP来阻止患者出现新生血管并发症,从而防止大部分非缺血型患者受到过度视网膜光凝治疗,进而损伤视野。
由于AI模型预测准确性无法达到100%,本研究中343例FFA图像的人工标注值和AI预测值统计学比较有差异,所以在本研究中统计分析最佳截断值时采用人工标注值。该AI诊断系统对NPA诊断误诊率相对高,漏诊率相对较低,临床应用中可避免漏诊缺血型高危患者。
综上所述,本研究基于深度学习的NPA智能识别定量系统,提出了抗VEGF治疗时代真实世界中CRVO缺血阈值标准,此标准可作为该AI系统对CRVO自动分型诊断的依据。但该AI系统仅适用于后极部55°视野范围的情况,其研究成果需迁移学习到超广角FFA影像中进一步开发和验证。
