丹参多酚酸介导PIDD通路改善大鼠缺血性脑损伤的机制研究
2022-06-27何地芹曹自为管叶明黄海丽汪青松
李 蒙,何地芹,曹自为,管叶明,黄海丽,汪青松
0 引 言
脑梗死作为神经系统的常见疾病,发病率高和致死、致残率高以及复发频率高是它的主要特点[1],而神经细胞凋亡是脑缺血再灌注损伤的主要形式。目前,溶栓治疗是有效治疗手段,但其存在严格的治疗时间窗限制以及再灌注后出血等并发症[2]。丹参多酚酸 (salvianolate,SA) 是丹参的提取物,SA主要包括丹酚酸B、丹酚酸E、紫精酸和迷迭香酸。已报道SA具有微循环、抗炎、抗氧化、清除氧自由基等作用[3-4]。我们课题组的既往研究表明:SA可以通过促进沉默信息调节因子1(SIRT1)转录、抑制高迁移率族蛋白B1(HMGB1)迁移和表达,减少下游的炎症因子p53、核转录因子(NF-κB)的释放,与此同时抑制神经细胞凋亡,进而减轻大鼠脑缺血损伤[5]。
p53诱导死亡结构域蛋白(p53-induced protein with a death domain,PIDD)是Lin等[6]和 Telliez等[7]首次在其研究课题中描述的一种蛋白质,作为p53蛋白的靶基因,PIDD能调节细胞周期与细胞凋亡,决定p53基因能否响应下游的应激反应。既往多项研究表明,caspase-2、caspase-3等细胞蛋白与PIDD相互作用可以调节细胞的凋亡与存活。PIDD的研究大多数关注于肿瘤的治疗,PIDD与脑缺血性损伤中神经细胞凋亡的关系较少报道。因此,我们推测SA可以通过介导PIDD途径改善大鼠脑缺血损伤。
本实验采用建立大鼠大脑中动脉栓塞模型的方式进行研究,通过大鼠尾静脉注入SA及PIDD抑制剂BubR1(Bub-ralated1,即纺锤体检测点spindle assembly checkpoin的重要组成成分),观察缺血再灌注大鼠脑组织中PIDD表达变化及其与caspase-2、caspase-3等下游靶标分子的关系,以及SA能否通过介导PIDD表达而发挥抗凋亡作用,从而减轻脑缺血神经功能损伤,为缺血性脑损伤的临床治疗提供有力的探索。
1 材料与方法
1.1 实验动物与分组所有动物协议均经安徽医科大学临床学院动物护理和使用机构委员会批准(批准号:LLSC20180149)。40只SPF级SD雄性大鼠,7~8周龄,体重在250~280 g之间,购于安徽医科大学实验动物中心(实验动物许可证号:34072922010002554)。将大鼠置于自然光照环境下,给予自由饮水及进食1周。随机将所有大鼠分为4组: 假手术组、缺血模型组、丹参多酚酸组、PIDD抑制剂组,每组10只。
1.2 动物模型制备及干预脑缺血模型按照Miao等[8]的方法建立。通过腹侧、中线切口暴露出右侧颈总动脉 (CCA)、颈外动脉 (ECA) 和颈内动脉 (ICA)。将具有圆形尖端(头端直径0.53 mm)的尼龙单丝缝合线引入 CCA 管腔并轻轻推进到 ICA 中,直到它阻塞大脑中动脉(MCA)的分叉起点。闭塞后2 h,通过撤回缝合线直到其尖端清除CCA的管腔,对动物进行重新麻醉和再灌注。所有的实验都是随机的。在缺血期间,死亡、昏迷或抽搐的大鼠被排除在实验之外。将SA(天津天士力子娇药业有限公司)和PIDD抑制剂(BubR1)分别溶于5%二甲基亚砜(DMSO)中,丹参多酚酸组和抑制剂组于术前1 h 100 mg/kg腹腔注射。在同样的时间点给假手术组和缺血模型组大鼠腹腔注射等量的等渗盐水。
1.3 神经功能缺损评分模型制备成功后分别在缺血再灌注后1 d、3 d、7 d对3组大鼠进行评分,采用改良的神经功能缺损评分(modified neurological severity scores, mNSS)[9],共 18分,其中轻度:1~6分; 中度:7~12分;重度:13~18分。
1.4 Western blot法检测梗死灶脑组织PIDD、caspase-2、t-BID、细胞色素-c、caspase-3的蛋白表达在脑梗死区域取脑组织标本。第一步:提取组织匀浆及蛋白。剪取组织并称重,每个样品重量控制在100 mg左右,加入1 mL RIPA细胞裂解液(内含1 mM PMSF)进行裂解,采取11 280×g,保持4 ℃离心15 min,收集含有组织总蛋白的上清液。第二步:电泳。配制10%SDS-PAGE凝胶备用,在收集的上清液中按照1∶4加入SDS-PAGE蛋白上样缓冲液,经上样后进行垂直电泳;分离后采用湿法转膜至聚偏二氟乙烯膜上,漂洗5 min后加入4%牛血清白蛋白(BSA),在摇床上缓慢摇动,室温封闭2 h;分别加入一抗维持4 ℃孵育过夜,洗涤后加入二抗室温再孵育2 h,并再次洗涤;最后使用化学发光试剂盒来检测蛋白。
1.5 荧光定量实验检测梗死灶脑组织中PIDD mRNA 表达取标本于梗死灶脑组织,按试剂盒说明书提取总RNA。第一步:RT反应。在0.2 mL 离心管中,加入总RNA(质量为1 μg)、10 μM低聚核苷酸(Oligo)(dT)1 μL、焦碳酸二乙酯水补足至12 μL,混匀、点动离心,PCR仪上65 ℃加热5 min,立即冰浴3 min,在上述EP管中加入各种试剂,置于42 ℃ 60 min,70 ℃ 5 min,最后取出上述反应液,即为cDNA,-80 ℃保存备用。第二步:荧光定量PCR反应。取出cDNA作为荧光定量的模板,反应条件为95 ℃ 5 min、95 ℃5 s、60 ℃30 s、40个循环。以β-actin为内参物,2-ΔΔCT计算所得结果。
1.6 TUNEL法检测各组梗死灶脑组织神经细胞凋亡情况为了研究 SA 是否可以改善脑缺血引起的神经细胞凋亡,使用大鼠局灶性脑缺血模型计算梗死灶脑组织神经细胞凋亡指数 (AI)。4组分别取10只大鼠于缺血再灌注7 d后取缺血脑组织,制成石蜡切片,根据操作说明使用ApopTag 荧光素原位凋亡检测试剂盒 (Roche) 进行TUNEL法检测,显微镜下观察细胞核中含有棕褐色颗粒者为凋亡细胞,计算4组神经细胞凋亡率进行比较,细胞凋亡指数(AI)为视野内凋亡细胞数占总细胞数的百分比。
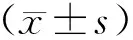
2 结 果
2.1 各组在不同时间点神经功能损伤评分结果假手术组在各时间点评分均为0分。其余3组在缺血再灌注后1 d的评分比较差异无统计学意义(P>0.05)。与缺血模型组比较,丹参多酚酸组神经功能缺损评分在3 d、7 d明显降低(P<0.01)。与抑制剂组比较,丹参多酚酸组的神经功能缺损评分在3 d、7 d明显增加(P<0.01)。见表1。
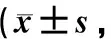
表1 各组大鼠缺血再灌注后不同时间神经功能缺损评分比较分)
2.2 SA对梗死灶脑组织PIDD mRNA表达的影响与假手术组比较,缺血模型组缺血再灌注后1 d、3 d和7 d的PIDD mRNA水平显著升高(P<0.01)。与缺血模型组比较,丹参多酚酸组缺血再灌注后1 d、3 d和7 d的PIDD mRNA水平显著降低(P<0.01),并且抑制剂组PIDD mRNA水平降低得更多(P<0.01),表明SA可以显著抑制缺血模型大鼠PIDD mRNA表达。见表2。
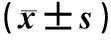
表2 各组大鼠缺血再灌注不同时间PIDD mRNA表达水平比较
2.3 SA对梗死灶脑组织PIDD、caspase-2、t-BID、细胞色素-c和caspase-3蛋白表达缺血模型组、丹参多酚酸组和抑制剂组缺血再灌注后PIDD表达明显高于假手术组(F=663.398、231.584、182.711,P<0.01),丹参多酚酸组缺血再灌注后PIDD 蛋白表达低于缺血模型组,高于抑制剂组(F=67.700、141.168、871.009,P<0.01),见图1。丹参多酚酸组、缺血模型组和抑制剂组缺血再灌注后7d的caspase-2、t-BID、细胞色素-c和caspase-3的表达均显著高于假手术组(F=2019.980、304.864、299.969、699.548,P<0.01),丹参多酚酸组再灌注后7d的caspase-2、t-BID、细胞色素-c和caspase-3 蛋白的表达显著低于缺血模型组但略高于抑制剂组(F=210.997、1027.480、613.917、612.462,P<0.01),见图2。

与假手术组比较,*P<0.01;与丹参多酚酸组比较,#P<0.01

与假手术组比较,*P<0.01;与缺血模型组及抑制剂组比较,#P<0.01
2.4 SA对梗死灶脑组织神经细胞凋亡的影响假手术组、缺血模型组、丹参多酚酸组和抑制剂组大鼠脑缺血再灌注后7 d神经细胞AI分别为(5.02±1.32)%、(53.25±4.16)%、(35.13±4.23)%、(24.5±5.14)%。400倍光镜下可见假手术组皮质区仅有少数或无凋亡细胞,细胞结构完整。缺血模型组可见大量凋亡神经细胞,细胞的胞核明显固缩,胞浆可见浓缩深染,核仁模糊不清,细胞浆及细胞核内呈棕褐色,与假手术组比较凋亡指数明显增高(P<0.05)。抑制剂组神经细胞凋亡情况最轻,凋亡指数明显低于缺血模型组和丹参多酚酸组(P<0.05),丹参多酚酸组细胞凋亡情况介于抑制剂组和缺血模型组之间,凋亡指数明显低于缺血模型组(P<0.05)。见图3。

a:假手术组;b:缺血模型组;c:丹参多酚酸组;d:抑制剂组
3 讨 论
PIDD即p53诱导的死亡结构域蛋白,DNA损伤后可产生含有富含亮氨酸重复序列的48 kDa N-末端片段(LRRs,PIDD-N)和含有死亡结构域(DD,PIDD-C)的51kDa C端片段,后者进一步裂解产生37 kDa片段(PIDD-CC)[10]。可分别介导两种信号传导途径,其中一种是触发caspase-2活化,可形成称为PIDDosome的复合物,从而造成细胞凋亡[11]。
Niizuma等[12]在短暂性全脑缺血(tGCI)模型中利用小干扰RNA(siRNA)处理来测试对PIDD表达的抑制,siRNA的施用对PIDD的抑制作用不仅减少了PIDD-CC的表达,还降低了procaspase-2和Bid的活性,导致tGCI后海马CA1亚区的组织学神经元损伤和DNA断裂减少。研究者提出PIDD是tGCI后神经元死亡的假设分子靶点。研究结果显示PIDD在procaspase-2激活和延迟tGCI(短暂性全脑缺血)后CA1神经元死亡中起重要作用。Jang等[13]研究中发现,新型TAT融合肽,RDH3和PDH3,它们对PIDDosome的形成产生强烈的负面影响,并能够拯救鱼藤酮处理的神经元细胞死亡,提示PIDDosome是神经细胞凋亡过程的重要角色。Wan等[14]研究显示,PIDD在损伤后的脑组织中表达明显上升,损伤后3 d左右表达达到顶峰,之后表达下降,在约 14 d左右回到正常水平,并且主要定位于神经元之中,推测PIDD可能是决定脑损伤神经元命运的重要调节因子。
本研究中大鼠脑缺血模型制备成功后,缺血模型组、丹参多酚酸组和抑制剂组1 d、3 d、7 d PIDD mRNA表达高于假手术组,说明急性脑缺血后可诱导脑组织中PIDD mRNA表达上调,介导神经细胞凋亡过程。丹参多酚酸组1 d、3 d、7 d PIDDmRNA表达明显低于缺血模型组,但稍高于抑制剂组。抑制剂BubR1,一种有丝分裂监视蛋白,是一种直接的PIDDosome抑制剂,可以结合PIDD DD,与RAIDD募集竞争,在PIDD对接站点上超越了RAIDD,抑制PIDDosome介导的细胞凋亡[15]。本研究实验结果显示丹参多酚酸也能抑制PIDD表达从而发挥抑制细胞凋亡的作用,它是否也如BubR1一样,通过与RAIDD竞争招募来抑制PIDDosome的形成而产生作用有待进一步研究。但仍可说明注射用丹参多酚酸可通过抑制PIDD的表达,从而发挥改善神经功能的作用,虽然未能达到和PIDD的抑制剂BubR1同等水平的作用,但作用效果是一致的。
PIDD诱导细胞凋亡可通过PIDD/caspase-2/t-BID/细胞色素-c/caspase-3信号通路进行[15-17],caspase-3是凋亡级联反应过程中关键的蛋白酶,受上游蛋白酶的活化,活化的caspase-3又参与激活下游底物,诱发细胞凋亡,而细胞色素c(cyt-c)从线粒体释放到细胞质中,可诱导神经细胞凋亡[18]。Ray等[15]在结直肠癌细胞凋亡机制研究中发现,PIDD表达激活caspase-2,后者继而裂解BID以产生活性t-BID,进而引起MTP损失,细胞色素c从线粒体间隙释放及下游caspase-3的激活。而Wang等[16]研究发现碘-131通过PIDD/caspase-2/t-BID/细胞色素-c /caspase-3信号通路诱导心肌细胞凋亡。Shi等[17]也发现PIDD的表达与肝细胞癌细胞增殖和凋亡有关。
本研究中丹参多酚酸组、缺血模型组、抑制剂组第7天caspase-2、t-BID、细胞色素-c、caspase-3 蛋白表达均明显高于假手术组,显示在脑缺血损伤后凋亡相关因子caspase-2、t-BID、细胞色素-c、caspase-3蛋白表达显著升高,而丹参多酚酸组第7天PIDD、caspase-2、t-BID、细胞色素-c、caspase-3蛋白表达明显低于缺血模型组,提示注射用丹参多酚酸改善大鼠神经功能缺损,对大鼠脑缺血再灌注损伤的保护机制可能与PIDD/caspase-2/t-BID/细胞色素-c/caspase-3信号通路有关。
综上所述,本实验研究结果表明:注射用丹参多酚酸可能通过介导PIDD/caspase-2/t-BID/细胞色素-c/caspase-3信号通路,下调PIDD及其下游凋亡相关因子caspase-2、t-BID、细胞色素-c、caspase-3的表达,发挥改善神经功能缺损的作用。
