基于体外巨噬细胞极化作用进行异种血管组织脱细胞评价的实验研究△
2022-06-27王喜春梁远锋林展翼
王喜春,梁远锋,林展翼,3
[1.华南理工大学医学院,广州 510006;2.广东省人民医院(广东省医学科学院),广州 510080;3.广东省老年医学研究所,广州510080]
细胞外基质(extracellular matrix,ECM)材料作为一种生物材料来源于哺乳动物的组织,可以用来修复或替代各种受损器官和组织,例如心脏、食管、肌腱、真皮等[1-2]。ECM 的获得是通过对天然组织进行有效的脱细胞,实现完全去除细胞和细胞碎片等抗原成分,同时保留ECM 的生化组成、生物活性、三维结构以及ECM 的完整性,从而降低植入体内的免疫原性[3]。对于血管这样一种对力学性能要求比较高的移植支架材料来说,如何选择合理的评价指标来评价洗脱效果尤其重要。既往研究已经表明,巨噬细胞是宿主应对植入材料的第一效应细胞,通常分为促炎型的M1 表型和促重构的M2 表型[4]。M1 表型产生大量的促炎信号和细胞因子介导慢性炎症的持续,损害组织再生和伤口愈合。M2 表型分泌抗炎因子发挥抗炎症能力,可以减轻急、慢性炎症的发生,同时通过促进祖细胞和干细胞的增殖分化,协调ECM 的再组装和重构[5]。未完全洗脱细胞的材料将含有残存DNA,势必对巨噬细胞的极化产生影响。本研究拟通过建立巨噬细胞极化影响的体外实验研究,评价血管ECM 材料内DNA 浓度是否超“阈值”,评判材料植入体内的长期效果。
1 材料和方法
本研究已经由南方医科大学伦理委员会批准(审查号L2019225),所有程序都遵循其操作规范及指导原则进行,实验动物均来自南方医科大学实验动物中心。
1.1 脱细胞血管的制备
获取成年牛新鲜主动脉,保存在含有1%青链霉素的磷酸盐缓冲液(phosphate buffer solution,PBS)(pH7.4)中。脱细胞方法参考之前文献的方法[6]。简言之,将牛主动脉放入3-[(3-胆酰胺基丙基)二甲氨基]-1-丙磺酸内盐[3-(3-Cholamidopropyl)dimethylammonium-1-propanesulfonate,CHAPS]和十二烷基硫酸钠(sodium dodecyl sulfate,SDS)脱细胞溶液中进行洗涤。最后用含10%胎牛血清的PBS 中漂洗。其中SDS 脱细胞时间设置为36 h 和24 h 两组,将制备好的脱细胞血管放入PBS 缓冲液中4 ℃保存。
1.2 苏木素-伊红染色及DNA 定量
将脱细胞前后的血管用4%多聚甲醛固定2 d,石蜡包埋,切成5 μm 切片。切片用苏木精-伊红染料染色。同时进行DNA 定量,将脱细胞前后的牛主动脉(n=6)冷冻保存后,冻干称重,再用木瓜蛋白酶溶液(125 μg/mL 木瓜蛋白酶,5 mmol/L 半胱氨酸及5 mmol/L 乙二胺四乙酸)常温下消化过夜。消化后的溶液用TE 缓冲液(10 mmol/L Tris-HCl 及1 mmol/L 乙二胺四乙酸,pH7.5)稀释,用等体积的QuantiTTM PicoGreen dsDNA 试剂孵育,在485 nm 激发波长和530 nm 发射波长下测定荧光值,根据标准品的浓度和对应的荧光值画出标准曲线方程,最后计算样本浓度。
1.3 溶解性细胞外基质的制备
脱细胞牛主动脉ECM 溶液的制备参考之前的方法[7]。简单来说,将脱细胞ECM 冻干后研磨成粉末状,然后用10 mg/mL 胃蛋白酶将粉末消化成溶液状态,消化过程在37 ℃条件下进行。接着将可 溶性 的ECM 用1/10 体积0.1 mol/L 的NaOH 和1/9 体积的10×PBS 中和至pH 为7.4,放在4 ℃条件下备用。
1.4 巨噬细胞的极化
雄性2~3 个月龄的SD 大鼠通过颈椎脱臼实施安乐死。在无菌条件下,切除后肢皮肤,分离出胫骨和股骨。剪开骨的一端,并用巨噬细胞完全培养基冲洗骨髓腔并收集骨髓,该培养基包括DMEM、10%胎牛血清、100 U/mL的青霉素、100 μg/mL 的链霉素。无菌PBS洗涤骨髓细胞,并以106个/mL 的密度接种在六孔板上。将六孔板置于37 ℃、5%二氧化碳的培养箱在中,每48 h换液一次,培养7 d。7 d 后使用基础培养基加刺激因素进行极化原始巨噬细胞:(1)20 ng/mL γ 干扰素(γ-IFN)和100 ng/mL的脂多糖(LPS)刺激形成M1型巨噬细胞;(2)20 ng/mL白细胞介素(interleukin,IL)-4刺激形成M2型巨噬细胞;(3)SDS脱细胞时间为24 h的血管基质材料刺激形成M24hSDS表型;(4)SDS 脱细胞时间为36 h 的血管基质材料刺激形成M36hSDS表型。在37 ℃、5%二氧化碳的培养基中培养24 h。
1.5 巨噬细胞表型及分泌细胞因子鉴定
刺激24 h 后,细胞使用TRIzol 试剂分离总RNA。总RNA 使用PrimeScript®RT Master Mix 试剂盒(Taraka)逆转录成cDNA。采用定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)定量基因表达,最终反应体积为10 μL,包括TB Green(Taraka)、10 μmol/L 正向和反向引物和4 ng cDNA(引物序列见表1),在qPCR 仪器上运行。使用GraphPad Prism8.3 对数据进行分析。以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,计算相对表达量2-ΔΔCT。

表1 基因引物序列
1.6 统计学分析
使用GraphPad Prizm 8.3 统计软件对数据进行分析。所有的数据均以()表示,以单因素方差分析进行检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同方法脱细胞后血管表征比较
对原生动脉以及两种方法脱细胞的牛主动脉进行苏木素-伊红染色(图1 A-C)。结果可见新鲜原生动脉结构清晰,可见大量完整细胞核。牛主动脉24 h SDS 脱细胞后,苏木素-伊红染色未见明显完整的细胞核,但可看到较多的残存细胞碎片。牛主动脉36 h SDS 脱细胞后可见血管结构完整,未见残留核。Picogreen 法DNA 定量可见24 h SDS 脱细胞后DNA 浓度为(121.01±4.09)ng/mg,>50 ng/mg干重(图1D)。36 h SDS 脱细胞的牛主动脉DNA 浓度为(9.46±0.75)ng/mg,小于<50 ng/mg干重(图1D),符合脱细胞标准。
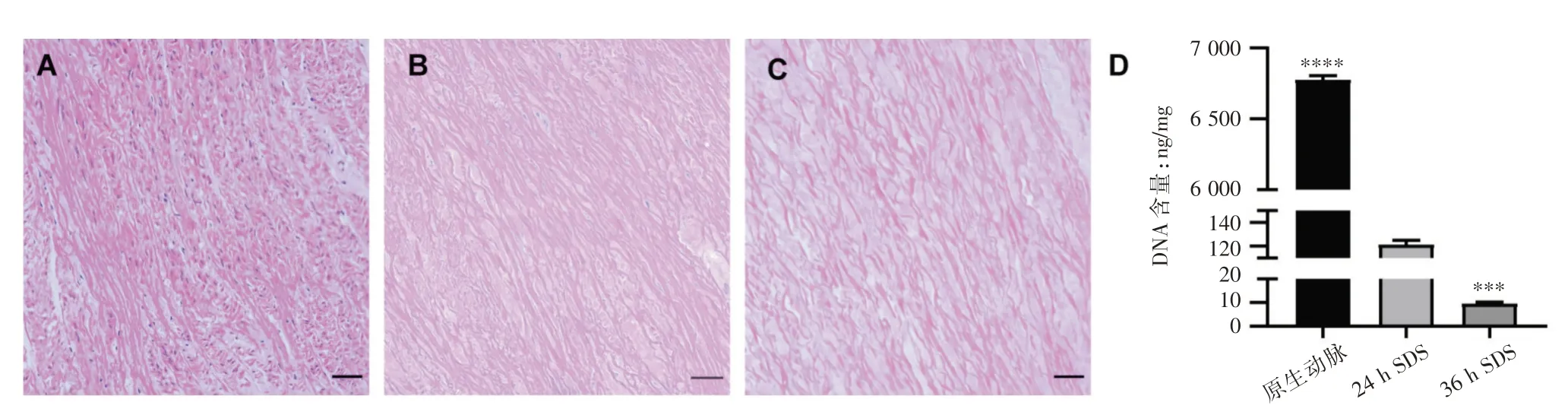
图1 不同方法脱细胞后血管表征光学显微镜下图像(标尺:50 μm;A:原生牛主动脉苏木素-伊红染色显微镜下图像;B:SDS 脱细胞为24 h 的牛主动脉苏木素-伊红染色显微镜下图像;C:SDS 脱细胞为36 h 的牛主动脉苏木素-伊红染色显微镜下图像;D:Picogreen 法DNA 定量)
2.2 不同表型巨噬细胞表面标记基因表达比较
利用qPCR 法对不同刺激因素所得的巨噬细胞表面标志物进行分析。M1 表型iNOS 和CD80 的表达明显增加,M2 表型CD206 和CD163 的表达升高。与24 h 脱细胞表型M24hSDS促炎性巨噬细胞表面标志物iNOS 和CD80 的表达量相比,SDS 脱细胞时间为36 h 的脱细胞血管基质材料刺激获得的巨噬细胞M36hSDS表达量要明显减少,差异有统计学意义(P<0.05);而对促重构巨噬细胞的表面标记物CD206 和CD163,M36hSDS表型较M24hSDS表型表达明显增加,差异有统计学意义(P<0.05),详见图2。
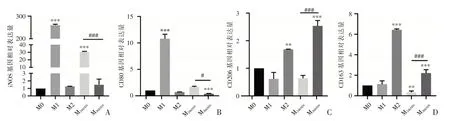
图2 不同表型巨噬细胞表面标记基因表达比较(A:M1 表型表面标记物iNOS 的表达;B:M1 表型表面标记物CD80 的表达;C:M2 表型表面标记物CD206 表达;D:M2 表型表面标记物CD163 表达)
2.3 不同表型巨噬细胞分泌的细胞因子基因表达比较
不同表型巨噬细胞分泌的细胞因子基因分析比较,见图3。IL-1B 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在M1 表型表达增加。M36hSDS表型与M24hSDS表型相比,IL-1β和TNF-α的表达明显较少,差异有统计学意义(P<0.005)。M36hSDS表型与M24hSDS表型相比,TNF-α 的表达明显减少,差异有统计学意义(P<0.005)。IL-10 在M1 表型表达较M2 表型增加。M36hSDS表型与M24hSDS表型相比,IL-10 的表达明显减少,差异有统计学意义(P<0.005)。
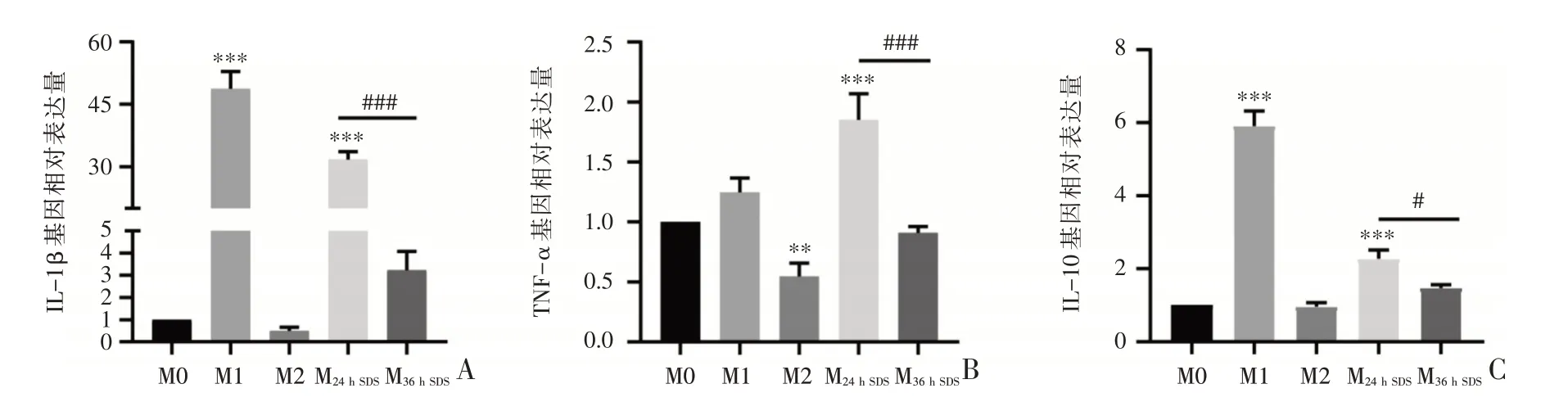
图3 不同表型巨噬细胞分泌的细胞因子基因表达分析(A:细胞因子IL-1β 基因表达;B:细胞因子TNF-α 表达;C:细胞因子IL-10 的表达)
3 讨论
自体血管来源的局限性以及取血管带给患者二次创伤等问题,使得异种来源血管或者异种细胞构建的组织工程血管成为必然趋势,而美国Niklason团队已经使用来源于牛的平滑肌细胞成功构建出组织工程血管并进入到Ⅲ期临床试验[8-9]。但是,由于这些材料中存在完整的异体或异种DNA 物质,必须有效去除其抗原表位和细胞成分,才能降低植入后宿主的不良免疫反应。目前脱细胞的方法各式各样,如何选择理想的方法进行恰当的洗脱非常重要,特别是对于血管组织这种移植之后马上就要承受一定压力血液冲刷的材料。
异种脱细胞基质材料制备的多个过程,包括脱细胞的有效性及脱细胞后的修饰,均会影响植入体内材料-宿主相互作用过程,进一步决定远期重构反应和功能结果。之前有研究显示CHAPS 联合SDS 的脱细胞方案中经过24 h SDS 脱细胞处理,可以去除人脐动脉及大鼠主动脉细胞及残留细胞碎片,使得DNA 浓度低于50 ng/mg,达到公认的脱细胞纯度[10-11]。但是正如本研究所发现,24 h SDS脱细胞后牛主动脉仍然有残留细胞核及细胞碎片,并不能达到像其他动脉同样的脱细胞纯度,将SDS 脱细胞时间延长至36 h 才可使得DNA 浓度低于50 ng/mg。这也说明了尽管脱细胞的原则是简单的,但具体操作过程比较复杂,必须考虑到种属来源、组织来源等因素[3]。
既往研究一般是选择免疫荧光的方法测定组织残余DNA 浓度,但是如何进一步评价材料未来移植进入体内可能引起的免疫反应,一直没有很好的方法。近年来随着对巨噬细胞相关表型研究的深入,发现巨噬细胞存在M1 和M2 两种不同表型,它可以随着环境变化在这两种表型之间转化,即巨噬细胞极化现象。M1 型巨噬细胞与急性炎症相关,而M2 型巨噬细胞与组织再生相关。之前Badylak[12]团队所开展的研究结果显示,充分去细胞化的小肠黏膜将促进巨噬细胞表型从M1 向M2的转化有关。而在灵长类动物模型研究中发现,支架内细胞的存在及促炎细胞因子数量的增加可以带来巨噬细胞M1 表型的增加,与不良重构结果有关。植入含有细胞成分的异种ECM 支架会导致单核细胞浸润的经典炎症过程级联,包括植入后3 d 主要为M1 表型的巨噬细胞[13]。因此,通过体外巨噬细胞极化结果,将可以提前预知材料移植后的中远期效果。
巨噬细胞分泌的细胞因子是其发挥生物功能的关键成分。本研究结果显示异种血管组织经过36 h 洗脱后,诱导的M36hSDS表型对促炎型细胞因子IL-1β、TNF-α 的表达量要明显减少。IL-10 是抗炎型细胞因子,既往认为在人和小鼠体内是由M2型巨噬细胞分泌,而本研究中在M1 型巨噬细胞及M24hSDS表型表达增加,与之前大鼠巨噬细胞极化的研究结果一致[14]。
本研究的结果表明,生物支架材料的脱细胞化效果是巨噬细胞表型反应的一个重要因素。除了测定残存DNA 之外,体外诱导巨噬细胞极化的方法是对异种或异体组织脱细胞处理效果的客观评价手段之一。