人脐带间充质干细胞治疗小鼠急性肺损伤的安全性及有效性研究
2022-06-25陈千晴别亚男陈柏羽许佳欢欧宝芳谢水林吴少瑜
陈千晴别亚男陈柏羽许佳欢欧宝芳谢水林吴少瑜∗
(1.南方医科大学药学院,广州 510515;2.广东药科大学生命科学与生物制药学院,广州 511436;3.华南理工大学生物科学与工程学院,广州 510006)
新型冠状病毒(COVID-19)感染引起的全球疫情使急性肺损伤(acute lung injury, ALI)再次受到大众的关注[1]。 ALI 发病急骤、病死率高,死亡率在在34.9%~46.1%之间[2]。 多种原因可引起急性肺损伤,如吸入性肺炎[3]、肺挫伤、多次输血、脓毒血症等[4]。 脂多糖(lipopolysaccharide,LPS)可诱导炎症反应,模拟脓毒血症引起的ALI[5]。 ALI 发病机制较为复杂,免疫调节反应是最为关键的因素[6]。
间充质干细胞是一种具有自我更新、多向分化、免疫调控等特点的多潜能组织干细胞[7],可通过强大的抗炎[8]和免疫调节[9]功能减少肺部炎细胞浸润[10],抑制炎症因子分泌,从而减轻肺损伤。干细胞主要通过旁分泌功能(包括细胞因子、生长因子以及外泌体等)与巨噬细胞、T 细胞、NK 细胞等接触发挥免疫调控作用。 研究表明,干细胞条件培养基雾化给药可治疗小鼠肺炎[11],为ALI 提供了新的治疗选择。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
清洁级成年健康新西兰兔1 只,雄性,6 月龄,体重2.5~2.7 kg,由南方医科大学实验动物中心提供[SCXK(粤)2021-0041]。 SPF 级C57BL/6 雄性小鼠82 只,6 ~ 8 周龄,体重18 ~ 22 g。 SPF 级BALB/c-nu 雌性小鼠27 只,15~21 d,体重18~20 g。 均购自珠海百试通生物科技有限公司[SCXK(粤)2020-0051]。 实验动物均饲养于广州华腾生物医药科技有限公司[SYXK(粤)2020-0237],小鼠饲养条件符合SPF 级要求。 环境温度维持在20℃~24℃,湿度维持在40%~70%,明暗比为12 h/12 h,动物可自由饮水及摄食。 实验及研究过程给予动物人道主义关怀,遵循“3R 原则”,研究方案经广州华腾生物医药科技有限公司实验动物伦理委员会(HTSW210211、HTSW210516)审查通过。
1.1.2 细胞
人脐带间充质干细胞购自广州塞莱拉干细胞科技股份有限公司,编号为Y2023QD01141;Hela 细胞购自广州辉园苑医药科技有限公司。
1.2 主要试剂与仪器
脂多糖(L861706, 麦克林); DMEM/F-12(Gibco,C11330500BT);EDTA(Gibco,25200-056);
氯化钠注射液(辰欣药业股份有限公司);苏木素(美国Sigma 公司);伊红染液(天津光复精细化工有限公司);瑞氏-姬姆萨复合染液(索莱宝,G1020)。 生物显微镜(舜宇光学科技(集团)有限公司);组织切片机(RM2245,德国徕卡Leica 公司);雾化仪(鱼跃,M104 网式雾化器);电子精密天平(倍尔BEL)。
1.3 实验方法
1.3.1 HUC-MSCs 的准备
HUC-MSCs 培养于含10%胎牛血清的DMEM/F-12 培养基中,隔天换液,2~3 d 传代1 次。 待细胞传代至P6 代,培养48 h 后收集贴壁细胞上清液,在4℃条件下以3000 r/min 离心15 min 去除细胞碎片。 收集离心后上清用于雾化治疗组。 使用0.05%含EDTA 胰酶消化收集细胞,用于尾静脉注射治疗组。
1.3.2 HUC-MSCs 致瘤性实验
27 只BALB/c-nu 雌性小鼠随机分成3 组:阴性对照组(等体积生理盐水)、阳性对照组(1×106个Hela 细胞)、HUC-MSCs 组(1×107个HUC-MSCs 细胞[12]),每组9 只,各组均采用皮下注射给药。 每周观察2 次体重、瘤体大小、是否成瘤,持续观察1 个月。 按照公式V=π×ab2/6(V:体积,a:肿瘤长径,b:肿瘤短径)计算肿瘤体积。
1.3.3 体外溶血实验
将实验分为3 组:阴性对照组、阳性对照组、HUC-MSCs 组,每组设置3 个平行对照。 取新鲜兔血脱纤处理,分别加入2.5 mL 生理盐水、纯净水、HUC-MSCs(1×106cells)。 混匀每组血液样本后静置于37℃水浴锅中,3 h 后观察血样样本是否有溶血和凝集现象。
1.3.4 HUC-MSCs 的急性毒性实验
(1)40 只C57BL/6 雄性小鼠随机分为4 组:3 个不同剂量的受试细胞组、对照组,每组10 只小鼠。 (2)给药方案:受试细胞组分别尾静脉注射4×105、8×105、1×106个人脐带间充质干细胞,对照组尾静脉注射灭菌生理盐水,各组给药总体积0.2 mL。 (3)观察:注射后4 h 观察小鼠毒性反应,包括小鼠摄食量、体重变化等指标,记录小鼠死亡情况,此后连续观察记录28 d。
1.3.5 急性肺损伤(ALI)模型构建及评分
12 只C57BL/6 雄性小鼠随机分为3 组:对照组、滴鼻组、腹腔注射组,每组4 只,分别使用LPS(10 mg/kg)缓慢滴鼻或腹腔注射构建模型。
各组肺组织HE 染色后采用McGuigan 评分法[13]判定急性肺损伤程度,评分根据:(1)肺泡壁增厚或透明膜形成;(2)肺泡充血;(3)血管壁或肺泡腔炎性细胞浸润;(4)出血。 每组随机抽取5 个视野对以上4 个评分根据进行急性肺损伤半定量检测评分分析。
1.3.6 HUC-MSCs 治疗小鼠急性肺损伤
30 只C57BL/6 雄性小鼠随机分为5 组:对照组、模型组、尾静脉注射治疗组、雾化对照组、雾化治疗组,每组6 只。 小鼠选用LPS(10 mg/kg)腹腔注射造模,6 h 后给予HUC-MSCs 尾静脉注射治疗(MSCs-IOCV,5×107cells/kg)。 实验收集HUCMSCs 条件培养基用于雾化治疗组(CM-atomization,2 mL)给药,雾化对照组小鼠使用同剂量空白培养基雾化给药。
1.3.7 BALF 炎症细胞分类计数
LPS 造模后96 h,分离暴露支气管,注射器吸取1 mL PBS 插入右主支气管灌洗肺部,重复3 次,回收率80%以上。 将肺泡灌洗液在4℃条件下以1500 r/min 离心10 min,去除上清,加入100 μL PBS 重悬。 取10 μL 重悬液于载玻片上涂抹展开,风干5~10 min,固定15 min,使用瑞氏-姬姆萨染色法染色。镜下选取3 个视野进行炎症细胞分类计数。
1.4 统计学方法
应用IBM SPSS 25.0 进行实验数据分析,使用GraphPad Prism 9 软件作图。 计量资料用平均数±标准差(±s)表示,使用重复测量方差分析、单因素方差分析进行组间差异分析,组间多重比较采用LSD-t检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 两种给药方式导致的急性肺损伤程度比较
肺组织HE 染色显示滴鼻组小鼠肺泡壁厚度均匀,肺泡未见炎性渗出物,血管附近有少量炎性细胞浸润。 腹腔注射组小鼠肺泡壁增厚,伴炎性细胞浸润,多处支气管及血管周围淋巴细胞灶性浸润,并见淋巴小结形成,偶见支气管内出血(图1A)。
McGuigan 评分结果显示,腹腔注射组评分与对照组相比显著升高(P<0.01),肺损伤程度对比滴鼻组明显加重(P<0.05)(图1B)。
2.2 人脐带间充质干细胞致瘤性实验
小鼠皮下注射HUC-MSCs 后持续观察28 d,注射部位未见肿瘤形成,与阴性对照组结果一致,无致瘤性(图2A)。 阳性对照组小鼠皮下注射Hela 细胞后10 d 观察到肿瘤形成,并逐渐增大(图2B),成瘤率100%,小鼠肿瘤平均直径不超过20 mm,生长不超过原体重10%。
2.3 致瘤性实验小鼠组织病理切片
观察期结束后,解剖各组小鼠脏器并进行HE染色(图3A)。 HUC-MSCs 组、阴性对照组各脏器病理学检查均未发现异常。 阳性对照组小鼠脾白髓数量减少,淋巴细胞减少,红髓大量髓外造血细胞增生,伴有多量中性粒细胞浸润;肺泡壁增厚,伴有较多中性粒细胞浸润。 肿瘤细胞密集排列,胞核异型性低,核质比大,胞浆呈嗜碱性,多见核分裂像(图3B)。
2.4 人脐带间充质干细胞的急性毒性实验
各组小鼠尾静脉注射给药后均未出现死亡,记录给药后28 d 小鼠体重及摄食。 各组小鼠体重均正常增长(图4A),摄食正常(图4B),差异无统计学意义。
对各组小鼠的心、肝、脾、肺、肾进行病理学检查,HE 染色结果显示各脏器组织未见坏死或炎症反应(图4C)。 以上结果显示,尾静脉注射人脐带间充质干细胞(4×105~1×106cells)不会引起急性毒性反应。
2.5 人脐带间充质干细胞的体外溶血实验
在3 h 内阳性对照组有明显溶血现象,HUCMSCs 组、阴性对照组上层澄清透明,下层细胞沉淀较多,无溶血现象发生(图5A)。 各组血液样本重悬后于显微镜下观察,阳性对照组红细胞破裂,红细胞数明显减少,HUC-MSCs 组、阴性对照组无溶血和致红细胞凝集作用(图5B)。
2.6 人脐带间充质干细胞治疗急性肺损伤的有效性评价
各治疗组肺组织HE 染色结果显示,HUC-MSCs尾静脉注射治疗后可见炎症缓解,肺泡壁无增厚(图6A),肺损伤评分明显下降(图6C)。 HUCMSCs 条件培养基雾化治疗后小鼠肺泡壁仍可见少量炎性细胞散在浸润,肺泡壁未见明显增厚,损伤评分介于模型组和尾静脉注射治疗组(MSCs-IOCV组)之间(图6C)。 雾化对照组肺组织可见弥漫性肺间质增厚,肺泡腔缩小。
采用瑞氏-姬姆萨染色法观察各组BALF(图6B)的炎性细胞总数和分类计数,尾静脉注射治疗组巨噬细胞数明显高于模型组(图6D),雾化治疗组巨噬细胞数介于两组之间。
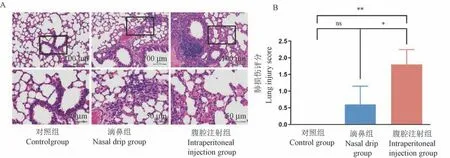
注:A:肺组织HE 染色;B:肺损伤McGuigan 评分。 与同期相应组别比,∗P<0.05,∗∗P<0.01,nsP>0.05。图1 脂多糖诱导的肺病理改变及McGuigan 评分结果(n=5)Note. A, HE staining of lung tissue. B, McGuigan score for lung injury. Compared with corresponding groups in the same period, ∗P<0.05, ∗∗P<0.01, nsP>0.05.Figure 1 Lipopolysaccharide induced lung pathological changes and McGuigan score results
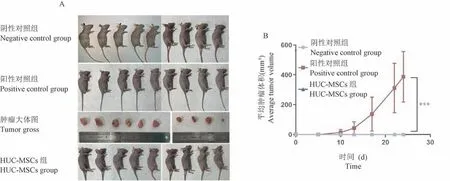
注:A:接种28 d 后肿瘤的大体图;B:平均肿瘤体积。 与同期相应组别比,∗∗∗P<0.001。图2 人脐带间充质干细胞体内致瘤性研究Note. A, Macroscopic images of tumor 28 days post-inoculation. B,Average tumor volume. Compared with corresponding groups in the same period, ∗∗∗P<0.001.Figure 2 Tumorigenicity of human umbilical cord mesenchymal stem cells in vivo
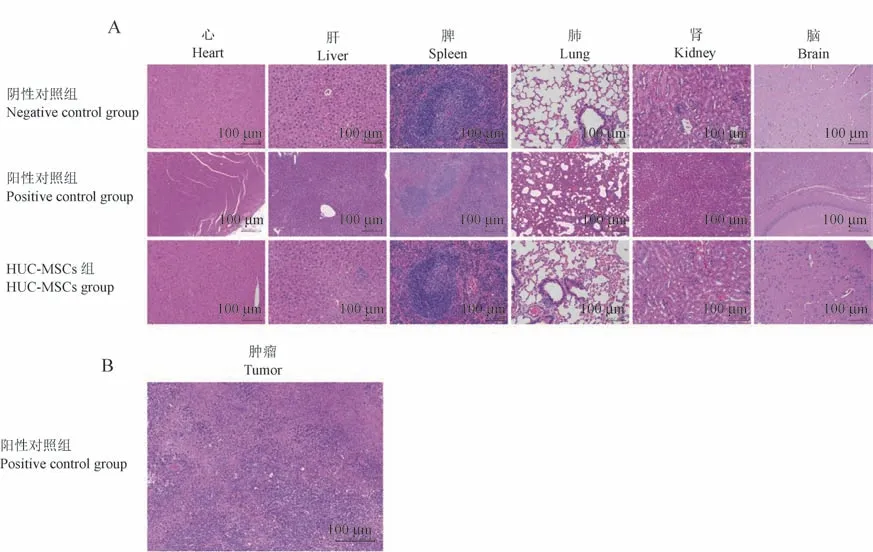
注:A:致瘤性实验小鼠各脏器HE 染色;B:阳性对照组小鼠肿瘤HE 染色。图3 致瘤性实验小鼠组织HE 染色Note. A, HE staining of organs in tumorigenic experimental mice. B, HE staining of tumors in mice in the positive control group.Figure 3 HE staining of tumorigenic experimental mouse tissues
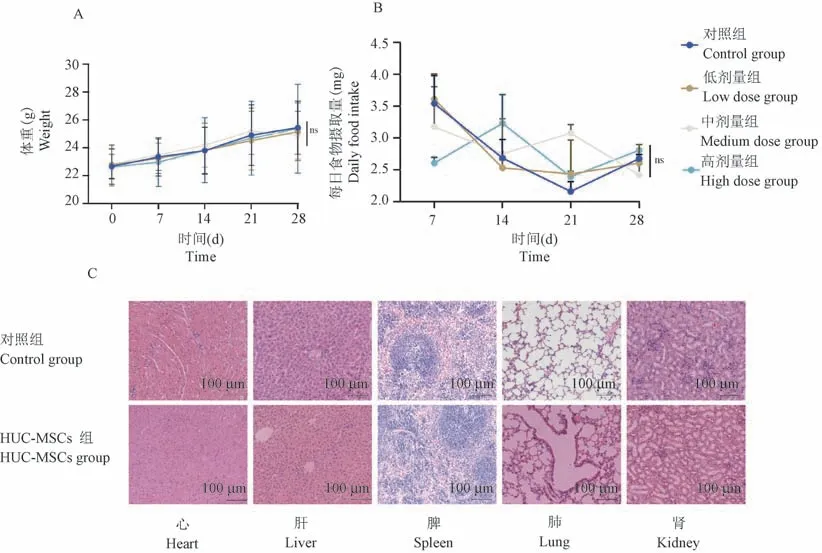
注:A:小鼠体重-时间曲线;B:小鼠摄食-时间曲线;C:小鼠各脏器HE 染色。 与同期相应组别比,nsP>0.05。图4 人脐带间充质干细胞尾静脉注射的急性毒性实验Note. A, Body weight of mice were measured once per week. B,Total amount of food intake were measured once per week.C, HE staining of various organs in mice. Compared with corresponding groups in the same period, nsP>0.05.Figure 4 Acute toxicity of HUC-MSCs injected into tail vein of mice

注:A:体外溶血实验肉眼观察;B:体外溶血实验光镜观察结果。图5 人脐带间充质干细胞体外溶血实验Note. A, Visualizing of hemolysis experiment in vitro. B, Observation results of hemolysis test in vitro under light microscope.Figure 5 Hemolysis experiment of human umbilical cord mesenchymal stem cells in vitro
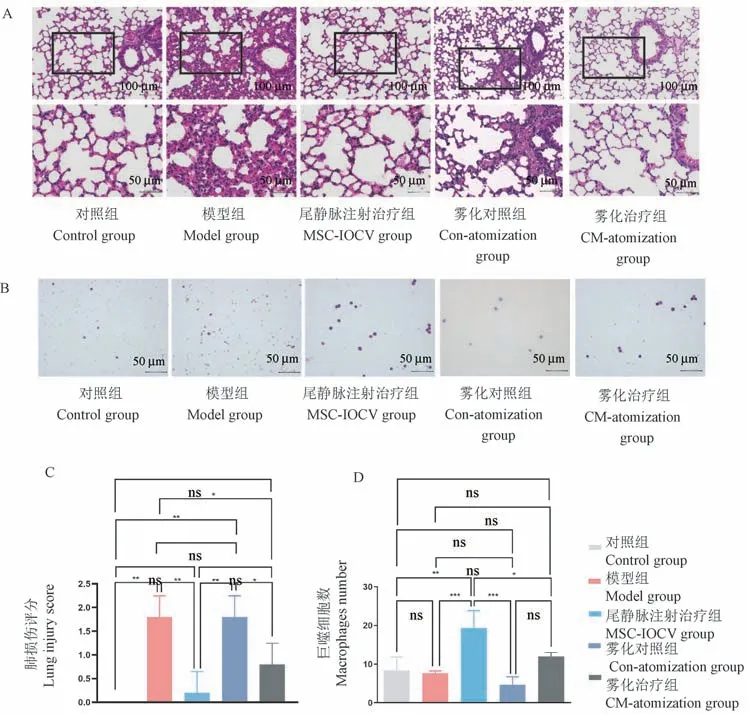
注:A:肺组织HE 染色;B:BALF 瑞氏-姬姆萨染色;C:肺损伤McGuigan 评分(n=5);D:BALF 巨噬细胞数(n=3)。 与同期相应组别比,∗P<0.05,∗∗P<0.01,∗∗∗P<0.001,nsP>0.05。图6 人脐带间充质干细胞治疗急性肺损伤的有效性评价Note. A, HE staining of lung tissue. B, BALF Wright-Giemsa staining. C, McGuigan score for lung injury (n=5). D, Number of BALF macrophages (n=3). Compared with corresponding groups in the same period, ∗P<0.05,∗∗P<0.01,∗∗∗P<0.001,nsP>0.05.Figure 6 Efficacy of human umbilical cord mesenchymal stem cells in the treatment of acute lung injury
3 讨论
急性肺损伤(ALI)是呼吸系统常见的危重症之一[14],其发展与炎症相关,关键因素是抗炎因子/促炎因子水平失衡,伴随着促炎因子的大量释放[15],进一步发展可引发急性呼吸窘迫综合征(acute respiratory distress, ARDS)甚至死亡[16]。 临床上可选择的治疗方法较为局限,仍停留在支持治疗的层面。
本研究采用滴鼻[17]或腹腔注射LPS[18]给药法构建急性肺损伤模型,通过肺组织病理McGuigan 评分对比两种造模方式的优劣。 病理结果显示,两种造模方法均出现一定程度的肺损伤,滴鼻给药模型损伤部位主要集中在主支气管,肺内分布不均,组内差异较大,重复性较差。 且造成的肺损伤程度较轻,偶见血管周围少量炎细胞浸润;腹腔注射给药实验结果与Nie 等[19]一致,LPS 均匀分布于小鼠肺部,肺泡壁明显增厚,伴大量炎细胞浸润,肺损伤程度更严重,重复性好。
随后我们评估HUC-MSCs 治疗ALI 的安全性[20]及有效性[21]。 安全性实验结果显示:HUCMSCs 对兔红细胞无溶血反应;裸鼠皮下注射HUCMSCs 无致瘤性;临床安全剂量下[22](4×105~1×106cells/kg)尾静脉注射HUC-MSCs 28 d 后不会引起急性毒性反应,无动物死亡;且病理结果显示HUCMSCs 静脉注射后多脏器未见明显异常。 这提示通过标准化的质检评估,本批次获得的HUC-MSCs 应用于动物治疗有较高的安全性。 有效性结果显示:尾静脉单次注射5×107cells/kg HUC-MSCs 后ALI小鼠的肺泡损伤减轻,McGuigan 评分降低,肺组织炎细胞明显减少。 这表明间充质干细胞是ALI 的一种有效的治疗方法。 研究表明,间充质干细胞可通过外泌体诱导肺泡Ⅱ型细胞再生[23]、防止肺毛细血管内皮细胞凋亡、抑制免疫细胞的浸润[24],促进空气-肺泡屏障修复、抑制细菌生长,从而降低ARDS的严重程度,避免发展成ARDS[25]。
为了进一步评估HUC-MSCs 旁分泌功能[26]在ALI 中的治疗作用,本研究采用HUC-MSCs 条件培养基雾化给药[27]方式替代干细胞治疗。结果表明:使用HUC-MSCs 条件培养基单次雾化治疗ALI 小鼠能缓解小鼠肺部炎症反应。 但由于HUC-MSCs 条件培养基中外泌体含量较少,雾化治疗组McGuigan评分介于模型组与尾静脉注射治疗组之间。 进一步分析各组肺泡灌洗液炎症细胞群,发现两个治疗组中巨噬细胞数明显增加,这表明巨噬细胞在MSCs治疗急性肺损伤的进程中发挥关键作用。
综上,腹腔注射LPS 构建的急性肺损伤模型操作简单稳定,重复性高,造成的肺损伤效果较好。两种治疗方式均能缓解小鼠肺部炎症,其中尾静脉注射组效果明显优于雾化治疗组,可有效降低急性肺损伤小鼠McGuigan 评分。
