咖啡酸与牛血红蛋白的相互作用及抗氧化研究
2022-06-23周向军邹亚丽孙文媛高义霞
周向军,邹亚丽,孙文媛,高义霞
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
咖啡酸(caffeic acid,CA)又称3,4-二羟基肉桂酸,是一种天然酚酸类化合物,广泛存在于中药材[1]、咖啡、蔬菜、水果等食物中,具有抗病毒[2]、抗癌[3]、抗氧化[4]、抗菌[5]、保护心血管[6]和红细胞[7]以及降血糖[8]等功效。血红蛋白是脊椎动物体内运输O2和小分子活性化合物的别构蛋白,由珠蛋白和血红素组成,具有维持血液酸碱平衡和作为天然食品添加剂[9]等功能。牛血红蛋白(bovine hemoglobin,BHb)与人血红蛋白一级结构同源性高达90%,空间结构高度一致且BHb容易获得,因而常作为模型蛋白。当CA进入体内后通过血液运输至靶器官的过程中,会对BHb的空间构象和生物学功能产生一定影响。目前相关研究主要以牛血清白蛋白为主[10-11],且由于CA的水溶解性较差[12-13],在行业应用中常需添加不同浓度的乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)等助溶剂。因此,本试验通过紫外光谱、荧光光谱、同步荧光光谱、红外光谱及对DPPH自由基和ABTS+自由基能力的测定,研究CA和BHb在3种不同溶剂体系中的相互作用和抗氧化性,为明确CA在体内运输及对BHb空间构象的影响等提供参考。
1 材料与方法
1.1 材料与试剂
牛血红蛋白(分析纯):美国Worthingtong Biochemical Corporation;ABTS试剂(色谱纯):索莱宝生物科技有限公司;咖啡酸、DMSO、乙醇(均为分析纯):生工生物工程(上海)股份有限公司;DPPH(分析纯):日本东京化成工业株式会社。
1.2 仪器与设备
RF5301荧光光谱仪、UV-1800紫外可见分光光度计:岛津(中国)有限公司;Nicolet iS5红外光谱仪:美国赛默飞世尔科技公司;PHS-3D型pH计:上海仪电科学仪器股份有限公司;ME204电子天平:梅特勒托利多科技(中国)有限公司。
1.3 试验方法
1.3.1 紫外光谱测定
用dH2O将BHb配制成1.5×10-3mol/L储备液,用DMSO将CA配制成1.5×10-3mol/L储备液。反应体系中固定BHb浓度为1.0×10-5mol/L,分别用dH2O、10% DMSO和10%乙醇稀释,使CA终浓度分别为0、3×10-5、6×10-5、9×10-5、12×10-5mol/L。在 250 nm~500 nm 扫描紫外光谱[14]。
1.3.2 荧光光谱和同步荧光光谱测定
反应体系中固定BHb浓度为1.0×10-5mol/L,分别用dH2O、10% DMSO和10%乙醇稀释,使CA终浓度分别为 0、3×10-5、6×10-5、9×10-5、12×10-5mol/L。上述体系在 298、304、310 K,激发波长 280 nm,300 nm~500 nm进行荧光光谱扫描[15]。固定Δλ=15 nm、Δλ=60 nm扫描同步荧光光谱[16]。
1.3.3 红外光谱测定
固定CA终浓度为1.5×10-4mol/L,BHb终浓度为1.5×10-4mol/L。在 4 000 cm-1~400 cm-1范围内,分辨率为4 cm-1下扫描红外光谱[17]。
1.3.4 抗氧化性测定
DPPH自由基清除率参考封易成等[18]的方法,CA和BHb终浓度分别为1.5×10-2mol/L和1.5×10-5mol/L。ABTS+自由基清除率参考Peng等[19]的方法,CA和BHb终浓度分别为1.5×10-2mol/L和1.5×10-3mol/L。固定CA浓度为1.5×10-2mol/L,添加BHb使其终浓度分别为0、0.1×10-5、0.2×10-5、0.4×10-5、0.8×10-5、1.6×10-5mol/L,分析CA对DPPH自由基清除率的影响;固定CA浓度为1.5×10-2mol/L,添加BHb使其终浓度分别为0、0.1×10-3、0.2×10-3、0.4×10-3、0.8×10-3、1.6×10-3mol/L,分析CA对ABTS+自由基清除率的影响。
1.4 荧光猝灭类型、结合常数和结合位点数
CA对BHb的猝灭遵循Stern-Volmer方程[20]。
式中:F0和F分别为CA与BHb作用前后的荧光强度;Q为CA浓度,mol/L;τ0为CA不存在时BHb的寿命,10-8s;Kq为猝灭常数,L/mol;Ksv为 Stern-Volmer常数,L/(mol·s)。
假设BHb有n个结合位点可与CA相互作用,则在静态猝灭中药物对BSA的猝灭变化遵循公式如下。
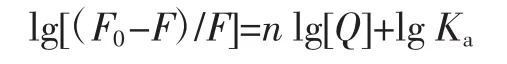
式中:Ka为结合常数,mol/L;Q 为 CA 浓度,mol/L;n为结合位点数。
1.5 CA与BHb的结合距离
BHb荧光光谱与CA紫外光谱有一定重叠,依据Forster非辐射能量转移理论,可求出CA与BHb中Trp残基的结合距离。能量转移效率与结合距离的关系计算公式如下。
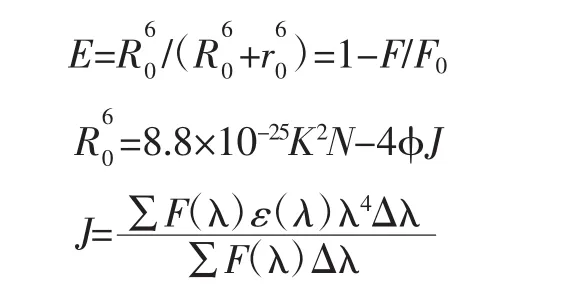
式中:R0为能量转移效率E达50%时的距离;r0为CA与BHb的距离;F0和F分别为未加CA时的荧光强度和CA与BHb摩尔比为1∶1时的荧光强度;K2为取向因子,2/3;N为介质折射指数,1.336;φ为BHb的量子产率,0.062;J为CA紫外吸收光谱和BHb荧光发射光谱的重叠积分面积,cm3·L/mol;F(λ)为 BHb 在波长λ处的荧光强度;ε(λ)为CA在波长λ处摩尔消光系数,L/(mol·cm)。
1.6 热力学和相互作用力
当温度变化较小时,ΔH视为常数,CA与BHb相互作用满足Van't Hoff方程。
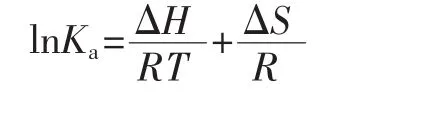
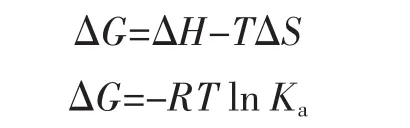
式中:△S 为熵变,J/mol·K;△H 为焓变,kJ/mol;△G为自由能变化,kJ/mol;R为摩尔气体常数,8.314 5 J/(mol·K);T为热力学温度;Ka为相应温度下的结合常数,L/mol。
1.7 数据分析
采用SPSS16.0进行最小显著性差异法统计分析,P<0.05为显著差异。利用Origin7.5作图。
2 结果与分析
2.1 紫外光谱
在3种不同溶剂体系中,CA-BHb紫外光谱图见图1。

图1 CA-BHb紫外光谱Fig.1 Ultraviolet spectrum of CA-BHb
由图1可知,当CA浓度小于6×10-5mol/L时,在280 nm和405 nm附近可观察到2个吸收峰,280 nm吸收峰代表芳香族氨基酸的吸收,405 nm强吸收峰是血红素卟啉环π-π*跃迁所形成的Soret带。Soret带几乎未发生位移,仅强度略有不规律变化,这表明CA对BHb的血红素辅基几乎不产生影响[21]。3种溶剂体系几乎均在350 nm附近形成等吸收点,这表明CA与BHb可形成具有确定计量比的配合物,游离BHb与CA-BHb达到平衡。当CA浓度大于6×10-5mol/L时,在312 nm附近开始出现新吸收峰,这表明较高浓度的CA可对BHb的空间构象产生影响[22]。
随着CA浓度的增加,一方面BHb在280 nm吸收增强,原因是CA使BHb分子中Tyr、Trp等生色基团暴露以及CA的紫外吸收,另一方面BHb发生红移,原因是CA使BHb分子π-π*跃迁所需能量减少[23]。另外,由于静态猝灭会改变BHb吸收强度,而动态猝灭则不影响BHb吸收强度[24],据此可初步认为CA对BHb的荧光猝灭为静态猝灭。
2.2 荧光光谱
CA-BHb的荧光光谱图见图2。
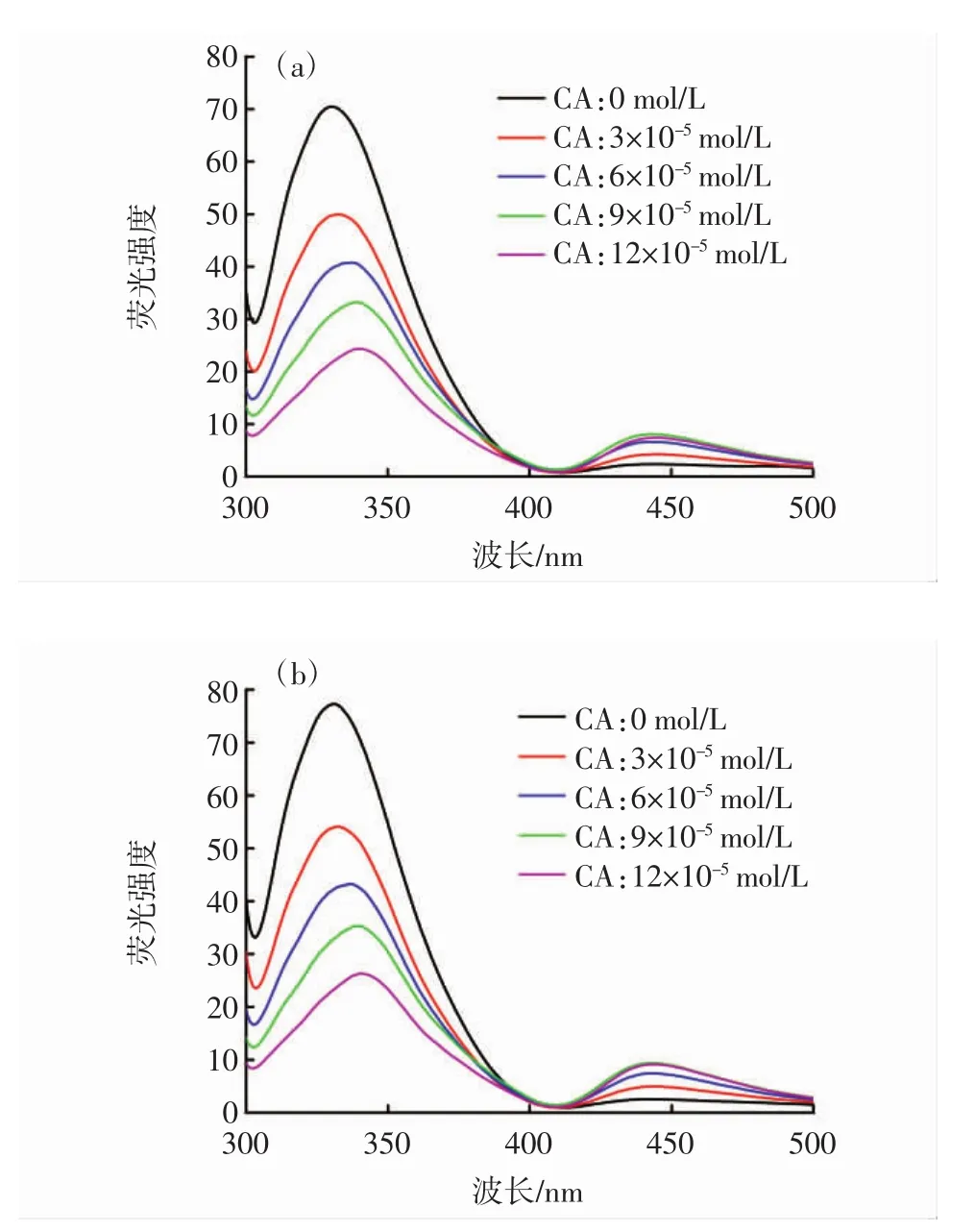

图2 CA-BHb荧光光谱Fig.2 Fluorescence spectrum of CA-BHb
由图2可知,当激发波长为280 nm时,Phe荧光信号通常较弱且以共振能形式将能量转移至Trp残基上,理论上Tyr荧光峰应在304 nm附近,但3种溶剂体系均未在304 nm附近出现荧光峰,这表明BHb分子发生了从Tyr残基到Trp残基的能量转移。在3种溶剂体系中,随着CA浓度的增加,BHb在330 nm处荧光强度呈规律性下降,且荧光峰逐渐从330 nm红移至340 nm附近,这表明CA与BHb的相互作用可使BHb二级结构发生改变,Trp残基所处微环境的亲水性增加[25]。另外,在3种不同溶剂体系中,BHb在410、410、385 nm附近形成等发射点,再次表明CA对BHb的作用可能为静态猝灭[26]。
2.3 荧光猝灭类型、结合常数和结合位点数
不同温度和溶剂条件下的计算结果见表1。
由表1可知,在3种不同溶剂体系中,Kq随温度升高而降低且均大于最大动态扩散猝灭常数2.0×1010L/(mol·s),因此CA对BHb的猝灭类型以静态猝灭为主[27]。经过计算得出,在dH2O、10% DMSO和10%乙醇溶剂中,平均结合位点数(n)分别为1.44、1.28和1.27,说明CA与BHb约有1个结合位点。一般认为,结合常数数量级在104~106范围内时相互作用力较强,3种不同溶剂体系中Ka为107数量级,这表明CA与BHb相互作用较强,CA在体内可被BHb转运。
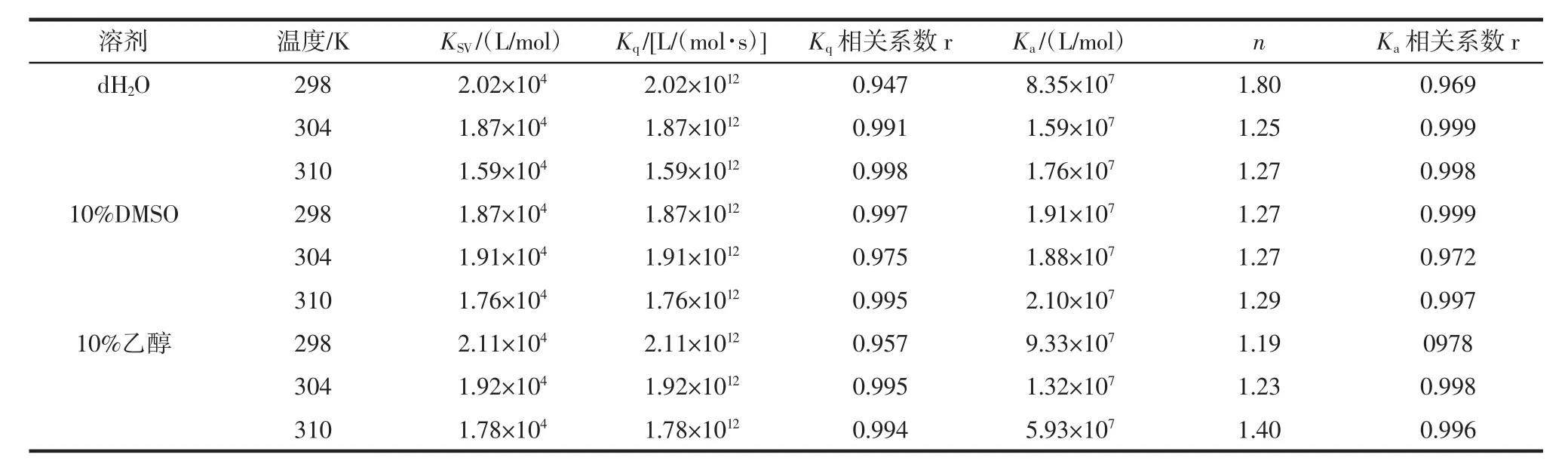
表1 不同溶剂中CA-BHb的猝灭常数、结合常数和结合位点数Table 1 Ksv,Kaand n of CA-BHb in different solvents
2.4 CA与BHb的结合距离
由计算可得,在3种溶剂体系中,CA与BHb的距离r0分别为1.748、1.697 nm和1.781 nm,均小于7 nm,表明BHA与CA间发生非辐射能量转移使BHb荧光猝灭,且猝灭方式为静态猝灭。
2.5 热力学和相互作用力
热力学参数计算结果见表2。

表2 不同溶剂体系中CA-BHb的热力学参数Table 2 Thermodynamic parameters in different solvents
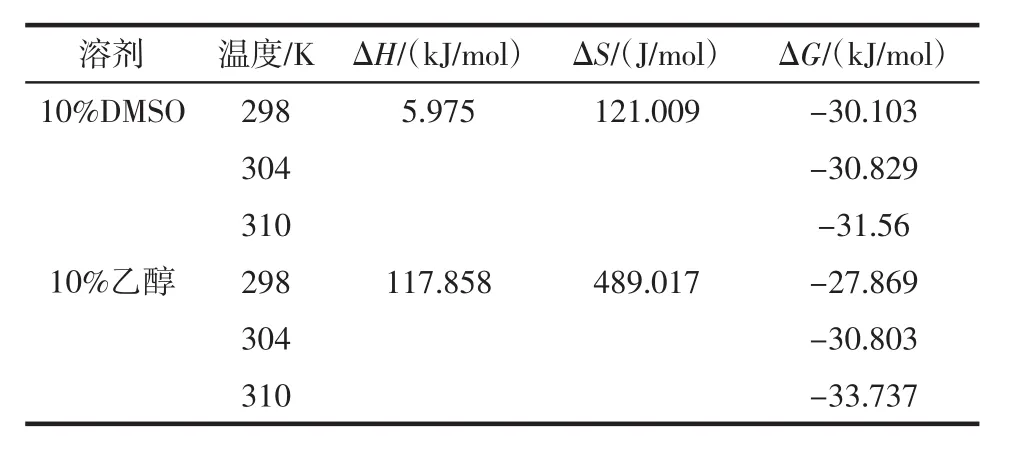
续表2 不同溶剂体系中CA-BHb的热力学参数Continue table 2 Thermodynamic parameters in different solvents
根据Ross理论,CA和BHb之间的作用力主要有疏水作用力(△H>0,△S>0)、氢键或范德华力(△H<0,△S<0)及静电引力。由表2可知,CA与BHb在3种不同的溶剂中,相互作用能够自发进行且作用力为疏水作用力。
2.6 同步荧光光谱
BHb分子中Trp、Tyr和Phe残基的荧光峰在一定条件下可发生重叠现象,选择合适的波长差可将重叠荧光峰分开。△λ=15 nm和△λ=60 nm分别代表Tyr和Trp残基的荧光光谱[30]。3种不同溶剂体系中△λ=15 nm和△λ=60 nm的同步荧光光谱见图3~图5。
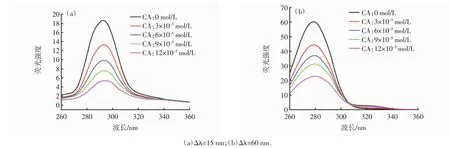
图3 dH2O中CA-BHb同步荧光光谱Fig.3 Synchronous fluorescence spectrum of CA-BHb in dH2O
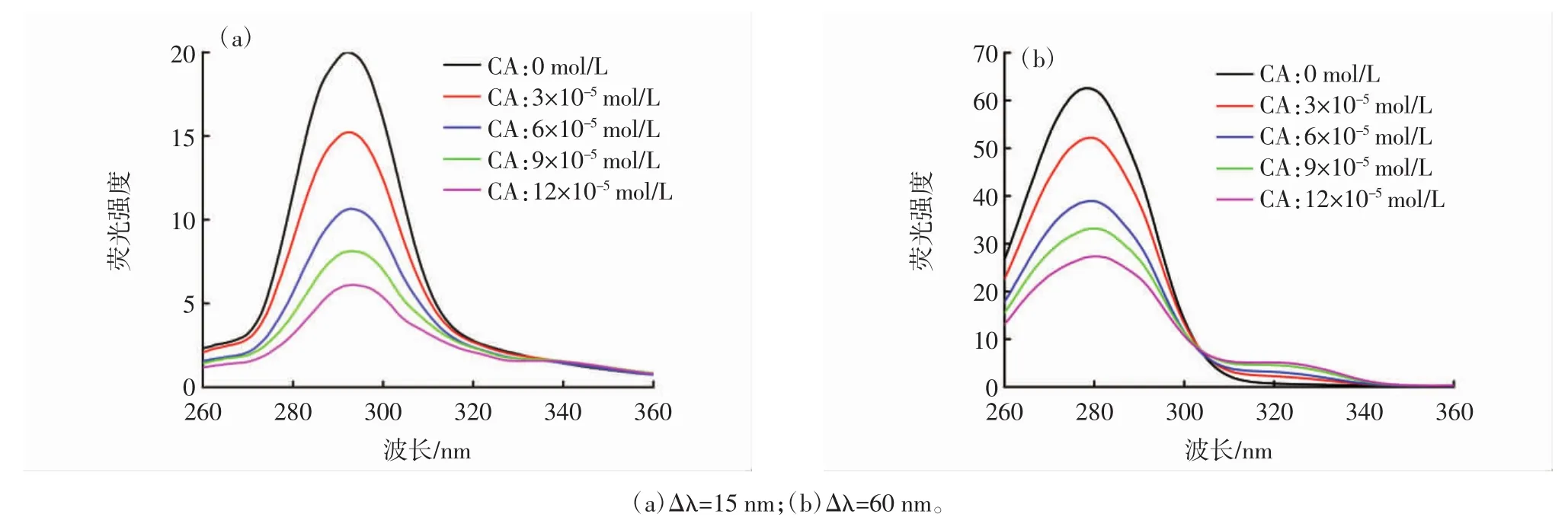
图4 10%乙醇中CA-BHb同步荧光光谱Fig.4 Synchronous fluorescence spectrum of CA-BHb in 10% ethanol
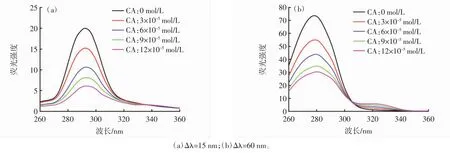
图5 10% DMSO中CA-BHb同步荧光光谱Fig.5 Synchronous fluorescence spectrum of CA-BHb in 10% DMSO
280 nm处的荧光峰归属于BHb四聚体中的Trp残基,325 nm处的荧光峰归属于BHb二聚体中的Trp残基[31-32]。由图 3(a)、图 4(a)和图 5(a)可知,随着 CA浓度的增加,Tyr残基的荧光强度逐渐降低且轻微红移,这表明Tyr残基所处微环境的亲水性略有增强;由图 3(b)、图 4(b)和图 5(b)可知,随 CA 浓度增加,Trp残基的荧光强度逐渐降低且荧光猝灭程度大于Tyr。这表明CA与Trp残基的相互作用强于Tyr残基,其结合位点更接近于Trp残基而非Tyr残基。
2.7 红外光谱
CA-BHb红外光谱见图6。

图6 CA对BHb红外光谱的影响Fig.6 The effects of CA on infrared spectrum of BHb
1600 cm-1~1700 cm-1为酰胺I带特征区,主要归属为C=O的伸缩振动,1 500 cm-1~1 600 cm-1为酰胺II带特征区,主要归属为C-N的伸缩振动和N-H面内变形振动[33]。在3种不同溶剂体系中,CA均增强BHb的红外吸收,这是由于CA酚羟基与BHb分子中C=O或C-N形成氢键,引起BHb多肽链上氢键的重排,最终导致其二级结构发生变化[34]。
1640cm-1~1610cm-1为 β-折叠,1650cm-1~1640cm-1为无规则卷曲,1 660 cm-1~1 650 cm-1为 α-螺旋[35]。由图6(a)可知,在dH2O溶剂体系中,CA可使BHb的酰胺I带从1 659.446 cm-1微弱红移至1 656.071 cm-1,这表明BHb以 α-螺旋为主[36]。由图6(b)可知,在 10%乙醇溶剂体系中,CA可使BHb的酰胺I带在1 628.108 cm-1附近出现肩峰,这表明部分BHb已由α螺旋转化为β折叠。由图6(c)可知,在10% DMSO溶剂体系,CA可使BHb的酰胺I带从1657.035cm-1红移至1627.144cm-1,表明BHb已大部分由α螺旋转化为β折叠。图6(c)中原1 657.035 cm-1处的红外吸收峰几乎完全消失,原因是DMSO中的S=O具有较强的氢键形成活性,会竞争性破坏BHb分子中维持α-螺旋稳定的氢键,从而使α-螺旋特征性吸收峰消失[37]。由于α-螺旋反映的是BHb分子的致密性,β-折叠等反映了BHb分子的松散性,故与dH2O体系相比较,10%乙醇和10% DMSO两种体系使BHb空间结构更加伸展。
由图6(a)可知,酰胺II带位置未发生位移,由图6(b)和图 6(c)可知,酰胺 II带分别从 1 543.738 cm-1红移至 1 526.864 cm-1,从 1 536.506 cm-1红移至1 517.221 cm-1,BHb空间结构的有序性有所降低[38]。分析认为,有机溶剂的介电常数较低,因而增强了分子间的静电引力,而CA与BHb分子间的氢键作用,从本质上讲也是一种静电引力。上述结果表明,在3种不同溶剂体系下,CA与BHb的相互作用对BHb的二级结构影响不同,即低极性溶剂体系易使BHb分子的酰胺I带和酰胺II带发生红移,甚至完全消失。
2.8 CA对DPPH自由基和ABTS+自由基的抗氧化性
CA对DPPH自由基和ABTS+自由基的清除率见图7。
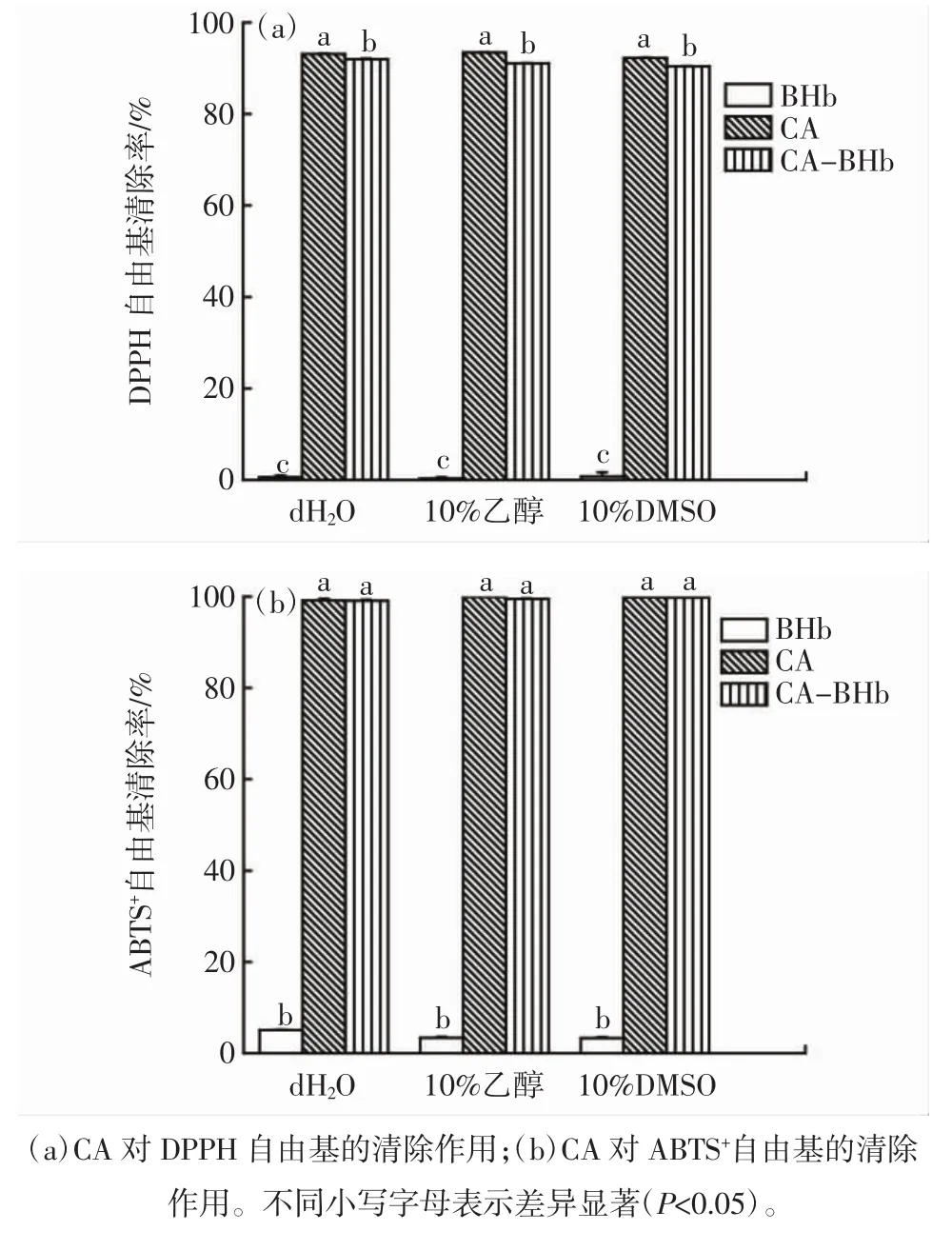
图7 不同溶剂体系下CA对DPPH和ABTS+自由基的清除作用Fig.7 DPPH and ABTS+scavenging activity of CA in different solvents
由图7可知,当加入BHb后,CA对DPPH自由基清除率均显著降低(P<0.05),对ABTS+自由基清除率无显著影响(P>0.05),这表明BHb对CA抗氧化性的影响与所采用的抗氧化体系有关[39]。由于CA抗氧化性取决于其分子中的酚羟基,故可初步认为DPPH自由基促进BHb与CA分子间氢键的形成,从而降低CA抗氧化性,而ABTS+自由基则不影响BHb与CA分子间氢键的形成,因而对CA抗氧化性影响不明显。
为进一步了解CA对DPPH和ABTS+自由基的清除作用是否对BHb浓度具有依赖性,以dH2O为代表,分别在 0~1.6×10-5mol/L、0~1.6×10-3mol/L 范围内分析BHb对CA清除DPPH和ABTS+自由基的影响,结果见图8。

图8 dH2O体系中BHb对CA清除DPPH自由基和ABTS+自由基的影响Fig.8 DPPH radical and ABTS+radical scavenging activity of CA with different BHb concentration in dH2O
由图 8(a)可知,在 0.1×10-5mol/L~1.6×10-5mol/L内,随着BHb浓度的增加,CA对DPPH自由基清除率呈显著下降趋势(P<0.05),具有一定的浓度依赖性。由图 8(b)可知,在 0.1×10-3mol/L~0.4×10-3mol/L 内,CA对ABTS+自由基清除率呈显著增加趋势(P<0.05),在0.4×10-3mol/L~1.6×10-3mol/L 范围内,CA 对 ABTS+自由基清除率呈显著降低趋势(P<0.05),但并未呈现浓度依赖性。
3 结论
本文运用紫外光谱、荧光光谱、同步荧光光谱和红外光谱及对DPPH自由基和ABTS+自由基的清除率等方法,研究在dH2O、10%乙醇、10% DMSO溶剂体系中,CA和BHb的相互作用及其对CA抗氧化性的影响。在3种不同溶剂体系中,CA均可静态猝灭BHb内源荧光,使BHb分子Trp残基微环境的亲水性增强。CA与BHb的结合是自发的且以疏水作用力为主,约有1个结合位点且更接近Trp而非Tyr残基。在10%乙醇和10% DMSO体系中,BHb酰胺I带和酰胺II带发生明显红移,二级结构由α-螺旋逐渐向β-折叠转变。在3种不同溶剂体系中,CA-BHb显著降低了CA对DPPH自由基清除率,但对ABTS+自由基清除率无明显影响。该研究有助于从分子水平了解CA在体内的转运、代谢及对BHb空间构象和生物学功能的影响,为设计有效CA载体提供依据。
