产磷脂酶D工程菌构建及发酵条件优化
2022-06-23刘琦张海洋李雪晗刘振孙建安毛相朝
刘琦,张海洋,李雪晗,刘振,孙建安,毛相朝,2*
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术国家试点实验室/海洋药物与生物制品功能实验室,山东 青岛 266003)
磷脂(phospholipids,PLs)是生物体中生物膜的主要组成部分,可分为鞘磷脂、溶血磷脂和甘油磷脂[1],甘油磷脂又可根据磷酸基团极性头基的不同,分为磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)和磷脂酰甘油(phosphatidylglycerol,PG)等。迄今为止,PLs因其重要的营养和生物功能,已被广泛应用于食品、药品和化妆品等领域[2-3]。
磷脂酶D(phospholipase D,PLD)是一类可以水解甘油磷脂的酶的总称。这一类酶既可以催化PC水解为磷脂酸(phosphatidic acid,PA),也可以催化PC转磷脂酰反应得到新型磷脂[4]。PLD催化的磷脂酰基交换反应,可以将自然界中含量十分丰富的卵磷脂催化合成具有多功能性且纯度高的稀有磷脂。PLD广泛存在于微生物、哺乳动物和植物中[5],与动植物来源的PLD相比,微生物来源的PLD催化性能高、纯化工艺简单、稳定性强。目前已有大量微生物能够异源表达PLD,如链霉菌、蜡样芽胞杆菌、大肠杆菌等[6-7]。其中,大肠杆菌仍然是磷脂酶异源表达的主要宿主,在所有宿主中约为86%[8]。
枯草芽孢杆菌是一种重要的原核表达宿主,其培养简单快速,具有非致病性,被美国食品和药品管理局认定为安全菌株[9]。除此之外,它还具有一套完整高效的异源蛋白分泌表达体系,已被广泛应用于工业生产各种酶制剂。本课题组前期研究获得了DNA改组后的重组酶PLDR34[10],与亲本酶相比,重组酶PLDR43的反应速度和反应效率均有大幅度提升,并通过Zhang等[11]的方法,利用PLDR43构建重组枯草芽孢杆菌。在此基础上,本研究通过在转录水平比较不同启动子的效果进行工程菌改造,然后对工程菌的发酵条件进行优化,并对表达的PLD进行转磷脂酰活性检测,为PLD的工业化生产和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α 感受态细胞:北京天根生化科技公司;pMA5质粒、枯草芽孢杆菌WB800:中国海洋大学海洋食品酶学与生化工程实验室保藏。
1.1.2 试验试剂
核酸染料Redsafe:韩国iNtRON公司;蛋白胨、酵母粉、琼脂粉:英国Oxiod公司;硫酸卡那霉素、Taq酶mix试剂盒:上海生工生物工程有限公司;快速质粒小提试剂盒:天根生化科技有限公司;磷酸二氢钾、甘油、磷酸氢二钾、氯化钠、硫酸铵(均为分析纯):国药集团化学试剂有限公司;胆碱氧化酶(50 U)、过氧化物酶(100 U):美国Sigma-Aldrich公司。
1.1.3 培养基
Terrifie-Broth(TB)液体培养基:蛋白胨 12 g/L、酵母粉 24 g/L、甘油 4 mL/L、K2HPO40.72 mol/L、KH2PO40.17 mol/L,115℃灭菌30 min后备用。
Luria-Bertani(LB)液体培养基:蛋白胨10 g/L、氯化钠10 g/L、酵母提取物5 g/L,高压灭菌条件相同。
LB固体培养基:在LB液体培养基的基础上,加入质量分数为1.5%~2.0%琼脂粉,高压灭菌条件相同。
1.1.4 仪器与设备
GI80TW型立式自动压力蒸汽灭菌锅:厦门致微仪器有限公司;HH-3A型水浴锅:常州智博瑞仪器制造有限公司;TGL16型离心机:长沙英泰仪器有限公司;WD-9405B型水平摇床、DYY-6C型电泳仪:北京市六一仪器厂;MULTISKAN FC型酶标仪:赛默飞世尔科技公司;Mastercycler nexus型聚合酶链式反应仪:德国艾本德股份公司;SPX型生化培养箱:新江南仪器有限公司;LC-20AT型高效液相色谱仪、ELSD-16型蒸发光散射探测器:日本岛津公司;F6/10型手持式高速匀浆机:上海净信实业发展有限公司。
1.2 方法
1.2.1 重组质粒的构建与表达
以pMA5为模板,扩增质粒骨架,再利用SnapGene软件进行质粒构建,设计引物,分别扩增含有启动子PHpaII、Pylb(F4)[12]、P2069m[13]、P43的 sfGFP-PLDR34目的基因。将基因片段和质粒骨架的聚合酶链式反应(polymerase chain reaction,PCR)产物用无缝拼接试剂盒进行连接,转化到大肠杆菌DH5α感受态细胞中并测序。然后将构建成功的质粒,通过Spizizen化学转化法转入枯草芽孢杆菌中表达。
把构建好的4种工程菌(pMA5-PHpaII-sfGFP-PLDR34、pMA5-Pylb(F4)-sfGFP-PLDR34、pMA5-P2069m-sfGFP-PLDR34、pMA5-P43-sfGFP-PLDR34)在 50 mL LB 摇瓶发酵,12 h后测定酶活和菌浓度,选择酶活最高的菌株进行发酵条件优化。
1.2.2 酶活及菌体浓度测定
取卵磷脂0.1 g,加入1 mL乙醚配制成100 mg/mL的溶液,加入9mL超纯水,在匀浆机作用下形成乳浊液。取100 μL乳浊液置于1.5 mL离心管中,加入0.1 mol/L柠檬酸钠缓冲液(pH 6.0)10 μL、0.1 mol/L 氯化钙溶液5 μL、15 μL 7.5% Triton X-100 和粗酶液 100 μL。立即置于37℃水浴中反应20 min。加入含50 mmoL乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的0.1 mol/L Tris-HCl缓冲液(pH 8.0)20 μL,置沸水浴中5min终止反应,冷却至室温25℃。加入1.0 mol/L Tris-HCl缓冲液(pH 8.0)200 μL(其中含有 100 U/mL 胆碱氧化酶、200U/mL过氧化酶、4-氨基安替比林200mg/mL、苯酚 50 mg/mL、Triton X-100 2 g/mL),置于 37℃水浴中3h。反应后的混合液于12000r/min条件下离心2min,取上清于500 nm处测定吸光度[14]。
PLD酶活定义为在25℃、pH7.4条件下,以PC为底物,每分钟水解释放1 μmol胆碱所需要的酶量为一个酶活单位(U)。
菌体浓度的测定方法为取发酵液200 μL稀释到合适的倍数后置于96孔细胞培养板中,在波长600 nm处测定吸光度,记为OD600。
1.2.3 活化培养
取甘油管保存的重组枯草芽孢杆菌(WB800/pMA5-sfGFP-PLDR34),在含有卡那霉素的LB固体培养基上划线,在37℃培养12 h进行菌株活化后,挑LB固体培养基上的单一菌落于50 mL含有卡那霉素的LB液体培养基中,37℃、200 r/min摇瓶培养12 h后即为种子液。
1.2.4 单因素试验
通过前期研究,选择碳源(无甘油的TB培养基为对照、葡萄糖、柠檬酸、乳糖、蔗糖、麦芽糖、甘露醇、山梨醇、甘油)、氮源[无蛋白胨和酵母粉的TB培养基为对照、硫酸铵、酵母粉+硫酸铵(质量比2∶1)、硝酸铵、酵母粉、牛肉膏+硫酸铵(质量比2∶1)、玉米浆干粉、豆粕粉、蛋白胨]、发酵时间(12、24、36、48 h)、发酵温度(25、30、35、37、40 ℃)、接种量(1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL/dL)作为影响枯草芽孢杆菌产PLD的主要因素。以TB培养基为基础培养基,200 r/min、37℃培养12 h,通过单因素试验选择Plackett-Burman试验的影响因素与水平。
1.2.5 Plackett-Burman试验
根据Plackett-Burman试验设计标准,每个因素取高(1)低(-1)各两个水平。综合单因素试验的结果,以酶活为响应值,从各个试验的最大响应值前后选择高低水平,设计N=12的Plackett-Burman试验。探究各因素对枯草芽孢杆菌产PLD的影响,分析试验结果中各因素的效应值、方差及贡献率,从中选择出对酶活影响最显著的3个因素进行Box-Behnken试验。
1.2.6 Box-Behnken响应面优化试验
以单因素试验中的拐点为中心点,根据Plackett-Burman试验结果,选取对酶活影响最显著的3个因素为试验因素,以PLD水解活力为响应值,设计三因素三水平的Box-Behnken响应面试验并进行数据分析,从而确定最优的试验条件,以获得产PLD最高的培养基。Box-Behnken试验设计见表1。
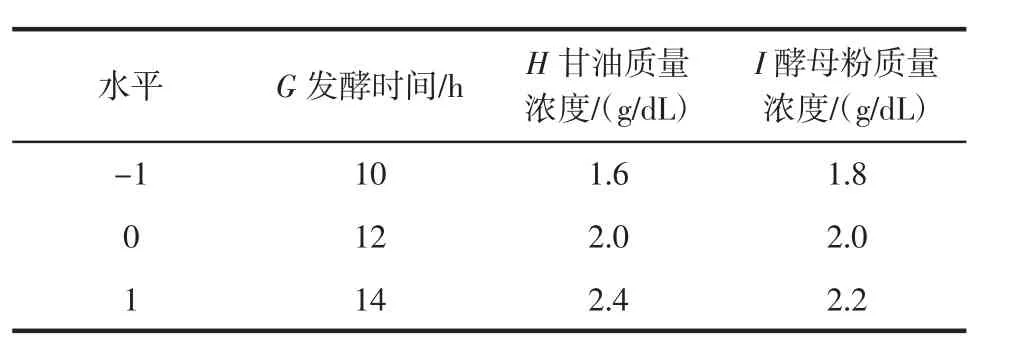
表1 Box-Behnken试验设计Table 1 Factors and levels of Box-Behnken experimental design
1.2.7 磷脂酶D的转磷脂酰反应
将pMA5-PHpaII-sfGFP-PLDR34工程菌进行500 mL LB液体培养基发酵,离心后取上清冻干3 d为酶粉。采用双相反应体系合成磷脂酰葡萄糖苷(PtdGlc)、PS、PI、PG,将 50 mmol/L CaCl2和 1 mol/L 葡萄糖、L-丝氨酸、肌醇、甘油分别溶于柠檬酸-柠檬酸钠缓冲液(20 mmol/L,pH 6.0),加0.5 U PLD 酶粉,于 40℃水浴振荡反应6 h。反应结束后取上清进行液相检测。
1.2.8 转磷脂酰反应的测定
转磷脂酰反应生成的磷脂酰化合物,以及反应体系中的PC由蒸发光散射检测器(evaporative light-scattering detector,ELSD)高效液相色谱进行检测[15]。
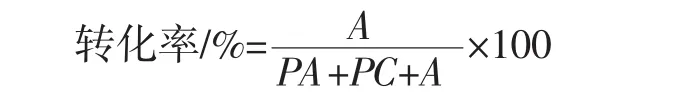
式中:A为合成磷脂酰化合物的峰面积;PA为磷脂酸峰面积;PC卵磷脂峰面积。
2 结果与分析
2.1 重组菌的构建
将构建成功且无突变的重组质粒化学转入枯草芽孢杆菌WB800中,然后接入到LB液体培养基表达,检测不同启动子对枯草芽孢杆菌产PLD的表达效果,不同启动子的工程菌OD600及PLD的水解活力如图1所示。
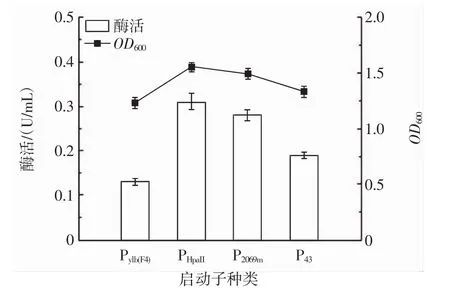
图1 4种启动子产酶活测定Fig.1 Determination of enzyme production activity of four kinds of promoters
由图 1 可知,B.subtilis来源的 PHpaII、Pylb(F4)、P43型启动子中,酶活分别为 0.35、0.13、0.19 U/mL,说明 pMA5载体本身启动子PHpaII的表达水平要远高于组成型启动子P43和Pylb(F4)。短小芽孢杆菌(B.pumilus)来源的P2069m型启动子的酶活为0.28 U/mL,略低于PHpaII型启动子。B.pumilus与B.subtilis的遗传背景相似,因此P2069m可以在B.subtilis中异源表达并且表达水平高于Pylb(F4)、P43型启动子。为了更加高效地制备PLD,选择酶活最高的工程菌WB800/pMA5-PHpaII-sfGFP-PLDR34进行发酵条件优化。
2.2 单因素试验
2.2.1 碳源对重组菌和PLD酶活的影响
碳源对微生物的生长代谢至关重要,主要为细胞提供碳架及其生命活动所需要的能源[16-17],不同微生物对碳源的利用程度都不一样,因此需要找到一种最适合重组枯草芽孢杆菌产PLD的碳源。不同种类的碳源对产PLD影响如图2所示。

图2 碳源种类对PLD酶活的影响Fig.2 Effects of carbon sources on PLD enzyme activity
由图2可知,当以甘油作为碳源时,酶活最高,并且此时菌体浓度也最高,可能是由于甘油的分子量较小,易于被菌株直接利用,直接参与多条代谢途径。因此,甘油有利于菌体生长代谢,促进枯草芽孢杆菌产PLD。
不同质量浓度甘油对枯草芽孢杆菌产PLD的影响如图3所示。
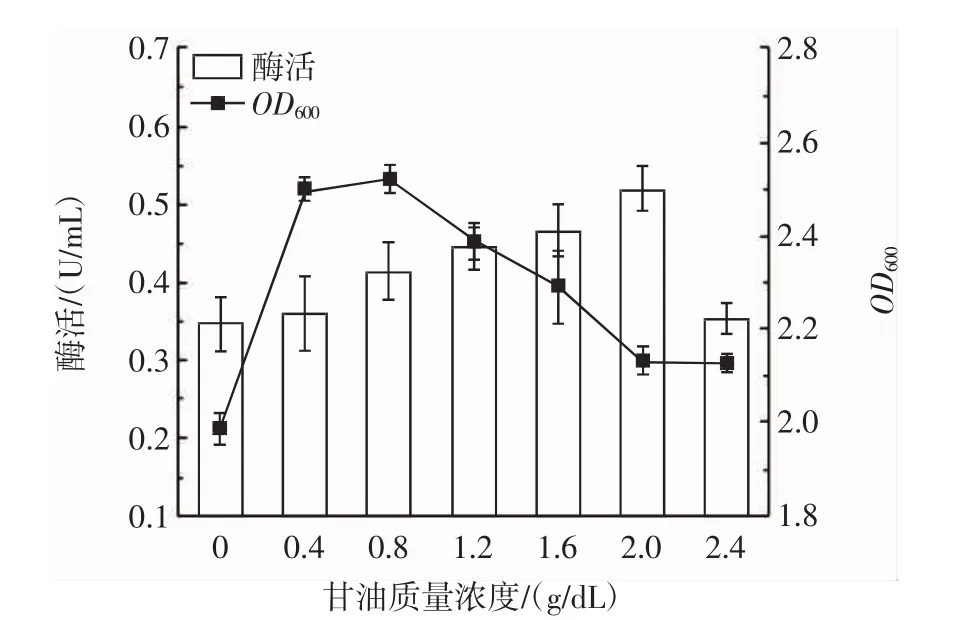
图3 甘油质量浓度对PLD酶活的影响Fig.3 Effect of glycerol concentration on PLD enzyme activity
由图3可知,在甘油质量浓度为2.0 g/dL时,酶活达到最大值。随着甘油质量浓度的增加,酶活迅速降低,分析是由于过高的甘油浓度导致发酵液的黏度增大,溶氧降低,影响到枯草芽孢杆菌的生长代谢。因此甘油质量浓度选择2.0 g/dL为最佳浓度,并且选择浓度1.6 g/dL为最低水平,2.4 g/dL为最高水平进行Plackett-Burman试验。
2.2.2 氮源对重组菌和PLD酶活的影响
氮源主要用于微生物合成氨基酸等细胞物质和含氮化合物[18]。不同种类的氮源对产PLD影响如图4所示。

图4 氮源种类对PLD酶活的影响Fig.4 Effects of nitrogen sources on PLD enzyme activity
由图4可知,氮源对酶活的影响较大,当酵母粉和硫酸铵作为复合氮源时,酶活最高,并且比各自作为唯一氮源的酶活和菌体浓度高。可能是由于酵母粉为枯草芽孢杆菌提供一定的有机氮源、微量元素、维生素及氨基酸等。在硫酸铵和酵母粉的共同作用下能够更好促进枯草芽孢杆菌的生长,因此选择酵母粉和硫酸铵作为最佳氮源,进行最优质量浓度的研究。
不同酵母粉和硫酸铵的质量浓度对枯草芽孢杆菌产PLD的影响,结果如图5和图6所示。
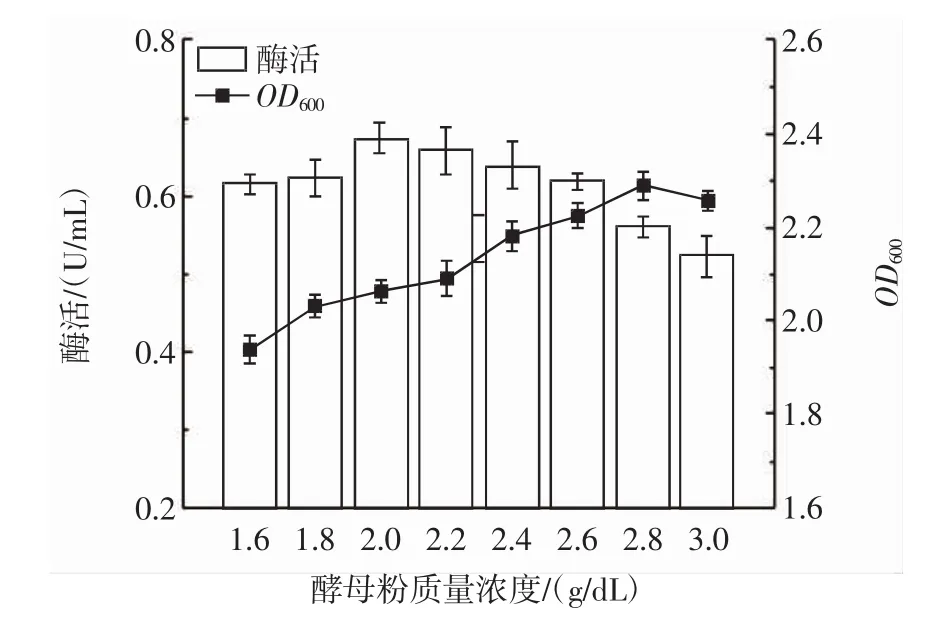
图5 酵母粉质量浓度对PLD酶活的影响Fig.5 Effect of yeast powder concentration on PLD enzyme activity

图6 硫酸铵质量浓度对PLD酶活的影响Fig.6 Effect of mass concentration of ammonium sulfate on PLD enzyme activity
由图5、图6可知,当酵母粉质量浓度为2.0 g/dL、硫酸铵质量浓度为0.8 g/dL时,酶活最高。因此将硫酸铵的质量浓度为0.7 g/dL、酵母粉质量浓度为1.8 g/dL作为最低水平,硫酸铵的质量浓度为0.9 g/dL、酵母粉质量浓度为2.2 g/dL作为最高水平进行Plackett-Burman试验。
2.2.3 发酵温度对重组菌和PLD酶活的影响
氧气在培养基中的溶解度和传播速率受到温度的影响,进而影响菌体生长和产酶的合成。随着温度的逐渐升高,酶促反应速率增大,细胞代谢增强,但是温度进一步升高后,会导致细胞内的活性物质(如蛋白质,核酸等)发生变性,细胞受到影响甚至死亡。发酵温度对产PLD菌株的影响如图7所示。
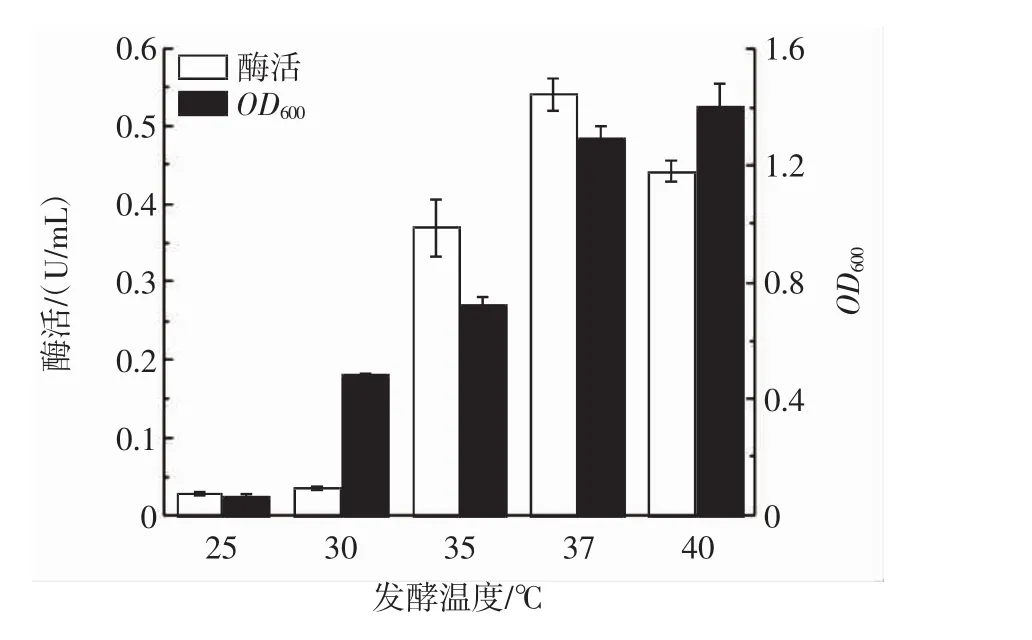
图7 发酵温度对PLD酶活的影响Fig.7 Effect of fermentation temperature on PLD enzyme activity
由图7可知,当发酵温度在25℃~30℃时,酶活维持在较低水平,当温度达到35℃以后酶活迅速增加,最终在37℃达到最大值。37℃以后,酶活开始下降,因此选择37℃为最佳发酵温度,并且选择35℃为发酵温度最低水平,39℃为最高水平进行Plackett-Burman试验。
2.2.4 发酵时间对重组菌和PLD酶活的影响
发酵时间对枯草芽孢杆菌的生长和产PLD都有很大影响,发酵时间过短,菌体生长不充分从而导致产酶量降低;发酵时间过长导致发酵副产物增多。发酵时间对枯草芽孢杆菌的影响如图8所示。
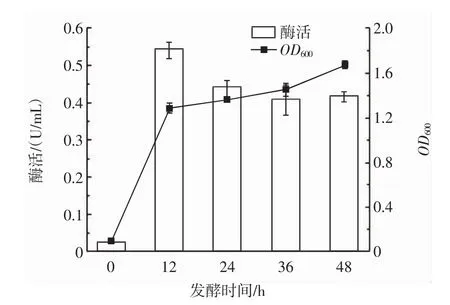
图8 发酵时间对PLD酶活的影响Fig.8 Effect of fermentation time on PLD enzyme activity
由图8可知,在0~12 h,酶活迅速增加,12 h后,酶活缓慢降低,最终酶活在12 h达到最大值。因此选择12 h为最佳发酵时间,并且作为Plackett-Burman试验的中心点,并且选择10 h为发酵时间最低水平,14 h为发酵时间最高水平进行Plackett-Burman试验。
2.2.5 接种量对重组菌和PLD酶活的影响
接种量能够影响发酵过程中枯草芽孢杆菌的生长繁殖速度,但是较大的接种量会导致发酵过程中菌株繁殖过多,溶氧不足,产PLD的速度变慢。接种量对产PLD菌株的影响如图9所示。
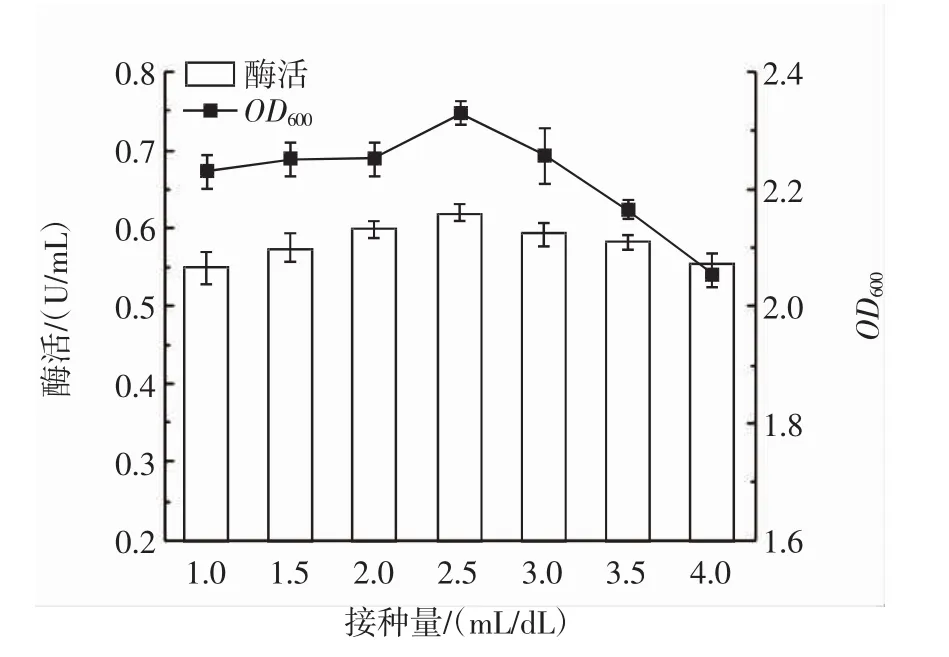
图9 接种量对PLD酶活的影响Fig.9 Effect of inoculation amount on PLD enzyme activity
由图9可知,接种量对酶活影响不明显,接种量在1.0 mL/dL~2.5 mL/dL时,酶活缓慢提升,当接种量大于2.5 mL/dL时,酶活和菌体浓度缓慢降低。根据酶活大小,选择2.5 mL/dL接种量为最佳接种量,并且选择2.0 mL/dL接种量最低水平,3.0 mL/dL为最高水平进行Plackett-Burman试验。
2.3 Plackett-Burman试验结果
通过单因素试验,筛选出接种量(A)、发酵温度(B)、发酵时间(C)、酵母粉质量浓度(D)、甘油质量浓度(E)、硫酸铵质量浓度(F)为枯草芽孢杆菌产PLD的最关键因素。Plackett-Burman试验设计及结果如表2所示,各因素效应分析和方差分析如表3所示。
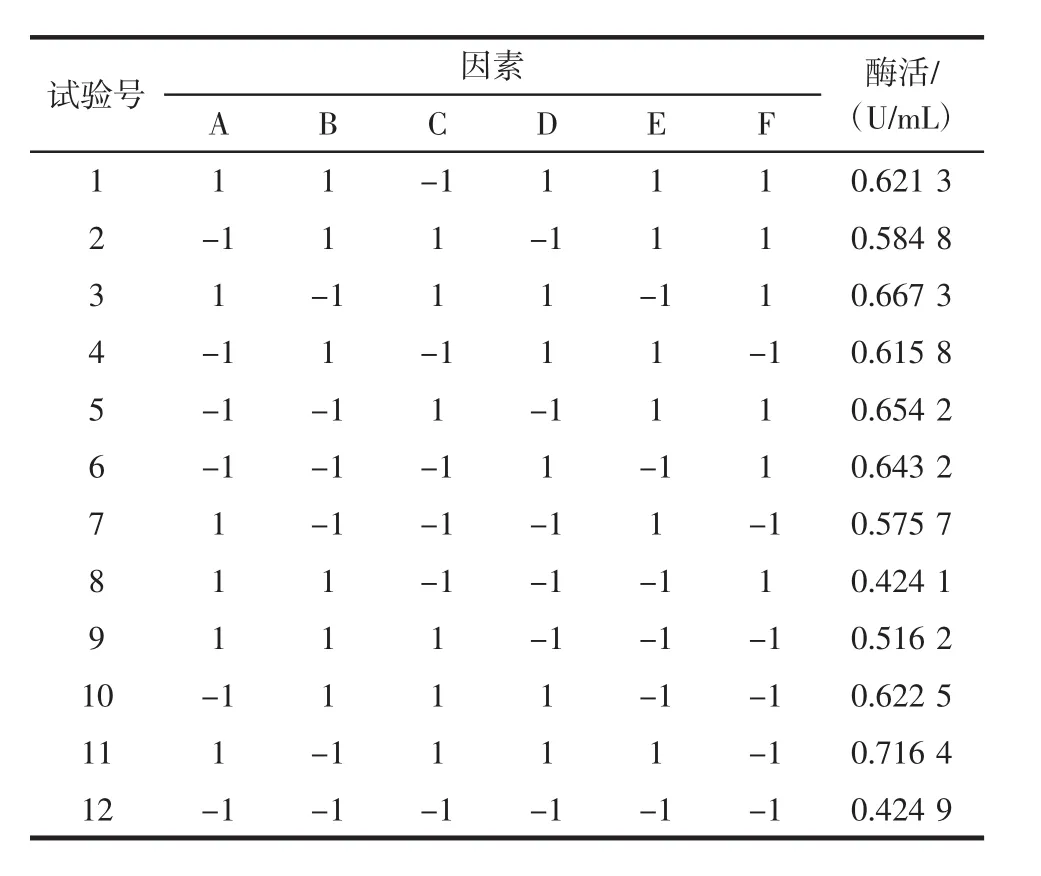
表2 Plackett-Burman试验设计及结果Table 2 Plackett-Burman design with experimental results
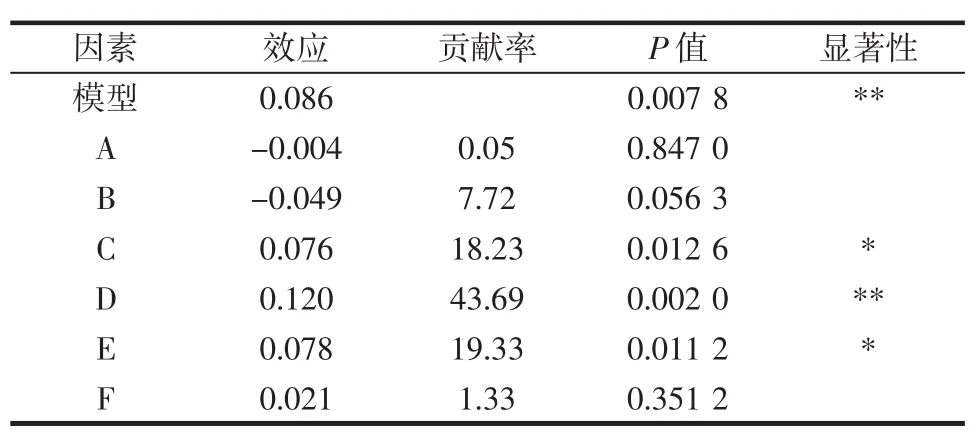
表3 Plackett-Burman试验效应分析Table 3 Effect analysis of independent variables in Plackett-Burman design
由表3可知,接种量、发酵温度的效应值为负,应该减小其梯度;酵母粉质量浓度、甘油质量浓度、硫酸铵质量浓度效应值为正,应该增加其梯度值。但是由于其梯度值过小,所以考虑成本和增加梯度值后的酶活提高幅度,决定维持现有梯度值。根据贡献率大小,可知这5个因素对模型影响的大小顺序为酵母粉质量浓度>甘油质量浓度>发酵时间>发酵温度>硫酸铵质量浓度>接种量。并且此次试验模型的P值为0.007 8达到了极显著水平,说明用此模型模拟试验的结果是可信的。其中酵母粉质量浓度对枯草芽孢杆菌产PLD的影响达到极显著水平(P<0.01),甘油质量浓度和发酵时间对枯草芽孢杆菌产PLD的影响达到显著水平(P<0.05)。故选择酵母粉质量浓度、甘油质量浓度和发酵时间3个关键因素进行Box-Behnken试验设计。其余3个因素根据单因素最优结果选取,即接种量2.5%、发酵温度为37℃、硫酸铵质量浓度为0.8 g/dL。
2.4 Box-Behnken试验结果分析
Box-Behnken试验设计及结果如表4所示,回归模型方差分析如表5所示。
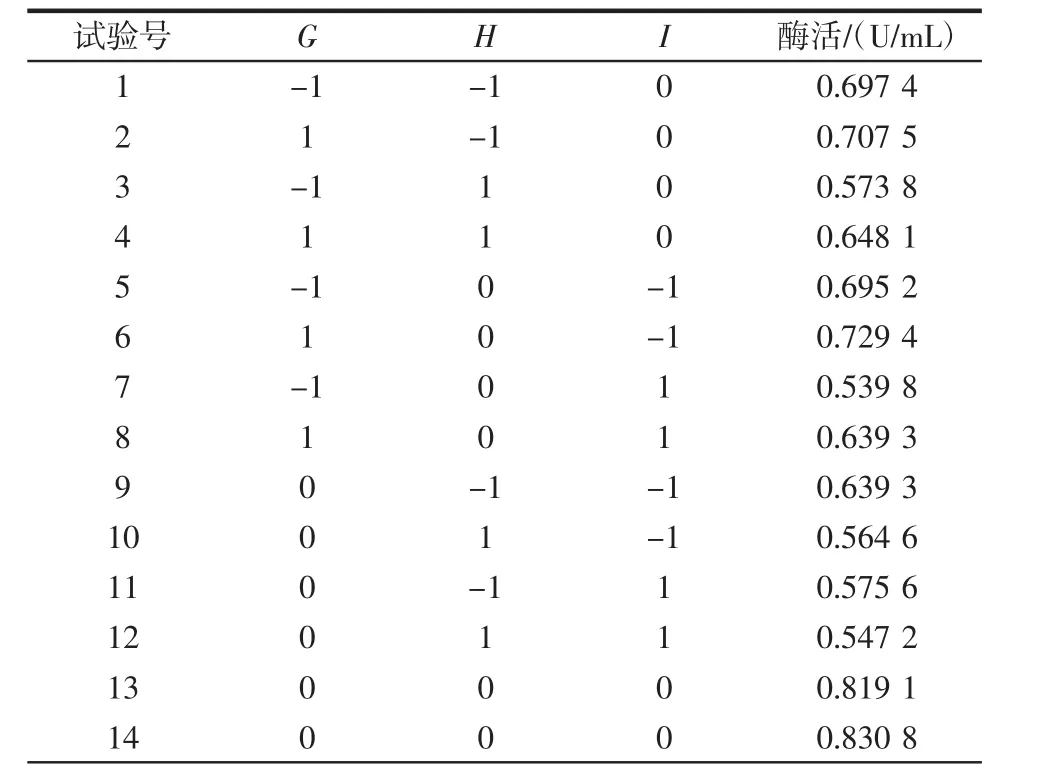
表4 Box-Behnken试验设计与结果Table 4 Box-Behnken experiment with experimental results

表5 回归模型方差分析Table 5 Analysis of variance of the regression model
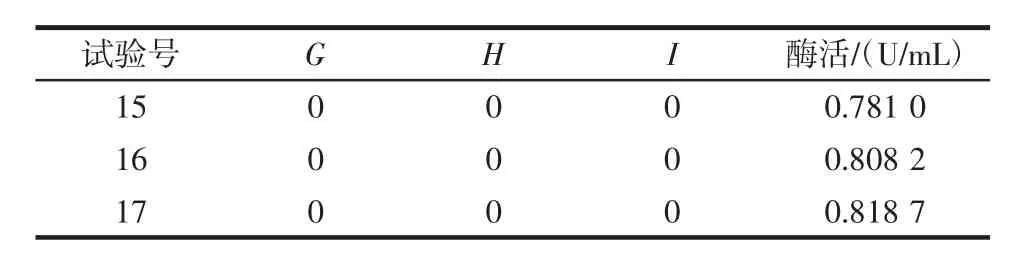
续表4 Box-Behnken试验设计与结果Continue table 4 Box-Behnken experiment with experimental results
利用Design-Expert 10.0对表4的数据进行处理,得到了酶活(Y)对发酵时间(G)、甘油质量浓度(H)、酵母粉质量浓度(I)的二元多项回归模型方程为Y=0.81+0.027G-0.036H-0.041I+0.016GH+0.016GI+0.012HI-0.044G2-0.11H2-0.12I2。由方程的F值可知,影响PLD酶活因素的主次顺序为酵母粉质量浓度>甘油质量浓度>发酵时间。由表5可知,该回归模型的P值为0.000 2,小于0.001,说明整体模型对试验结果具有极显著的影响,并且有很高的可信度;失拟项的P值为0.153 2,大于0.05,因此失拟项检验不显著,能够接近真实的响应曲面的结果,模型选择较合适。
2.5 响应面优化分析与结果验证
为了更好地探究3个因素之间的交互作用对响应值的影响,采用Design-Expert 10.0软件绘制三维响应曲面图以及相对应的等高线图。等高线图可以直观地反映两因素交互作用的程度,椭圆形和等高线的间距密集表示两因素作用显著,圆形和等高线的间距稀疏表示两因素作用不显著,各因素相互作用的等高线图和响应面图见图10。

图10 各因素相互作用的等高线图和响应面图Fig.10 Contour diagram and response surface diagram of interaction of various factors
如图10所示,(a)、(b)等高线图近似为椭圆形但其间距较为稀疏,(c)等高线图近似为圆形并且间距也稀疏。再结合方差分析中的结果GH交互的P值为0.2899,GI交互的P值为0.281 0,HI交互的P值为0.435 6均大于0.05,由此可知三因素两两交互虽有一定的规律但并不显著。结合拟合的二元多项回归方程可知,方程中的二次项系数全都是负数,可以看出该方程的抛物面开口向下,有极大值点存在。利用Design-Expert 10.0进行分析计算,得出PLD产量最高的发酵条件为发酵时间12.5 h,甘油质量浓度为1.94 g/dL,酵母粉质量浓度为1.93 g/dL,此时酶活为0.82 U/mL。在上述条件下,进行3次发酵试验,以此检验优化结果的可靠性。验证试验中,PLD的平均产量为0.85 U/mL,与预测值拟合度达96.34%,说明该优化模型可靠。并且比出发菌株的酶活(0.52 U/mL)提高62.5%。
2.6 磷脂酶D的转磷脂酰化反应及产物分析
PLD的转磷脂酰化结果见图11。
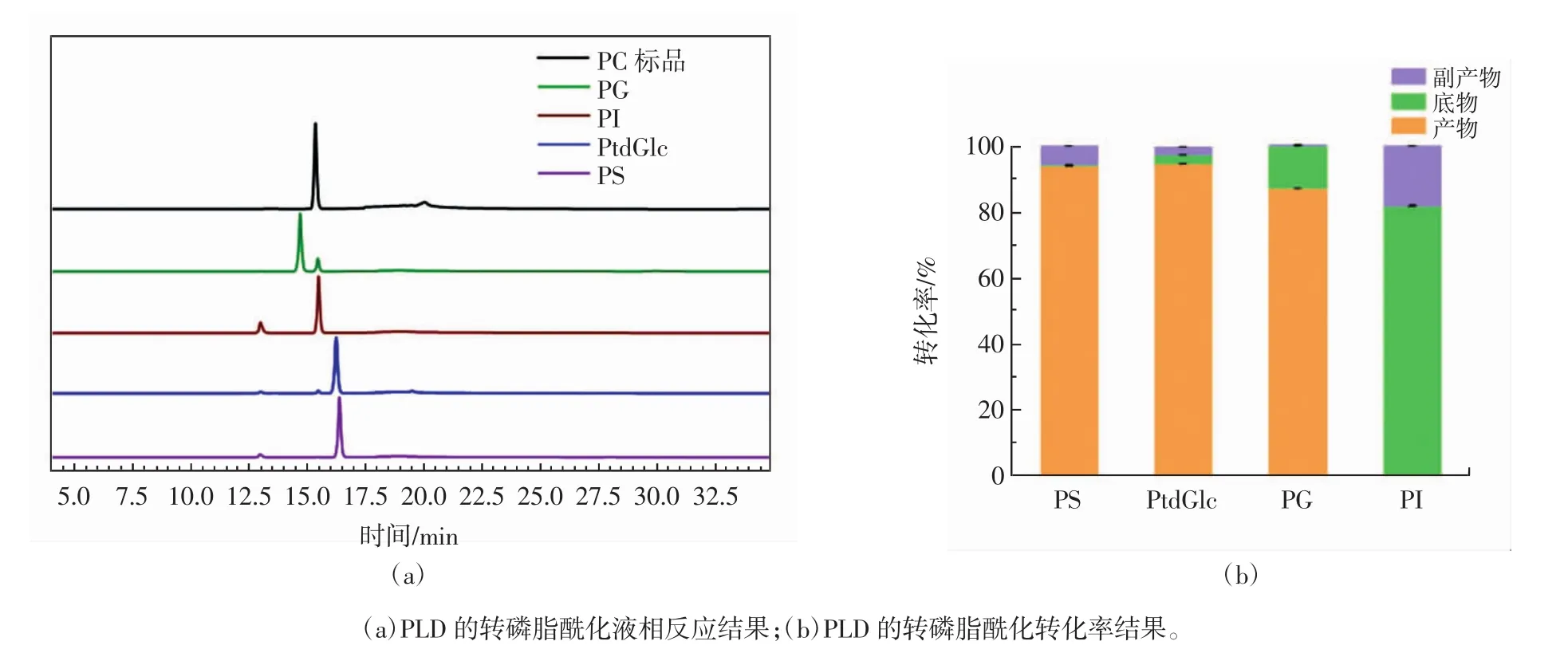
图11 PLD的转磷脂酰化结果Fig.11 Transphosphatidylation results of PLD
由图11可知,在双相反应体系中,以环戊基甲醚作为有机相时,PC几乎完全转化为PS、PtdGlc、PG,转化率分别为94.0%、94.8%、87.1%,水解副产物PA分别为5.65%、2.37%、0.13%,底物PC残留分别为0.34%、2.83%、12.94%。合成PS反应过程中,底物几乎完全反应,并且反应的水解副产物含量也较低;合成PtdGlc时,底物虽略有剩余但水解副产物更低,可能是由于丝氨酸的分子量低于葡萄糖的分子量,并且丝氨酸结构较葡萄糖也更简单,更容易进入酶的催化口袋,所以合成PS比PtdGlc底物残留更少,反应更加彻底。合成PS时水相的PLD接触有机相的PC的概率更大,当合成反应基本达到平衡时,催化其水解生成更多的PA。虽然PG的转化率不高,但是其反应的水解副产物含量很低,可能是由于甘油使水相的黏度增大,导致在摇床振荡过程中水相和有机相的接触不充分。除此之外,由于PI的肌醇分子量过大无法直接进入PLD的底物结合口袋[19-20],导致无法催化PC合成PI。能够以较高的转化率合成PS、PtdGlc、PG,说明了该条件下制备的PLD在合成小分子底物水平上有较出色的转磷脂酰化活性。
3 结论
本研究以枯草芽孢杆菌为宿主,PHpaII为启动子,表达了一个经过DNA改组后的重组酶PLDR34。分别从碳源种类和质量浓度、氮源种类和质量浓度、发酵温度、发酵时间和接种量对该菌株进行发酵条件优化。结果表明,当接种量为2.5 mL/dL、发酵温度为37℃、硫酸铵质量浓度为0.8 g/dL、发酵时间12.5 h、甘油质量浓度为1.94 g/dL,酵母粉质量浓度为1.93 g/dL,在此发酵条件下PLD酶活达到0.85 U/mL。此外,还利用双相反应体系以94.0%、94.8%和87.1%的转化率高效合成了PS、PtdGlc、PG。但是由于肌醇的分子量过大,无法进入PLD的催化口袋,导致无法合成PI。本研究以食品安全级表达菌株枯草芽孢杆菌为宿主,利用启动子工程和发酵工程策略,提升PLD的表达水平,表达的PLD有良好的转磷脂酰活力。为酶法合成新型稀有磷脂和功能性磷脂提供了一定的参考,也为PLD的应用奠定基础。
