Microbulbifer salipaludis褐藻胶裂解酶的酶学性质研究
2022-06-23张文立王鑫绣徐炜刘晓勇沐万孟
张文立,王鑫绣,徐炜,刘晓勇,沐万孟*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.山东海之宝海洋科技有限公司,山东 威海 264333)
海洋的水体环境具有高盐、高压、低温、寡营养的特点,因此赋予了海洋生物更多特殊的生理功效,是人类膳食营养和生物医药的巨大资源宝库。以海洋糖类为代表的海洋食品和生物医药产业等新型产业快速发展,为我国海洋产业的结构升级和可持续发展注入了新的动力。
褐藻有超过250个属,约1 800余种,是我国十分重要的经济藻类[1]。褐藻胶是广泛存在于各种褐藻中的一类多糖物质,由β-D-甘露糖醛酸(β-D-mannuronic acid,M)和 α-L-古罗糖醛酸(α-L-guluronic acid,G)通过1,4-糖苷键聚合而成的线性多糖[2],可以形成多聚甘露糖醛酸片段、多聚古罗糖醛酸片段和甘露糖醛酸-古罗糖醛酸混合片段。不同藻类来源的褐藻胶M与G的比值不同,其成胶性、离子结合能力、流动性等理化性质也各不相同[1]。褐藻胶水溶液黏度高,常被用作增稠剂、稳定剂、赋形剂等应用到食品行业中[3]。然而,褐藻胶分子量大,导致其水溶性差和生物利用度低,严重限制了其应用范围。褐藻寡糖,是一种聚合度在2~25的分子,由褐藻胶分解而成[4],具有调节人体免疫、抗氧化、抗肿瘤、抑菌、保护神经系统、促进植物生长等多种功能[5-6]。由于褐藻寡糖具有良好的水溶性、较强的稳定性、高生物利用度和安全无毒等特点,因此广受国内外研究学者的关注。
褐藻寡糖的生产主要包括化学分解法、物理分解法和生物酶法[7-9]。化学物理方法主要包括酸水解法、H2O2法[10]、臭氧法[11]、辐照法等,但存在耗能大、副产物复杂等问题。与化学物理法生产的寡糖片段在两个末端都具有未修饰的己糖醛酸残基不同的是,酶法能生成含有不饱和双键还原末端的寡糖,反应副产物少、耗能低、产物生物活性高,具有很高的应用价值。在褐藻寡糖的生物转化中,褐藻胶裂解酶(alginate lyase,aly)发挥着至关重要的作用。
褐藻胶裂解酶,是一种多糖裂解酶,通过β消除机制催化1,4-糖苷键发生水解,然后在断裂后新生成的C4-羟基处发生C4与C5间的脱去反应,生成非还原性末端的C4-C5双键[12]。该双键与C5-羧羰基形成共轭结构,在紫外230 nm~240 nm处有特征性的强吸收。褐藻胶裂解酶有多种分类方式,以不同底物偏好性可分为聚甘露糖醛酸(polyM)特异性酶、聚古罗糖醛酸(polyG)特异性酶和双功能酶[13];以反应方式可分为内切酶和外切酶[12];以分子量大小可分为小型(25 kDa~30 kDa)、中型(约 40 kDa)和大型裂解酶(>60 kDa)[14]。褐藻胶裂解酶用途广泛,除去降解褐藻胶生产褐藻寡糖作为食品与农业原料[15-18],在医学上还可以被加入到抗菌药物中协助对铜绿假单胞菌感染的治疗[19-20]。
微泡菌属盐田微泡菌(Microbulbifer salipaludis,Misa)的全基因组序列已经解析,并公布在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中,编号为NZ_JAEKJR-010000001。在M.salipaludis的全基因组序列中,存在一段编码褐藻胶裂解酶的假定基因,GenBank登录号为WP_207000102.1。本研究合成了M.salipaludis褐藻胶裂解酶假定基因片段,插入pET-22b(+)表达载体,并转化至Escherichia coli BL21(DE3)进行异源表达。随后进行蛋白分离纯化和酶学性质鉴定,证实重组酶属于褐藻胶裂解酶(命名为Misa-aly)。本研究为褐藻寡糖的生物转化提供了理论和技术基础。
1 材料与方法
1.1 材料与试剂
表达宿主 E.coliBL21(DE3)、克隆宿主 E.coliDH5α:生工生物工程(上海)股份有限公司;氨苄青霉素(ampicillin,Amp)、异丙基-β-d-硫代半乳糖苷(β-d-1-thiogalactopyranoside,IPTG)、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白定量试剂盒、牛血清白蛋白标准品(bovine serum albumin,BSA)、琼脂糖、4S Green Plus无毒核酸染料、海藻酸钠:大连Takara公司;SDS-PAGE凝胶快速制备试剂盒(12.5%)、蛋白Loading Buffer(5×)、蛋白Marker:上海雅酶生物医药科技有限公司;DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒抽提试剂盒:天根生化科技(北京)有限公司;polyM、polyG:青岛博智汇力生物科技有限公司。其他试剂均为国产分析纯。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。
1.2 仪器与设备
Centrifuge5804R型高速冷冻离心机:德国Eppendorf公司;SCIENTZ-IID型超声波细胞破碎仪:宁波新芝生物科技股份有限公司;CFX-96型实时荧光定量PCR仪、蛋白电泳仪系统:美国Bio-Rad公司;Tanon 2500型凝胶成像分析系统:上海天能科技有限公司;Infinite F50型酶标仪:瑞士Tecan公司;Quattro Premier XE三重四极杆液质联用仪:美国WATERS公司;Free-Zone 6 L立式冷冻干燥机:美国LABCONCO公司。
1.3 方法
1.3.1 Misa-aly重组质粒构建
合成编码来源于Microbulbifer salipaludis的假定褐藻胶裂解酶的基因片段,利用SignalP 5.0在线网站预测信号肽位置并切除,同时将6个组氨酸标签添加到目的基因片段的C末端,以简化后续重组酶的分离纯化步骤。将目的基因片段插入表达载体pET-22b(+)的Nde I和Xho I酶切位点之间,构建重组质粒,命名为pET22b-Misa。利用热激法将质粒转入大肠杆菌E.coli BL21(DE3),获得转化子。
1.3.2 诱导表达
挑取1.3.1中的转化子单菌落接种于4 mL的LB培养基,37℃、200 r/min培养12 h;以2%接种量转接至200 mL的LB培养基(Amp 100 μg/mL),37℃、200 r/min培养3 h~4 h。培养至OD600约0.6~0.8后,添加终浓度1 mmol/L的IPTG,在28℃、200 r/min下诱导表达6 h。
1.3.3 表达纯化
将诱导表达后的菌液在25℃、6 000 r/min条件下离心5 min,收集菌体,超声破碎后4℃、8 000 r/min离心10 min除去细胞碎片,用0.45 μm水系滤膜过滤上清液中的杂质,得到粗酶液,冰浴放置。
利用Ni2+亲和层析柱收集上清液中的重组酶,随后将上述得到的重组酶溶液转移至截留分子量为10 kDa的透析袋中,用10 mmol/L乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA-2Na) 的 Tris-HCl缓冲液(50 mmol/L,pH8.0)在 4℃下透析 6 h,以除去重组酶溶液中的咪唑以及其他金属离子。再将透析袋转移至50 mmol/L Tris-HCl pH8.0缓冲液中透析12 h,每6 h更换一次透析液,以去除EDTA。透析结束后,于4℃冰箱保存备用。纯化后的酶液进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)纯度验证。
1.3.4 酶活力和蛋白含量测定
蛋白含量的测定使用BCA试剂盒,以牛血清蛋白(BSA)作为标准蛋白,在560 nm下定量测定样品蛋白浓度。
采用 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定酶活力:取适当稀释的反应液加入两倍体积DNS试剂,沸水浴5 min,迅速冷却至室温约25℃,加入3倍体积水稀释后,560 nm波长下测定吸光度。以葡萄糖为标准,计算反应生成还原糖的量。酶活力单位(U)定义为每分钟生成1 μmol还原糖所需要的酶量。
1.3.5 酶学性质测定
1)酶反应标准体系:终浓度0.35%的海藻酸钠,100 mmol/L 的 NaCl,5 μg/mL 的重组酶,50 mmol/L 的Tris-HCl缓冲液(pH 8.5)。
2)酶反应标准条件:在45℃的恒温水浴中进行酶反应,准确计时5 min后立即将反应体系加入2倍体积的DNS显色液,结束酶反应。
1.3.5.1 最适pH值的测定
选用50 mmol/L不同pH值的缓冲液(磷酸钠缓冲液,pH 6.0~7.5;Tris-HCl缓冲液,pH 7.5~9.0;甘氨酸-NaOH缓冲液,pH 9.0~10.5),按照DNS法测定不同pH值下的褐藻胶裂解酶酶活力,以最大酶活力为100%,分别计算各pH值条件下的相对酶活。
1.3.5.2 最适反应温度的测定
在 Tris-HCl缓冲液(50 mmol/L,pH 8.5)条件下,采用DNS法测定不同温度下(35℃~60℃)褐藻胶裂解酶活力,以最大酶活力为100%,分别计算各温度处理条件下的相对酶活。
1.3.5.3 最适NaCl浓度的测定
在Tris-HCl缓冲液(50 mmol/L,pH8.5),45℃反应体系下,分别添加终浓度为0、25、50、100、200、400mmol/L的NaCl,采用DNS法测定不同NaCl浓度的酶活力,以最高酶活力为100%,计算各浓度的相对酶活。
1.3.5.4 热稳定性的测定
对酶液适当稀释至一定浓度并加入100 mmol/L的NaCl后,在40、45℃和55℃下分别保温1 h,间隔定时取样,在最适温度下采用DNS法测定残余酶活,以未处理的酶液为对照(100%),分别计算各温度处理后的相对残余酶活。
1.3.6 底物特异性及产物组成
将海藻酸钠、polyM、polyG分别作为底物测定酶活力,底物质量浓度均为0.35%。最适反应条件下,采用DNS法测定酶活力,将海藻酸钠组酶活力设为100%,测定不同底物时的比酶活。
9月14日,辽宁省政府发布《辽宁省集中式饮用水水源地保护攻坚战实施方案》,要求自10月起,辽宁省地级及以上城市集中式饮用水水源水质至少每月向社会公开1次;县级集中式饮用水水源水质应至少每季度向社会公开一次。到2020年,全省地级及以上城市集中式饮用水水源地得到全面有效保护。地级及以上城市集中式饮用水水源水质优良比例达到96.3%。强力推进县级及以上城市集中式饮用水水源地规范化建设,基本解决县级及以上城市集中式饮用水水源保护区内各类环境违法问题。加强农村饮用水水源地保护,完成乡级集中式饮用水水源保护区的划定。
在 Tris-HCl缓冲液(50 mmol/L,pH 8.5),40 ℃标准反应体系下,以终浓度1%的海藻酸钠作为底物,加过量酶充分反应24 h。加入4倍体积无水乙醇混合沉淀除去残余多糖与蛋白,8 000 r/min离心10 min,取上清液旋蒸浓缩去除乙醇,冷冻干燥后复溶至浓度为0.1 mg/mL,通过液相-质谱(liquid chromatograph mass spectrometer,LC-MS)检测产物组成。
向1%海藻酸钠标准反应体系中加入5 μg/mL酶,40℃分别反应12 h和24 h,煮沸灭酶后通过0.22 μm过膜后冻干,以冻干产物质量与底物总质量之比计算转化率。
液相色谱条件:色谱仪WATERS ACQUITY UPLC;BEH C18分析柱(2.1 mm×150 mm,1.7 μm)。流动相:A乙腈,B 0.1%甲酸;梯度洗脱程序:0~40 min,0%流动相A,100%流动相B;40 min~45 min,流动相A从 0%变到30%,流动相B从100%变到70%;45 min~50 min,流动相A从30%变到80%,流动相B从70%变到20%;50 min~55 min,流动相A从80%变到100%,流动相B从 20%变到 0%;柱温:45℃;流速:0.3 mL/min;进样量:5 μL。
MS检测条件:离子方式为电喷雾离子源(electron spray ionization,ESI)负模式 ;毛细管电压 3.0 kV;锥孔电压20 V;离子源温度100℃;去溶剂化温度400℃;脱溶剂气流量700 L/h;锥孔气流量50 L/h;碰撞能量6 eV;质量范围 m/z 50~2 000;电压 1 800 V。
1.4 数据处理
蛋白电泳图使用Adobe Photoshop 2021软件处理;序列对比使用CLUSTAL OMEGA与ESPript 3.0在线网站作图;相关酶活力数据使用Microsoft Excel计算,使用Originlab Origin 2021作图。
2 结果与分析
2.1 克隆表达与同源性分析
M.salipaludis的基因片段JF535_RS01340经预测,可能编码褐藻胶裂解酶(WP_207000102.1),命名为Misa-aly。与已报道的一种属于PL7家族来源于Microbulbifer sp.的裂解酶(AlgSH7,登录号 QID05195.1)[21]比对,蛋白序列相似度为73.90%。图1为Misa-aly与其他几个PL7家族褐藻胶裂解酶的序列比对图。
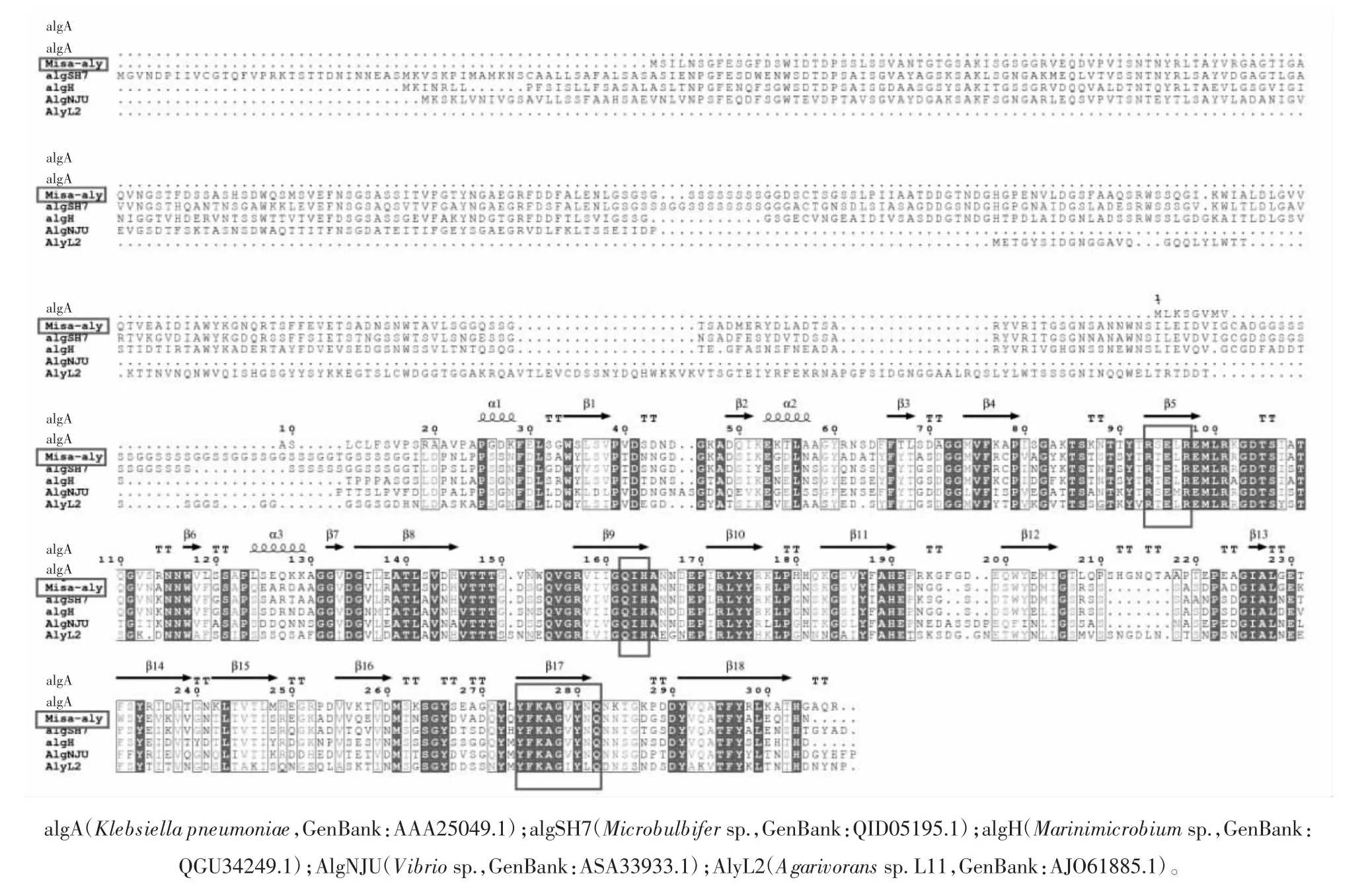
图1 褐藻胶裂解酶的氨基酸序列比对分析Fig.1 Multiple sequence alignment of amino acids from aly
PL7家族具有高度保守的区域SA3(RXEXR)、SA4(YXKAGXYXQ)、SA5(QXH),这些区域同样可以在Misa-aly序列内找到。序列比对分析结合酶学性质鉴定,可以证实该酶属于PL7家族中一种新的褐藻胶裂解酶。
2.2 蛋白表达纯化
Misa-aly全细胞与纯酶电泳图见图2。

图2 Misa-aly全细胞与纯酶电泳图Fig.2 SDS-PAGE analysis of of the whole cells and purified Misa-aly
2.3 酶学性质鉴定
pH值和温度对Misa-aly酶活的影响见图3。

图3 pH值和温度对Misa-aly酶活的影响Fig.3 Effects of pH and temperature on Misa-aly activity
温度和pH值是影响酶活力的重要条件之一。如图3所示,Misa-aly的最适pH值为8.5(Tris-HCl缓冲液),与来自Microbulbifer sp.的褐藻胶裂解酶AlgSH7相似(最适pH 9.0,最适温度40℃)[21]。绝大多数褐藻胶裂解酶的最适pH值为中性或弱碱性,只有少数为酸性。Misa-aly在弱碱性范围内相对酶活较高,pH8.0~9.0范围内相对酶活维持在80%以上。由于PL7家族褐藻胶裂解酶的产酶微生物大多来源于海洋,因此最适温度通常为30℃~50℃。类似的,Misa-aly最适温度为45℃,且对温度较为敏感。40℃和50℃时的相对酶活力下降为61.0%和65.3%。通常而言,海藻酸钠在碱性环境下溶解度增大、黏度下降,有利于生产;利用酶的冷适应特性与敏感性,可以更精准地控制启动和终止催化反应,有利于寡糖的精确生产调控[21]。
NaCl浓度对Misa-aly酶活的影响见图4。

图4 NaCl浓度对Misa-aly酶活的影响Fig.4 Effects of NaCl on Misa-aly activity
大多数褐藻胶裂解酶产酶微生物来自于海洋,因此Na+对褐藻胶裂解酶的催化活性具有一定的影响。如图4所示,Misa-aly的最适NaCl浓度为100 mmol/L,在400 mmol/L的高盐条件时相对酶活维持60%以上,而不额外添加Na+时相对酶活也超过50%。NaCl浓度在25 mmol/L~200 mmol/L,酶活都能在75%以上。褐藻胶作为一种海洋多糖,大多数研究表明褐藻胶裂解酶具有一定的Na+依赖性,如来自Vibrio splendidus OU02[22]、Microbulbifer thermotoleransDAU221[23]的褐藻胶裂解酶,不额外添加Na+时酶活力急剧下降。Misa-aly在不添加Na+时的较高活性,证明其对Na+的依赖性不强,这样可以降低添加NaCl的原料成本,减少后续脱盐环节,降低机械设备损耗。
在40、45℃和55℃下分别保温处理酶液,测定Misa-aly的热稳定性,结果见图5。

图5 不同温度保温对Misa-aly稳定性影响Fig.5 Effect of temperature on the stability of Misa-aly
如图5所示,Misa-aly在40℃以下时较为稳定,40℃保温1.0 h,残余酶活保留50%以上;在45℃下保温0.5 h,残余酶活下降到35%以下。褐藻胶裂解酶家族中一大部分裂解酶来源于海洋细菌,通常在40℃以上温度稳定性较差[22-25],具有典型的冷适应性,易于在狭窄的温度范围内控制反应进程,方便获得需要的聚合度范围的低聚糖。
2.4 Misa-aly底物特异性及产物组成
最适反应条件下,分别以海藻酸钠、polyM、polyG作为底物测定酶的催化活力,结果见图6。

图6 Misa-aly对不同底物的相对酶活力Fig.6 Substrate specificity of Misa-aly
由图6可知,当以海藻酸钠为底物时,酶活力为(53.0±1.2)U/mg;以polyG和polyM为底物时的相对活力分别为海藻酸钠的89.8%和273.8%,酶活力分别为(47.6±1.5)、(145.1±2.1)U/mg。与其他已研究的 PL7家族的褐藻胶裂解酶相似,Misa-aly也属于polyM偏好酶。
充分裂解底物海藻酸钠后,通过LC-MS对产物进行褐藻寡糖组分分析,结果见图7。
如图7所示,海藻酸钠经Misa-aly酶解后,产物分别主要集中分布在3个峰内(图7a),3个峰的主要产物分别对应质荷比 351(图 7b)、527(图 7c)和 703(图7d),即聚合度分别为DP2、DP3、DP4的褐藻寡糖,说明反应最终裂解产物可以产生聚合度DP2~4的寡糖。1%(10 mg/mL)海藻酸钠溶液在40℃下裂解反应12 h后,还原糖浓度达到0.56 mg/mL(DNS法计),冻干计算转化率为69.2%,24 h后冻干计算转化率可达到94.7%。相比之下,rFlAlyA-aly酶解4h,转化率为70.1%,效率较高[26];但Misa-aly酶解24 h后,底物海藻酸钠几乎全部酶解,酶解更为彻底。

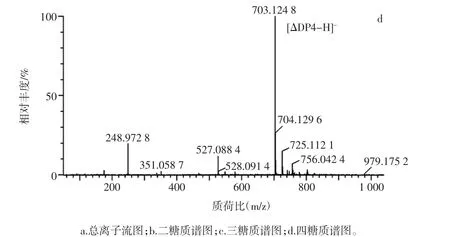
图7 裂解产物总离子流图与二糖、三糖、四糖对应质谱图像Fig.7 The mass spectrum images of pyrolysis products,disaccharide,trisaccharide and tetrasaccharide
3 结论
本试验筛选出一种来源于Microbulbifer salipaludis的新型褐藻胶裂解酶,合成了Misa-aly编码基因,并实现了在大肠杆菌E.coli BL21(DE3)中的异源表达。经分离纯化后,研究了Misa-aly酶学性质。以海藻酸钠为底物,通过 DNS法测定酶活力为(53.0±1.2)U/mg,最适pH值为8.5(Tris-HCl缓冲液),最适温度为45℃,40℃下半衰期约在1 h左右。Misa-aly对Na+依赖性较低,可以降低生产原料成本,减轻后续脱盐工序环节的压力,并降低机械设备损耗。Misa-aly属于PL7家族多糖裂解酶,且底物偏好性为聚甘露糖醛酸(polyM)。在Misa-aly催化作用下,海藻酸钠的裂解产物为DP2-4的寡糖,24 h后酶解转化率达到94.7%,底物海藻酸钠几乎全部酶解,转化率较高。因此,Misa-aly在褐藻寡糖的生物制备中具有一定的应用前景。
