镰刀菌Fo47来源木聚糖酶的异源表达、酶学性质及其对全麦面包品质的影响
2022-06-23张亚萍赵风光刘纯杨曼丽林影韩双艳
张亚萍,赵风光,刘纯,杨曼丽,林影,韩双艳*
(1.华南理工大学 生物科学与工程学院,广东 广州 510006;2.华南理工大学 轻工科学与工程学院,广东 广州 510006)
面制品是中国北方地区的传统主食,由于小麦的品种以及地理因素的限制,在制作面制品时,往往需要面粉改良剂的辅助[1]。传统的化学添加剂,如溴酸钾[2]、偶氮甲酰胺[1]等,由于存在安全隐患,已经被禁止在面粉中使用。与此同时,酶制剂作为绿色温和的面粉改良剂,正在显示出广泛的应用前景。近些年来,酶制剂在烘焙中的应用越来越受到重视,包括α-淀粉酶、蛋白酶和木聚糖酶在内的几种酶制剂已成功应用于烘焙行业[2-5]。但是,用于烘焙行业的商业木聚糖酶种类较少,并且多为国外公司供应[6]。
木聚糖酶能够水解小麦等谷物结构中存在的非淀粉多糖[7]。全麦面粉中的阿拉伯木聚糖(Arabinoxylan,AX)含量约为2%~5%,其中水溶性的阿拉伯木聚糖(water-extractable Arabinoxylans,WE-AX)约占25%~30%,水不溶性阿拉伯木聚糖(water-unextractable Arabinoxylans,WU-AX)约占 70%~75%[4,6,8]。WE-AX 具有低水亲和力,可诱导面筋网络中的水再分配,提高面团和面包的质量,WU-AX则对面包体积具有负面影响[9-11]。Both等[12]评估木聚糖酶对全麦面包的影响,证实木聚糖酶可以减少面团中纤维的不良影响。Guo等[13]发现,与高分子量水不溶性阿拉伯木聚糖相比,水溶性阿拉伯木聚糖可以通过增强水分子、淀粉和麸质之间的相互作用来改善小麦面团的流变特性和加工性能。此外,在木聚糖酶的作用下,面粉中释放的低聚木糖具有益生元作用[14],这些低聚物在刺激肠道双歧杆菌生长和促进肠道健康方面有着一定的潜力[15]。
迄今为止,已经从微生物中鉴定出多种木聚糖酶,并研究了它们对面团和面包质量的影响[16]。然而,酶源、纯度和特异性引起的活性和作用方式的变化会影响酶对面团面包的作用效果。烘焙行业一直在寻找更多具有良好性能和应用效果的酶[16]。在新酶挖掘中,基因组挖掘手段已被证明是一种有效且经济的方法,可以用于发现具有潜在工业应用的新酶[17]。在前期研究中,以对面包加工具有积极效果的棉状嗜热丝孢菌木聚糖酶(spO43097.1)为出发序列,利用基因组挖掘方法,找到了5种具有潜在价值的木聚糖酶基因,且在后续的验证试验中,来源于镰刀菌Fo47的木聚糖酶(EWZ46984.1)对改善面包品质具有积极效果。
为进一步探索镰刀菌Fo47木聚糖酶(Fusarium oxysporum Fo47 xylanase,FXYL)的生化特性,评估其对全麦面包品质改善的效果,本文对镰刀菌Fo47木聚糖酶进行了异源表达和分离纯化,在研究其酶学性质的基础上,通过面包烘焙试验,探讨其对全麦面包品质的影响,旨在为木聚糖酶在烘焙面包中的应用提供一种良好的候选酶,为丰富我国面粉改良酶制剂种类奠定理论基础。
1 材料与方法
1.1 材料与试剂
毕赤酵母X33菌株:华南理工大学生物科学与工程学院微生物酶学实验室保存;毕赤酵母筛选培养基(yeast extract peptone dextrose zeocin agar medium,YPDZ)、发酵生长培养基(buffered glycerol-complex medium,BMGY)、甲醇诱导培养基(buffered methanolcomplex medium,BMMY):参考美国Invitrogen公司毕赤酵母表达手册制备;酵母粉、蛋白胨、无氨基酵母氮源(生化试剂):美国BD公司;限制性内切酶(生化试剂):美国Thermo公司;鑫乐全麦面粉:塞鑫面业有限公司;木聚糖(分析纯):美国Sigma公司。
1.2 仪器与设备
MicroPulser电转仪:美国Bio-Rad公司;AKTApure蛋白纯化系统:美国通用电气公司;Biotek多功能酶标仪:美国基因有限公司;ESC1510全自动面包机:美的集团股份有限公司;KX32-V2171多功能烤箱:九阳股份有限公司;TA-XT质构仪:英国Stable Microsystem公司。
1.3 方法
1.3.1 镰刀菌Fo47木聚糖酶毕赤酵母重组表达菌的构建
利用 SignalP-5.0 Server(https://services.healthtech.dtu.dk/service) 预测镰刀菌 Fo47木聚糖酶(EWZ 46984.1)自身信号肽序列,利用NetNGlyc1.0在线网站(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)预测该蛋白N-糖基化位点。将不含前导肽序列的镰刀菌Fo47木聚糖酶氨基酸序列,按照毕赤酵母密码子偏好性进行优化,并在N端和C端分别加上EcoR1和Not1酶切位点后,交由上海捷瑞生物工程有限公司进行全基因合成,合成的基因连接在pPiczαA上。对全基因合成的质粒用限制性内切酶EcoR1和Not1进行双酶切验证,并将该质粒送往北京擎科生物科技有限公司进行测序,将测序正确的质粒命名为pPiczαA-fxyl。然后将重组质粒pPiczαA-fxyl线性化后,通过电击的方法将其转化至毕赤酵母X33中,并将其涂布于YPDZ固体筛选平板上。挑取YPDZ平板上的酵母单菌落进行裂解后,取适量酵母菌裂解液作为模板进行菌落聚合酶链式反应(polymerase chain reaction,PCR)验证,其中上游引物为5'-GCTCCATCTAAGGAAGGTT-3',下游引物为 5'-TTGACATGGTTCGTTAGCTC-3'。
1.3.2 重组镰刀菌Fo47木聚糖酶的诱导表达和纯化
接种1.3.1酵母菌落PCR鉴定过的阳性转化子于BMGY液体培养基中(5 mL),30℃、250 r/min振荡培养20 h~24 h。25℃温度下,3 000 r/min离心2 min后,收集菌体,并将其转接至BMMY液体培养基(25 mL)中,控制转接后的初始菌液OD600为0.5~1.0。之后,于30℃、250 r/min条件下继续培养144 h,期间每隔24 h取样测定木聚糖酶的酶活力,并向培养基中添加甲醇至1.0%。用导入pPiczαA空载体的毕赤酵母X33菌株作为对照,来验证木聚糖酶是否成功表达。
收集发酵上清液,使用0.22 μm膜进行过滤,以防止堵塞层析柱。将获得的样品螯合到Ni-NTA柱,先用20 mmol/L的磷酸盐缓冲液(pH7.0)进行平衡,之后使用含有咪唑的洗脱缓冲液(50 mmol/L~500 mmol/L咪唑、20 mmol/L磷酸盐缓冲液、pH7.0)梯度洗脱吸附的蛋白质,收集含有木聚糖酶活性的组分并进行浓缩。对收集到的组分进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析判断蛋白质纯度[18],通过考马斯亮蓝法(Bradford法)[19]测定蛋白质的浓度,并计算重组木聚糖酶的比酶活。
1.3.3 重组镰刀菌Fo47木聚糖酶酶活力测定
使用 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定木聚糖酶的酶活力[20]:以山毛榉木聚糖作为底物,用100 mmol/L的柠檬酸盐缓冲液(pH5.0)配制成1%山毛榉木聚糖的浓度。取100 μL底物,向其中加入100 μL稀释后的酶液,45℃反应10 min,立即加入300 μL DNS试剂,沸水浴5 min,冷却至20℃~30℃后,用酶标仪测定540 nm下吸光度值。配制不同浓度的木糖溶液,同样条件下与DNS反应,绘制标准曲线。木聚糖酶酶活力定义:在45℃,1 min水解底物生成1 μmoL还原糖的酶量定义为一个酶活力单位(U)。
1.3.4 pH值和温度对重组镰刀菌Fo47木聚糖酶特性的影响
按照1.3.3酶活力测定方法,测定重组木聚糖酶在不同pH值(3.0~8.0)和不同温度(30℃~60℃)下的酶活力,确定最适反应pH值和最适反应温度。将酶液置于不同pH值(4.0~11.0)的缓冲液中,25℃下处理12 h,以最高木聚糖酶酶活力为100%,计算相对酶活力,研究重组木聚糖酶的pH值稳定性。将酶液分别置于不同温度(4℃~70℃)中保温1 h,以最高木聚糖酶酶活力为100%,计算相对酶活力,确定其温度稳定性。所用缓冲液pH 3.0~6.0内采用100 mmol/L柠檬酸盐缓冲液,pH6.0~8.0内采用100 mmol/L磷酸盐缓冲液,pH8.0~9.0 采用 100 mmol/L Tris-HCl缓冲液,pH9.0~11.0采用100 mmol/L甘氨酸-氢氧化钠缓冲液。
1.3.5 面包的制作及质量评估
参照Liu等[21]的方法进行全麦面包的制作。将100 g全面粉、58 g纯净水、6 g糖、1.6 g食用盐、1 g酵母粉、3 g食用油和适量1.3.2纯化的酶制剂加入到面包机中,搅拌后形成均匀的面团。将和好的面团置于天平上,分成50 g/个,揉成圆形,置于38℃条件下发酵60 min。发酵结束后,将面团放入180℃烤箱中焙烤10 min,得到面包成品。将制得的面包20℃~30℃下冷却2 h,测定全麦面包的质量、体积、质构和比容,比容为全麦面包的体积/全麦面包的质量(cm3/g)。为测试全麦面包芯的质构特性,将全麦面包切成厚度为2 cm的面包片,使用TA-XT质构仪的P/25探头进行测试,测前速度、测试速度和测后速度分别设置为1、1 mm/s和5 mm/s,面包压缩比设置为50%,两次下压间隔时间设置为10 s。其中,以不加酶组为对照组,以加酶组为试验组。
1.4 数据处理
使用Origin 8.0软件对试验数据进行绘图。使用SPSS22.0软件对试验数据进行显著性分析(p<0.05)。
2 结果与讨论
2.1 镰刀菌Fo47木聚糖酶基因的优化
镰刀菌Fo47来源的木聚糖酶(EWZ46984.1)序列全长289个氨基酸,SignalP-5.0信号肽预测显示其肽链的N端含有19个氨基酸前导肽序列。针对毕赤酵母偏好性,对镰刀菌Fo47木聚糖酶去除前导肽后的270个氨基酸序列,进行密码子优化,优化后的镰刀菌Fo47木聚糖酶序列图见图1。

图1 密码子优化后镰刀菌Fo47木聚糖酶序列Fig.1 Sequence diagram of Fusarium oxysporum Fo47 xylanase after codon optimization
为方便后续的重组表达载体构建及质粒线性化,密码子优化后的碱基序列规避了EcoR1、Not1和Sac1酶切位点,优化后的碱基序列GC含量为48.89%,开放阅读框内目的蛋白理论分子量为31.6 kDa,NetNGlyc糖基化预测发现该蛋白有两个N-糖基化位点。
2.2 重组镰刀菌Fo47木聚糖酶毕赤酵母工程菌的构建
将全基因合成生物公司交付的质粒用EcoR1和Not1限制性内切酶进行双酶切验证,琼脂糖凝胶电泳结果如图2所示。
由图2可知,重组表达质粒经过双酶切后,得到了3 500 bp和800 bp左右的条带,分别与载体片段和目的基因片段大小一致。将该质粒线性化后电转化至毕赤酵母X33中,培养获得重组子,通过菌落PCR验证,结果见图3。

图2 重组Fo47木聚糖酶毕赤酵母质粒双酶切鉴定结果Fig.2 Identification results of recombinant plasmid by double enzyme digestion
由图3可知,菌落PCR的片段大小约为800 bp,与目的基因大小相符,表明重组镰刀菌木聚糖酶毕赤酵母重组菌构建成功。

图3 重组Fo47木聚糖酶毕赤酵母菌落PCR鉴定结果Fig.3 PCR identification of recombinant Pichia pastoris colony
2.3 重组镰刀菌Fo47木聚糖酶在毕赤酵母中的分泌表达
将酵母菌落PCR鉴定的阳性转化子按照1.3.2所述方法进行摇瓶发酵,用1%的甲醇进行诱导表达,每隔24 h取样,测试重组酵母菌生长情况和发酵液上清木聚糖酶酶活力,结果见图4。

图4 重组镰刀菌Fo47木聚糖酶毕赤酵母生长曲线和产酶曲线Fig.4 Growth curve and enzyme production curve of recombinant Pichia pastoris
由图4可知,随着诱导表达时间的延长,重组毕赤酵母菌OD600和发酵液上清中木聚糖酶的酶活力逐渐上升,当诱导表达时间为144 h时,重组毕赤酵母菌OD600达到33.96,发酵上清酶活力达到779.64 U/mL。结果表明,利用毕赤酵母X33,实现了重组镰刀菌木聚糖酶的异源分泌表达。
2.4 重组镰刀菌Fo47木聚糖酶的纯化及SDS-PAGE分析
收集发酵上清液,利用Ni-NTA柱层析对发酵液上清中的重组木聚糖酶进行纯化,收集洗脱液进行木聚糖酶酶活力测定,蛋白浓度测定和SDS-PAGE分析,结果见图5。

图5 重组镰刀菌Fo47木聚糖酶SDS-PAGEFig.5 SDS-PAGE analysis of recombinant xylanase
结果表明,纯化后的FXYL木聚糖酶的比酶活为764.33 U/mg,表观分子量约为35 kDa,略大于其理论分子量31.6 kDa,推测可能是蛋白质糖基化导致的分子量增加。
2.5 重组镰刀菌Fo47木聚糖酶的酶学性质研究
pH值对重组FXYL的影响如图6所示。
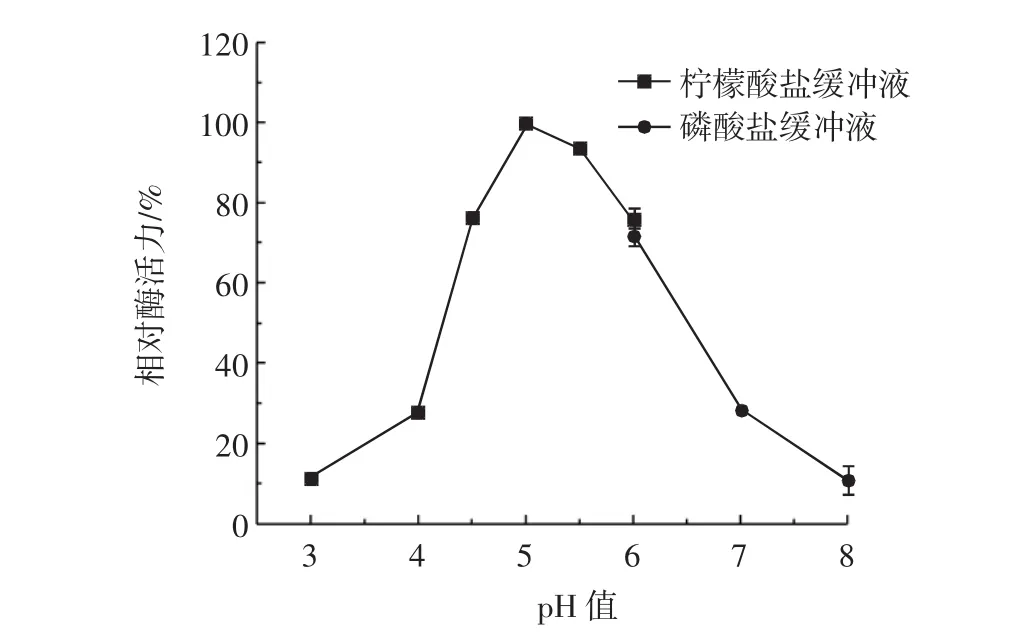
图6 重组镰刀菌Fo47木聚糖酶最适反应pH值Fig.6 Effects of pH on the activity of of recombinant FXYL
由图6可知,随着pH值的升高,FXYL的相对酶活力先升高再降低,最适反应pH值为5.0。将FXYL在不同pH值(4.0~11.0)孵育12 h后,测定相对酶活力,结果如图7所示。

图7 重组镰刀菌Fo47木聚糖酶pH值稳定性Fig.7 The pH stability of recombinant FXYL
由图7可知,在pH5.5~10.0内放置12 h,FXYL能保持60%以上的相对酶活力,表明FXYL具有较宽的pH值耐受性。
温度对重组FXYL的影响如图8所示。
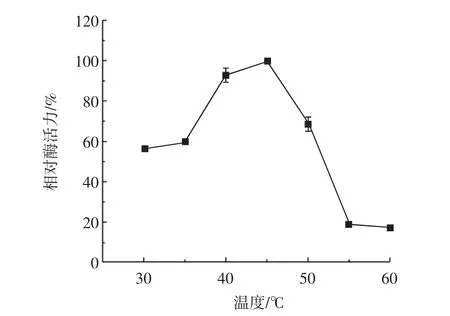
图8 重组镰刀菌Fo47木聚糖酶最适反应温度Fig.8 Effects of temperature on the activity of recombinant FXYL
由图8可知,FXYL的最适温度为45℃,在30℃~50℃相对酶活力在60%以上。热稳定性结果如图9所示。

图9 重组镰刀菌Fo47木聚糖酶温度稳定性Fig.9 The temperature stability of recombinant FXYL
由图9可知,随着温度的升高,重组FXYL的酶活力逐渐降低,在温度小于40℃放置1 h时,FXYL的相对酶活力保持在80%以上,随着温度的进一步升高,酶活力急剧降低,在温度为50℃时,FXYL仅残余20%左右的相对酶活力。
酶的作用温度对于面包烘焙至关重要,面团制备和醒发通常在中低温下进行,这意味着在中低温下具有良好活性的木聚糖酶可能更适合烘焙行业[22]。FXYL在30℃~45℃的温度内,具有良好的活性和稳定性(>60%),这也与面团的制备和醒发温度相一致。另一方面,木聚糖酶的pH值活性对其在烘焙中的利用也非常重要。在面团发酵过程中,面团中细菌缓慢产生的有机酸以及二氧化碳在水中溶解产生的碳酸会导致面团的pH值处于弱酸性(pH 6左右)[23]。在该pH值下,FXYL木聚糖酶的活性和稳定性都能够保持60%以上。这些结果均表明FXYL木聚糖酶在面包生产中具有潜在的优势。
2.6 重组镰刀菌Fo47木聚糖酶对全麦面包品质的影响
为了评估FXYL的潜在应用价值,将上述纯化的重组FXYL木聚糖酶(764.33 U/mg)添加到面团中,进行面包的制备,结果见表1。
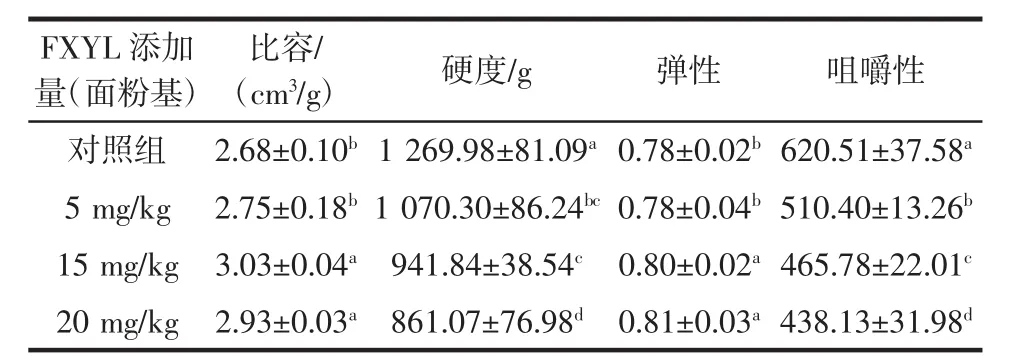
表1 重组镰刀菌Fo47木聚糖酶对全麦面包品质的影响Table 1 Effect of recombinant FXYL on wholemeal bread
在面包烘焙行业中,面包体积是评价面包质量的重要指标。从表1可以看出,与对照组相比,添加重组镰刀菌木聚糖酶FXYL后,全麦面包的比容明显增加,当FXYL添加量为15 mg/kg面粉基时,全麦面包的比容最大,与对照组相比,增加了13.06%。另一方面,面包的质构特性对于面包的品质也至关重要,在本研究中,通过质构仪研究了FXYL对面包硬度、弹性、咀嚼性的影响,与对照组相比,添加FXYL后,全麦面包的硬度和咀嚼性显著降低,弹性则明显增加。当FXYL添加量为20 mg/kg面粉基时,面包的硬度和咀嚼性分别降低了32.20%和29.39%,弹性增加了3.85%。全麦面包的比容和弹性与全麦面包品质成正比,硬度和咀嚼性则与全麦面包的品质成反比。这些结果表明,添加FXYL可以显著提高全麦面包的品质,其有望成为面包改良剂的候选。
研究表明,面粉中存在的水不溶性阿拉伯木聚糖是影响面粉加工品质的重要影响因素[8]。在面团混合过程中,阿拉伯木聚糖与面筋竞争水分,影响面筋蛋白的聚集和面筋网络的形成[24]。木聚糖酶可以通过水解水不溶性阿拉伯木聚糖的主链,降低其分子大小和持水能力,从而产生更好的面筋网络结构,进而提高面团的持气性和终端产品面包的品质[24-25]。
3 结论
本研究根据毕赤酵母的密码子偏好性,在不改变氨基酸序列的条件下,对镰刀菌Fo47木聚糖酶进行了密码子优化。之后构建了镰刀菌Fo47木聚糖酶重组表达菌,实现了其在毕赤酵母中的分泌表达。摇瓶水平下,甲醇诱导表达144 h后,重组毕赤酵母菌发酵上清酶活力达到779.64 U/mL。通过Ni-NTA柱层析对重组毕赤酵母发酵上清液进行了分离纯化,目的蛋白比酶活为764.33 U/mg。酶学性质研究表明,重组镰刀菌Fo47木聚糖酶最适反应温度为45℃,在小于40℃温度下放置1 h后,木聚糖酶的相对酶活力能保持在80%以上,属于中温酶;重组木聚糖酶最适反应pH值为 5.0,在 pH5.5~10.0,25℃放置 12 h后,相对酶活力保持60%以上,具有良好的pH值稳定性。最后,初步研究了重组镰刀菌Fo47木聚糖酶对全麦面包品质的影响,该酶能够提高全麦面包的比容和弹性,降低全麦面包的硬度和咀嚼性,后续需要进一步开展更为细致的研究,考察其是否可以发展成为一种新型的面包改良剂。
