干酪乳杆菌SB27降低N-亚硝胺对IEC-6细胞毒性作用研究
2022-06-22王淑梅于佳睿易华西
王淑梅,邸 维,于佳睿,王 雪,单 艺,易华西
(1.哈尔滨学院 食品工程学院,黑龙江 哈尔滨 150086;2.广东科贸职业学院 食品与生物工程学院,广东 广州 510430;3.中国海洋大学 食品科学与工程学院,山东 青岛 266100)
亚硝酸盐作为护色剂或防腐剂在肉制品加工中被广泛应用。在一定条件下,亚硝酸盐与二级胺或三级胺相互作用生成N-亚硝基化合物。存在于食品中的N-亚硝基化合物主要为N-亚硝胺类[1],是毒性很强的一类物质[2]。研究显示,多种食物中都含有一定量的N-亚硝胺,如N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基哌啶(N-nitrosopiperi dine,NPIP)[1],是食品中重要的致癌物[3]。N-亚硝胺诱发人体癌变具有明显的器官亲和性,不同化合物具有不同的致癌靶器官[4]。如外源性NDMA随食物进入体内,主要在肠道被吸收[4],因此肠道黏膜成为NDMA发挥毒性作用的靶向组织[5]。而体内亚硝化反应生成内源NDMA也发生在肠腔内,因此,NDMA成为肠道癌的诱变剂[6],诱导肠道黏膜细胞的损伤[7-9]。
在我国肉制品加工中,除控制护色剂、防腐剂使用量之外,也制订了N-亚硝胺的限量标准。现行食品安全国家标准GB 2762—2017《食品安全国家标准食品中污染物限量》中规定肉制品中NDMA含量≤3 μg/kg,海产品中NDMA含量≤5 μg/kg。虽然对肉制品及海产品中NDMA含量有严格限定,但是随着食品产地、种类及加工方式的不同,NDMA的含量也显著不同。调查显示,NDMA在我国熏肉制品中仅含0.3~6.5 μg/kg,而在日本加工干鱿鱼中含量高达300 μg/kg[4]。因此,除了改进加工工艺及在加工过程中添加抗氧化剂外,适当增加亚硝化阻断剂,如维生素C(vitamin C,VC)、维生素E(vitamin E,VE)、酚类及黄酮类的摄入量也可降低NDMA对人体的毒性损伤。
目前研究证实,乳酸菌可降低N-亚硝胺的毒性作用[2],可直接降低食品(如泡菜、香肠)中N-亚硝胺的含量。LIAO E等[10-11]研究发现,植物乳杆菌(Lactobacillus plantarum)120的添加可显著降低中国传统发酵鱼制品中的亚硝酸盐和NDMA含量,说明乳酸菌是抑制中国传统发酵鱼制品发酵过程中NDMA累积的一种有效方法。有研究发现,乳杆菌属中的植物乳杆菌、双歧杆菌(Bifidobacterium)、保加利亚乳杆菌(Lactobacillus bulgaricus)、噬酸乳杆菌(Lactobacillus acidophilus)、鼠李糖乳杆菌(Lactobacillus rhamnosus)具有降低N-亚硝基化合物含量的能力[12],有望与VC、VE和酚类等一同作为亚硝化阻断剂。前期研究显示,干酪乳杆菌(Lactobacillus casei)SB27作为发酵菌种具有较强的耐酸、耐胆盐性能,可定植于人体肠道上皮细胞[13]。因此,在前期研究的基础上,本研究以干酪乳杆菌SB27为研究对象,考察NDMA、NDEA、NPYR和NPIP(0~80 μg/mL)对其生长繁殖的影响,并以VC(50 μmol/L)为阳性对照,采用细胞计数试剂盒(cell counting kit,CCK)-8法分析干酪乳杆菌SB27(103~106CFU/mL)降低NDMA、NDEA、NPYR和NPIP(0~80 μg/mL)对大鼠肠道黏膜细胞IEC-6毒性作用的能力,以期进一步明确干酪乳杆菌SB27降解N-亚硝胺及菌株发挥功能的关键成分提供理论研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞和菌株
大鼠肠道黏膜细胞IEC-6:东北农业大学食品学院;干酪乳杆菌(Lactobacillus casei)SB27:分离自甘肃北部的牦牛乳,现保存于哈尔滨工业大学化学工程与技术学院。
1.1.2 化学试剂
N-二甲基亚硝胺、N-二乙基亚硝胺、N-亚硝基吡咯烷、N-亚硝基哌啶:美国Sigma-Aldrich公司;CCK-8试剂盒:上海碧云天生物技术有限公司;胰酶消化液:美国Corning公司;胎牛血清(fetal bovine serum,FBS):美国Thermo Fisher Scientific公司。其他试剂均为国产分析纯。
1.1.3 培养基
DMEM(Dulbecco's modified eagle medium):美国Corning公司。
MRS液体培养基[14]:蛋白胨10 g/L,牛肉膏8 g/L,酵母浸粉5 g/L,葡萄糖20 g/L,吐温-80 1.0 mL/L,磷酸氢二钾2 g/L,柠檬酸氢二胺2 g/L,七水硫酸镁0.58 g/L,三水乙酸钠5 g/L,硫酸锰0.25 g/L,蒸馏水1 000 mL,调整pH 6.2~6.6,于121 ℃高压蒸汽灭菌15 min。MRS固体培养基中添加琼脂18 g/L。
1.2 仪器与设备
HEPA1100二氧化碳培养箱、Forma 102厌氧培养箱:美国Thermo Electron公司;CX31电子显微镜:日本Olympus公司;Sartorius AG PB-10 pH计:德国Sartorius公司;Bio-Rad-680酶标仪:美国Bio-rad公司。
1.3 实验方法
1.3.1N-亚硝胺工作液的制备
将NDMA、NDEA、NPYR和NPIP溶于双蒸水中,配成质量浓度为10mg/mL的储备液[15],4℃保存。实验中将10mg/mL储备液稀释成1 000 μg/mL工作液,4 ℃保存备用。
1.3.2N-亚硝胺在MRS液体培养基中对菌株SB27生长的影响
取50 μL菌液接种于MRS液体培养基中,轻微振荡,37 ℃培养18 h,活化2代后备用。将N-亚硝胺工作液加入MRS液体培养基中,使终质量浓度分别为0、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL[1],将已活化的干酪乳杆菌SB27以4%(V/V)的接种量加入培养基中,37 ℃条件下培养7 d,每隔24 h采用倾注平板法进行菌落计数[16]。
1.3.3 干酪乳杆菌SB27对IEC-6细胞存活率的影响
将IEC-6细胞悬于DMEM中,调整细胞浓度为5×104个/mL,将细胞悬液加入到96孔组织培养板中,每孔100 μL。待细胞完全贴壁后,移去细胞培养液,加入10 μL各剂量的干酪乳杆菌SB27,使其终浓度分别为0(空白对照组)、103CFU/mL、104CFU/mL、105CFU/mL和106CFU/mL。各孔最后用DMEM补至100 μL。96孔培养板放置CO2培养箱中(5%CO2,95%空气,100%相对湿度),37 ℃条件下分别培养至2 h、8 h、14 h和20 h时加入10 μL CCK-8溶液,再继续孵育4 h。采用酶标仪检测波长450 nm处的吸光度值,并计算细胞存活率,其计算公式如下:
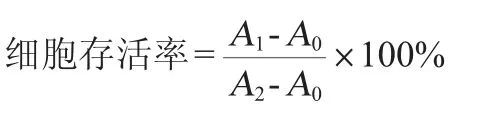
式中:A0为具有DMEM和CCK-8溶液的孔的吸光度值;A1为具有DMEM、IEC-6细胞、CCK-8溶液和干酪乳杆菌SB27的孔的吸光度值;A2为具有DMEM、IEC-6细胞、CCK-8溶液的孔的吸光度值。
1.3.4 干酪乳杆菌SB27降低N-亚硝胺毒性作用的检测
通过对大鼠肠道黏膜细胞IEC-6的生长增殖分析干酪乳杆菌SB27降低N-亚硝胺的毒性作用。采用CCK-8法,细胞处理及干酪乳杆菌SB27的添加同1.3.3,再分别加入NDMA、NDEA、NPYR和NPIP,使其终质量浓度分别为0、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL和80 μg/mL,阳性对照组为VC(50μmol/L)。96孔培养板放置CO2培养箱中(5%CO2,95%空气,100%相对湿度),37 ℃条件下培养至20 h时加入10 μL CCK-8溶液,再继续孵育4 h。采用酶标仪检测波长450 nm处的吸光度值,并计算细胞存活率,其计算公式如下:

式中:A0为具有DMEM和CCK-8溶液的孔的吸光度值;A3为具有DMEM、IEC-6细胞、CCK-8溶液、干酪乳杆菌SB27和N-亚硝胺的孔的吸光度值;A4为具有DMEM、IEC-6细胞、CCK-8溶液的孔的吸光度值。
1.3.5 数据处理及统计分析
实验重复3次,利用SAS 9.1软件进行方差分析,结果表示为“平均值±标准偏差”(X±SD),显著性水平设定为P<0.05。
2 结果与分析
2.1 N-亚硝胺在MRS液体培养基中对干酪乳杆菌SB27生长的影响
N-亚硝胺在MRS液体培养基中对干酪乳杆菌SB27生长的影响见图1。

图1 不同质量浓度的NDMA(a)、NDEA(b)、NPYR(c)和NPIP(d)对干酪乳杆菌SB27生长的影响Fig.1 Effect of different mass concentrations of NDMA (a),NDEA (b),NPYR (c) and NPIP (d) on Lactobacillus casei SB27 growth
由图1可知,随着培养时间的延长,各实验组干酪乳杆菌SB27的活菌数均呈先升高后下降的趋势,且各剂量组之间干酪乳杆菌SB27活菌数的差异不显著(P>0.05)。说明随着培养时间的变化,干酪乳杆菌SB27活菌数的显著差异是由菌株自身生长和繁殖周期所致,并非N-亚硝胺的毒性损伤。结果表明,N-亚硝胺在MRS液体培养基中对干酪乳杆菌SB27的生长增殖无显著影响,与NOWAK A等[16]的研究结果相似。
2.2 干酪乳杆菌SB27对IEC-6细胞存活率的影响
干酪乳杆菌SB27对IEC-6细胞存活率的影响见图2。

图2 干酪乳杆菌SB27对IEC-6细胞增殖的影响Fig.2 Effect of Lactobacillus casei SB27 on IEC-6 cells proliferation
由图2可知,随着培养时间的延长,各组IEC-6细胞的存活率呈现增长的趋势,培养6h与培养24h差异显著(P<0.05)。但是在相同培养时间内,空白对照组和干酪乳杆菌SB27各剂量组差异不显著(P>0.05)。说明干酪乳杆菌SB27对大鼠肠道黏膜细胞IEC-6的存活率并未产生显著的影响,因此可进行后续研究。
2.3 干酪乳杆菌SB27降低N-亚硝胺毒性的作用
VC每日推荐摄取量(recommended dietary allowance,RDA)约为60 mg/d[17]。人体每天摄入100 mg的VC会使血浆VC的浓度略低于60 μmol/L,由此推测平衡膳食条件下人血浆VC水平范围为5~50 μmol/L[18]。研究也显示,VC(50 μmol/L)在NPIP和NPYR存在下,对人的白血病细胞HL-60和肝癌细胞HepG2发挥保护作用。由于VC具有抗氧化性,又可减少N-亚硝胺对机体的损伤[19],因此本研究选用VC(50 μmol/L)作为阳性对照,选定干酪乳杆菌SB27的活菌体成分,分析其发挥降低N-亚硝胺对IEC-6细胞毒性作用的能力。
2.3.1 干酪乳杆菌SB27降低NDMA毒性的作用
由图3可知,当干酪乳杆菌SB27添加量分别为104CFU/mL、105CFU/mL、106CFU/mL时,NDMA剂量为20~80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NDMA剂量为0~10 μg/mL时的细胞存活率与空白对照组差异不显著(P>0.05),以上各组与阳性对照组差异均不显著(P>0.05)。当干酪乳杆菌SB27添加量为103CFU/mL时,NDMA剂量为80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NDMA剂量为0~40 μg/mL时的IEC-6细胞存活率与空白对照组差异不显著(P>0.05)。
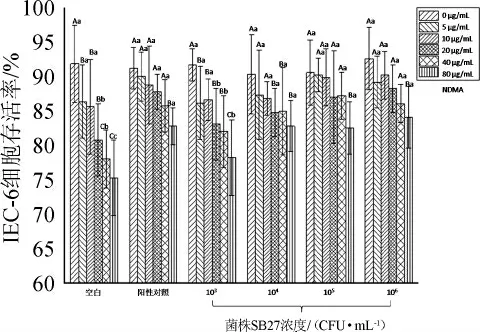
图3 干酪乳杆菌SB27降低NDMA对IEC-6细胞毒性作用Fig.3 Effect of Lactobacillus casei SB27 on reducing the toxic of NDMA to IEC-6 cells
有研究表明,NDMA会导致肝脏、胃肠道黏膜的损伤或形成肿瘤,100 mg的NDMA会导致人体腹泻、呕吐、肝毒性或死亡[20]。乳酸菌作为功能性益生菌,可通过生物的方式对抗N-亚硝胺的遗传毒性,抑制肠道黏膜的DNA损伤,如乳杆菌和双歧杆菌可剂量依赖性地保护人体肠道细胞系(HT-29或Caco-2)的遗传毒性作用[21]。本研究结果表明,干酪乳杆菌SB27(103~106CFU/mL)可降低NDMA对大鼠肠道黏膜细胞IEC-6的毒性作用,可抑制NDMA诱导IEC-6细胞的损伤,分析原因可能是干酪乳杆菌SB27降低了NDMA的含量。乳酸菌发挥降低NDMA毒性的作用可能是通过吸收或降解有毒化学物的含量[2],减少有毒化学物合成前体物或是乳酸菌抗氧化功能发挥的作用[22-23]。
2.3.2 干酪乳杆菌SB27降低NDEA毒性的作用
由图4可知,当干酪乳杆菌SB27添加剂量为104、105和106CFU/mL时,NDEA剂量为40~80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),而NDEA剂量为0~20 μg/mL时的IEC-6细胞存活率与空白对照组差异不显著(P>0.05),但以上各组均与阳性对照组差异不显著(P>0.05)。当干酪乳杆菌SB27添加剂量为103CFU/mL时,NDEA剂量为80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NDEA剂量为0~40 μg/mL时的细胞存活率与空白对照组差异不显著(P>0.05)。

图4 干酪乳杆菌SB27降低NDEA对IEC-6细胞毒性的作用Fig.4 Effect of Lactobacillus casei SB27 on reducing the toxic of NDEA to IEC-6 cells
有研究表明,乳酸菌可降低泡菜中亚硝酸盐的含量,且在MRS培养基中也有相似的研究结果[24]。戊糖乳杆菌(Lactobacillus pentosus)R3、发酵乳杆菌(Lactobacillus fermentum)R6、戊糖片球菌(Pediococcus pentosaceus)P1等五株乳酸菌在MRS培养液中可显著降低NDEA的浓度[11]。NDEA属于二级A类环境致癌物,会导致组织细胞活性氧的堆积,从而导致细胞的氧化应激和毒性损伤[25]。由于L.pentosus可降低N-亚硝胺的含量[26],其可作为潜在的提高肉制品质量安全的一种发酵剂。本研究结果也说明,随着NDEA添加剂量的增加,其对大鼠肠道黏膜细胞IEC-6的毒性损伤作用增强,而高剂量的干酪乳杆菌SB27(104~106CFU/mL)可显著抑制NDEA对IEC-6细胞的毒性损伤。
2.3.3 干酪乳杆菌SB27降低NPYR毒性的作用
由图5可知,当干酪乳杆菌SB27添加量为104、105、106CFU/mL时,NPYR剂量为40~80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NPYR剂量为0~20 μg/mL时的IEC-6细胞存活率与空白对照组差异不显著(P>0.05),以上各组与阳性对照组差异均不显著(P>0.05)。当干酪乳杆菌SB27添加剂量为103CFU/mL时,NPYR剂量为80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NPYR剂量为0~40 μg/mL时的IEC-6细胞存活率与空白对照组差异均不显著(P>0.05)。结果显示,干酪乳杆菌SB27具有降低NPYR毒性的作用,减小了NPYR对IEC-6细胞存活的抑制作用。

图5 干酪乳杆菌SB27降低NPYR对IEC-6细胞毒性的作用Fig.5 Effect of Lactobacillus casei SB27 on reducing the toxic of NPYR to IEC-6 cells
2.3.4 干酪乳杆菌SB27降低NPIP毒性的作用
由图6可知,当干酪乳杆菌SB27添加量为103、104、105CFU/mL时,NPIP剂量为80 μg/mL时的IEC-6细胞存活率显著高于空白对照组(P<0.05),NPIP剂量为0~40 μg/mL时的IEC-6细胞存活率与空白对照组差异不显著(P>0.05),以上各组与阳性对照组差异均不显著(P>0.05)。当干酪乳杆菌SB27添加量为106CFU/mL时,NPIP各剂量组(0~80 μg/mL)的IEC-6细胞存活率与空白对照组差异不显著(P>0.05)。

图6 干酪乳杆菌SB27降低NPIP对IEC-6细胞毒性的作用Fig.6 Effect of Lactobacillus casei SB27 on reducing the toxic of NPIP to IEC-6 cells
由于NPIP是食品中普遍存在的致癌物[27],而乳酸菌可降低食品中NPIP的含量,如弯曲乳杆菌(Lactobacillus curvatus)可显著降低哈尔滨红肠中NPIP的含量达14.6%[28]。本研究结果显示,干酪乳杆菌SB27可在肠道内发挥亚硝化阻断的作用,抑制NPIP诱发肠道黏膜细胞的损伤。
3 结论
本研究分析了四类N-亚硝胺(NDMA、NDEA、NPYR和NPIP)对干酪乳杆菌SB27生长影响及干酪乳杆菌SB27降低N-亚硝胺对大鼠肠道黏膜细胞IEC-6毒性的作用。结果显示,N-亚硝胺在MRS培养基中对干酪乳杆菌SB27的生长无显著影响(P>0.05),干酪乳杆菌SB27可降低N-亚硝胺对大鼠肠道黏膜细胞IEC-6的毒性作用。
