2种抗性淀粉的结构特征及体外消化性研究
2022-06-22林顺顺李梦琴赵龙珂张乐乐
程 冰, 林顺顺,2, 李梦琴,2, 王 筝, 赵龙珂, 张乐乐
(河南农业大学食品科学技术学院1,郑州 450002)(农业部大宗粮食加工重点实验室2,郑州 450002)
抗性淀粉(Resistant starch,RS)于1985年由英国科学家Englyst发现并提出[1],于1992年被世界粮农组织正式定义为不被健康人体小肠所吸收的淀粉及其降解物的总称。抗性淀粉普遍存在于天然食品原料中,如马铃薯、玉米、大米等,具有饱腹感强、消化率低、血糖生成指数低等特点,受到人们的广泛关注[2]。抗性淀粉特殊的结构性质主要与直链淀粉和支链淀粉相互作用以及两者在抗性淀粉中的占比有关。因此,呈现不同的颗粒形状(包括块状、层状、沟壑状、孔洞状、网络状/蜂窝状)、不同的晶体结构(由原生淀粉的A型、B型、C型转化为A型、C型、B型、V型或B+V型)和不同的分子结构(分子质量分布范围为104~108g/mol)[3]。目前关于抗性淀粉制备的研究较多,而关于抗性淀粉的结构特征及体外消化性研究尚不深入、系统。抗性淀粉的抗性机理及营养价值往往与其稳定的结构有关系。因此,研究其结构特征及体外消化性有助于评价其生理学价值。抗性淀粉在人体内的消化机理复杂,本文采用傅里叶红外变换(FT-IR)、X-射线衍射(XRD)、差示扫描量热(DSC)等对抗性淀粉的结构特征进行分析,并采用体外模拟抗性淀粉在人体内的消化过程,得到抗性淀粉消化率、消化速率常数等动力学参数,了解其结构特征与体外消化性的关系,旨在为进一步揭示抗性淀粉的抗酶解性及拓宽抗性淀粉在食品加工中应用提供参考。
1 材料与方法
1.1 实验材料
小麦抗性淀粉、马铃薯抗性淀粉;胰蛋白酶(250 U/mg)、糖化酶(10 000 U/g)、直链淀粉标准品、支链淀粉标准品;其他试剂均为分析纯。
1.2 主要仪器与设备
UV-2000紫外可见分光光度计,Bruker D8 X-射线衍射仪,PHS-3C PH计,快速黏度分析仪RVA-4500,HT-9300H型激光粒度分析仪,S-3400MⅡ型扫描电镜,SpecctrumGX傅里叶红外光谱仪。
1.3 方法
1.3.1 直链、支链淀粉含量测定
用双波长分光光度法测定小麦抗性淀粉和马铃薯抗性淀粉样品直链、支链淀粉含量及总淀粉含量[4,5]。直链淀粉测定波长λ1=632 nm,参比波长λ2=463 nm,支链淀粉测定波长λ3=560 nm,参比波长λ4=735 nm,根据标准曲线测定抗性淀粉中直链和支链淀粉的含量。
准确吸取0、0.3、0.6、0.9、1.2、1.5、1.8 mL的1 mg/mL直链淀粉标准溶液置于50 mL容量瓶中,加入20~30 mL蒸馏水,以0.1 mol/LHCl溶液调节pH至3.5,加入0.5 mL碘试剂,并用蒸馏水定容50 mL,静置30 min,即得0、6、12、18、24、30、36μg/mL的标准溶液在λ1、λ2两波长下分别测定Aλ1、Aλ2得ΔA直=Aλ1-Aλ2。以直链淀粉浓度(mg/mL)为横坐标,ΔA直为纵坐标,回归方程为y=0.012 4x-0.001 8,R2为0.999 6。
准确吸取0、2.0、2.5、3.0、3.5、4.0、4.5 mL的1 mg/mL支链淀粉标准溶液置于50 mL容量瓶中,加入20~30 mL蒸馏水,以0.1 mol/L HCl溶液调节pH至3.5,加入0.5 mL碘试剂,并用蒸馏水定容50 mL,静置30 min,即得0、40、50、60、70、80、90 μg/mL的标准溶液在λ3、λ4两波长下分别测定Aλ3、Aλ4得ΔA支=Aλ3-Aλ4。以支链淀粉浓度(mg/mL)为横坐标,ΔA支为纵坐标,回归方程为y=0.002 1x+0.002 3,R2为0.999 9。
样品测定:直链淀粉、支链淀粉含量测定,称取0.1 g处理过的抗性淀粉样品到50 mL容量瓶中,加入0.5 mol/L氢氧化钾溶液10 mL,在(80±1) ℃水浴10 min,摇均静置。取样品液2.5 mL,调节pH值为3.5,加入0.5 mL碘试剂,50 mL定容静置。分别测定波长为λ1、λ2、λ3、λ4下的吸收值Aλ1、Aλ2、Aλ3、Aλ4,得到ΔA直、ΔA支。分别在直链淀粉、支链淀粉标准曲线中查询,可计算出样品中直链淀粉、支链淀粉含量。
1.3.2 淀粉的碘吸收特性
称取淀粉样品(20±0.2) mg加入0.5 mL无水乙醇润湿样品,加入2 mol/L的KOH溶液1 mL,使样品充分溶解。加入10 mL蒸馏水,用0.1 mol/L的HCl溶液调节pH至6.5,定容至50 mL。准确移取10 mL上述溶液,加入80 mL蒸馏水和2 mL碘试剂,定容至100 mL,立即混匀。用紫外分光光度计在波长450~800 nm范围内扫描。记录最大吸收波长[6]。
1.3.3 粒径的测定
采用激光粒度分析仪测定样品粒径。取一定量抗性淀粉样品加入激光粒度分析仪中。测试条件:超声时间30 s;搅拌速度30;循环速度30;分散体系为蒸馏水。
1.3.4 扫描电镜分析
小麦抗性淀粉和马铃薯抗性淀粉颗粒结果通过扫描电镜来分析,将粉末将特制双面胶固定在样品台上,然后进行30 min的喷金。扫描条件:电压100 kV,加速电压15 kV。通过放大不同的倍数来观察样品表面颗粒形态。
1.3.5 红外光谱的分析
将抗性淀粉样品和溴化钾置于105 ℃烘干后,样品和溴化钾按1∶100的比例加入玛瑙研钵中研好后,置于压片机中压片,采用傅里叶变换红外光谱仪测定,光谱范围:400~4 000 cm-1,分辨率为4 cm-1,扫描范围400~4 000 cm-1,扫描次数为32次。
1.3.6 X-射线衍射
取小麦抗性淀粉和马铃薯抗性淀粉样品粉末进行X-射线衍射检测,实验参数:特征射线CuKa,最大电压60 kV,最大电流60 mA,扫描范围(5°~60°),扫描速度为2(°)/min。
1.3.7 抗性淀粉的热力学性能的分析
采用差示扫描量热仪测定。测试条件:扫描温度30~230 ℃,扫描速率10 ℃/min。以空坩埚为参比,载气为氮气,流速30 mL/min。
1.3.8 抗性淀粉的体外消化性分析
绘制葡萄糖标准曲线。葡萄糖标准溶液:称取103 ℃干燥至恒重的100 mg葡萄糖,用蒸馏水溶解,并定容至1 000 mL。DNS显色剂的配制:将1.575 g 3,5-二硝基水杨酸和65.5 mL 2 mol/L NaOH溶液溶解于125 mL含有46.25 g酒石酸钾钠的热溶液中,搅拌均匀,再加入1.25 g结晶酚和1.25 g亚硫酸钠,冷却后用蒸馏水定容至250 mL,摇匀后转移至棕色瓶中,放置1周后备用。取7支25 mL的具塞试管,准确吸取0、0.2、0.4、0.6、0.8、1.0、1.2 mL的葡萄糖溶液,再分别加入2、1.8、1.6、1.4、1.2、1.0、0.8 mL蒸馏水,每支具塞试管加入20~30 mL蒸馏水,再分别加入1.5 mL的DNS溶液,将各试管摇匀后,沸水浴5 min,取出后迅速流水冷却,以蒸馏水定容至25 mL,在540 nm下,以蒸馏水调零,测量1~7号管的吸光度,以吸光度为横坐标,以葡萄糖含量为纵坐标,绘制标准曲线[7]。其方程为y=0.018 6+0.040 3,R2=0.996 3。
体外消化性能测定:称取样品0.5 g于离心管中,加入20 mL的乙酸钠缓冲溶液(0.2 mol/L,pH=5.2),待缓冲溶液与样品充分混合后,再加入10 mL现配的胰蛋白酶(110 U/mL)和40 μL糖化酶(1 000 U/mL),然后将装有样品的离心管放入37 ℃的恒温震荡中,分别于0、20、30、60、90、120、150、180、240 min时取一定量上清液于试管中,用DNS法测定其还原糖量[8]。
参考Mardianaahamad等[9]及Goi等[10]方法计算快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)质量分数。
式中:G0为淀粉酶水解0 min后产生的葡萄糖含量/mg;G20为淀粉酶水解20 min后产生的葡萄糖含量/mg;G120为淀粉酶水解120 min后产生的葡萄糖含量/mg;Ts为样品中的总淀粉含量/mg。
抗性淀粉消化速率:


样品水解曲线下的面积:AUC=C∞(tf-t0)-(C∞/k)[1-e-k(tf-t0)]
式中:C∞为平衡浓度(t180);tf为最终时间(90 min);t0为初始时间(0 min);k为水解平衡常数。
通过测定淀粉在90 min时水解指数(HI),代入其线性回归方程得到食品的血糖指数(GI),GI=39.71+0.549HI90(R=0.894)。
1.4 数据统计分析方法
采用SPSS23软件进行单因素方差分析,所得实验数据以三次重复实验的平均值±标准偏差表示,差异显著性分析使用Least significant difference (LSD) 检验法。并且本实验的显著性为:P<0.05显著,P<0.01极显著。制图使用Origin8.0和Excel软件。
2 结果与分析
2.1 样品中直链淀粉、支链淀粉和总淀粉含量
采用双波长分光光度法测定抗性淀粉中直链淀粉、支链淀粉含量,结果见表1,马铃薯抗性淀粉的直链淀粉含量大于小麦抗性淀粉,支链淀粉比直链淀粉含量高。黄欢等[11]研究发现支链淀粉因含较多支链而易受淀粉酶作用,直链淀粉则对淀粉酶有一定抵抗性,结晶区主要有直链淀粉构成,抗性淀粉的抗酶解作用来源于直链淀粉的结晶。由支直比可知与小麦抗性淀粉相比,两者支链淀粉含量相差较小,马铃薯抗性淀粉的直链淀粉含量相对较高,直链淀粉的含量与抗性淀粉体外消化率显著负相关,即直链淀粉越高,抗性淀粉的抗酶解性越强。这与史韬琦等[12]实验结果一致。所以抗酶解性比小麦抗性淀粉的大。

表1 样品中直链淀粉、支链淀粉和总淀粉的质量分数
2.2 抗性淀粉碘吸收曲线的分析
图1可知,小麦抗性淀粉和马铃薯抗性淀粉-碘复合物的最大吸收峰分别为595、605 nm,由直链淀粉处向支链淀粉处偏移,小麦抗性淀粉具有更强的碘吸收能力。另外,马铃薯抗性淀粉-碘络合物的吸收峰比小麦抗性淀粉的窄,说明马铃薯抗性淀粉的分子质量分布比较集中[13]。
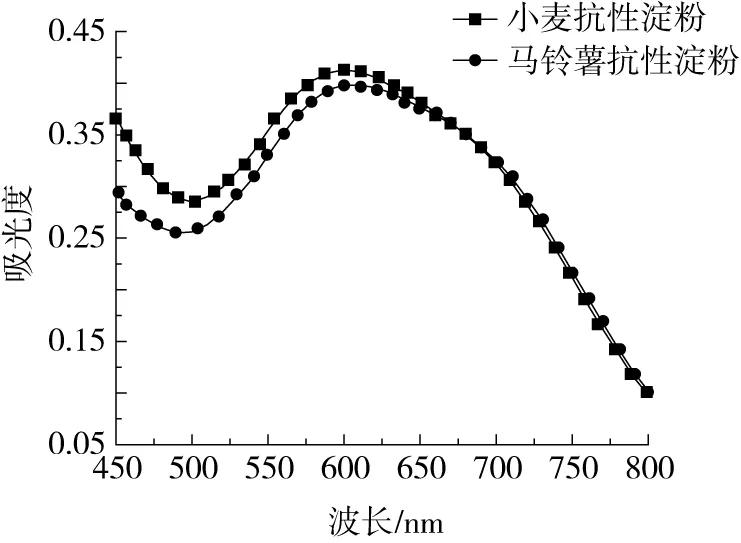
图1 抗性淀粉的碘吸收曲线
2.3 抗性淀粉的结晶性质分析
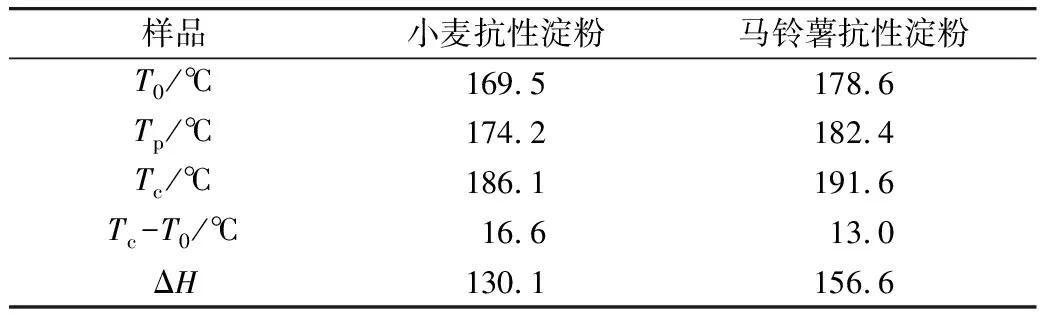
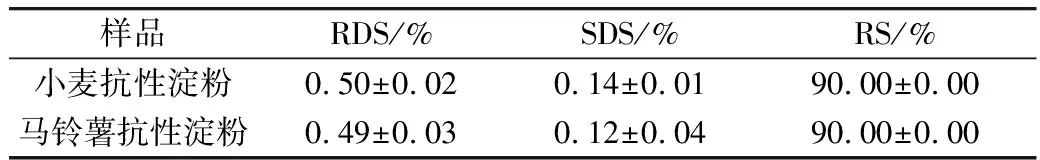
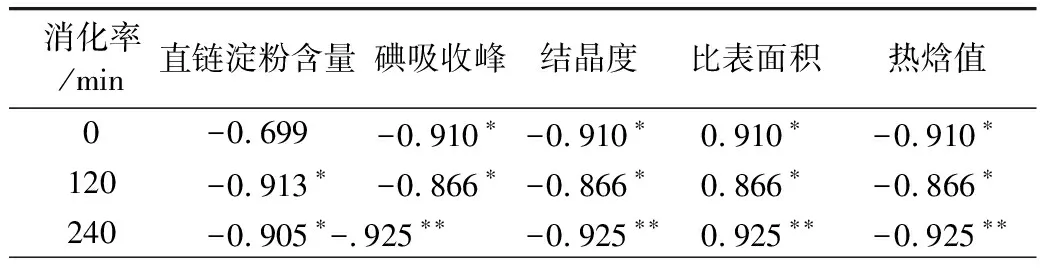
不同晶型的淀粉抗酶解性不同:A型 注:a马铃薯抗性淀粉,b 小麦抗性淀粉。图2 X-射线衍射图谱 表2 抗性淀粉的峰值强度 淀粉颗粒粒径的大小与粒径的分布,影响酶解时酶与底物接触的表面积,进而影响其抗消化特性[17,18]。从表3中可以看出,小麦抗性淀粉和马铃薯抗性淀粉的颗粒大小相差很小,推测它们具有相同的抗性机理。D3、D10、D50、D90、D97分别代表颗粒累积分布为3%、10%、50%、90%、97%的粒径,D3、D10、D50、D90、D97值增大代表大颗粒数目的增加。与小麦抗性淀粉相比,马铃薯抗性淀粉的D3、D90、D97较大,粒度范围减少,说明马铃薯抗性淀粉粒径大的颗粒占的比例大,通常抗性淀粉粒径越大、比表面积越小、聚合度越高越有利于淀粉颗粒抵抗淀粉酶的侵蚀,导致淀粉消化缓慢[19]。马铃薯抗性淀粉具有较高的聚合度,由相关性分析可知比表面积与抗性淀粉的消化性显著正相关(P<0.05)。所以马铃薯抗性淀粉具有较高的抵抗淀粉酶侵蚀的能力。这与Wang等[20]报道一致。 表3 小麦抗性淀粉和马铃薯抗性淀粉的粒径 如图3所示,小麦抗性淀粉原淀粉颗粒完整,表面光滑,整体呈不规则的椭圆形。小麦抗性淀粉分子颗粒形貌大致与原淀粉分子相似,颗粒表面覆着许多细小颗粒,可能是因为提取过程中破坏了颗粒结构,一些较小淀粉颗粒被破坏后破碎,附在淀粉颗粒表面。其结构具有较高密度和较独特的结晶结构,且具有完整的颗粒性使其具有较强的抗消化性[21]。马铃薯抗性淀粉原淀粉颗粒完整,表面光滑,整体呈不规则的椭圆形,马铃薯抗性淀粉分子变成为不规则多面体,分子表面粗糙,有凹陷,且有少量的层状起伏,附有少量小圆形颗粒。可能是提取过程中马铃薯抗性淀粉形成更加稳定的晶体结构,所以比小麦抗性淀粉更耐消化。说明提取出的小麦抗性淀粉颗粒与原淀粉无差异,而马铃薯抗性淀粉与原淀粉差异显著,可能是提取过程中马铃薯抗性淀粉原淀粉颗粒遭到破坏,表面结构变得比较疏松。 图3 淀粉颗粒扫描电子显微镜图 淀粉颗粒以半晶态形式存在,由直链淀粉和支链淀粉组成了结晶区和无定形区。其中直链淀粉和支链淀粉中的短链部分形成了双螺旋结构,又称为短程有序结构;这些双螺旋分子链通过分子间力以一定的空间点阵存在于淀粉颗粒的某些区域形成不同的多晶形(即晶体),又称为长程有序结构[22]。两种抗性淀粉的红外光谱图如图4所示,其数据分析结果见表4,两种抗性淀粉相比,主要特征峰基本重合,说明没有基团差异。汪颖[23]研究发现淀粉在800~1 200 cm-1的波谱属淀粉的特征波谱段,反映了淀粉在C—C、C—OH和C—H的伸缩振动以及淀粉聚合物的构象及水合过程。由图7可以看出,两种抗淀粉在800~1 200 cm-1的波谱无显著差异,在996~1 000 cm-1范围内的吸收峰主要是由于C—OH弯曲振动引起的,对应于淀粉大分子羟基间所形成的氢键结构。总而言之,两种抗性淀粉的化学结构相似,没有基团差异。 图4 抗性淀粉的红外图谱 表4 抗性淀粉的特征吸收峰 淀粉受热过程中的焓变(ΔH)与淀粉双螺旋解构有关,可以反映结晶形成的质量和程度,淀粉颗粒中T0、Tp、Tc表示淀粉颗粒中的双螺旋结构和结晶体,T0、Tp、Tc越高说明晶体结构越完整,破坏时所需的能量越大。糊化温度范围(Tc~T0)表示颗粒内淀粉微晶的均匀程度[24]。两种抗性淀粉的热性质见表5,可以看出相比于马铃薯抗性淀粉,小麦抗性淀粉的(Tc~T0)更大,表明小麦抗性淀粉的晶体质量更高,更为均匀。马铃薯抗性淀粉的T0、Tp、Tc、ΔH均大于小麦抗性淀粉,所以马铃薯抗性淀粉具有更致密的晶体结构,热稳定性更高,因此需要更多的热量使其发生非晶化相变,故其相变吸热峰吸热焓更大[25]。黄强等[26]发现淀粉热力学性质对消化性有重要影响,在常温常压加工条件下,具有较低糊化温度的普通玉米淀粉和蜡质玉米淀粉更易被消化,且具有慢消化特性;而具有较高糊化温度的高链玉米淀粉不易被消化,具有抗消化性。所以马铃薯抗性淀粉具有较高的糊化温度、较完整的双螺旋结构及较致密的结晶结构,具有较强的抗消化性。 表5 抗性淀粉的热力学参数 2.8.1 样品中快消化淀粉、慢消化淀粉和抗性淀粉的含量 餐后血糖的应答很大程度上取决于RDS的含量,RS和SDS含量控制低血糖控制指数(GI)的升高,RS的含量升高代表抗消化性能增加[27]。方桂红等[28]研究发现抗性淀粉位于淀粉的内部结构,是排列紧密的双螺旋结构,快消化淀粉(RDS)位于淀粉重结晶的外部区域,为无定形结构;慢消化淀粉(SDS)介于两者之间。表6中两种抗性淀粉的含量达到90%,两者的RDS和SDS差别不大,由于马铃薯抗性淀粉具有更坚实的抗酶解的结构晶体,热稳定性较高,水解耐受性较强,因而更耐消化。 表6 小麦抗性淀粉和马铃薯抗性淀粉的RDS、SDS和RS的质量分数 2.8.2 抗性淀粉的消化特性 如图5所示,在2 h内,两种抗性淀粉水解速度较快;葡萄糖释放量快速增加。随着消化时间的延长,大的淀粉分子被水解,与酶结合的位点减少,所以2 h后水解缓慢,释放的还原糖量较少。在相同消化时间内,消化率越大,表示越容易消化[29-31]。经相同消化时间后,小麦抗性淀粉消化率的量明显较大,说明马铃薯抗性淀粉更耐消化。 图5 抗性淀粉的水解预测动力学模型及葡萄糖释量 表7 不同抗性淀粉动力学方程特征参数、水解指数、血糖指数 通过Origin8.0软件拟合一级动力学模型,得到动力学公式,小麦抗性淀粉水解率动力学公式为:Ct=7.92×(1-e-0.023t),R2=0.919 2;马铃薯抗性淀粉水解率动力学公式为Ct=7.21×(1-e-0.021t),R2=0.952 0。马铃薯抗性淀粉水解指数和血糖指数平衡浓度较低,力学平衡浓度C∞和K都低于小麦抗性淀粉,这是由于马铃薯抗性淀粉中直链淀粉的比例较高,容易发生老化现象。李涛等[32]研究报告动力学常数K大小反映淀粉体外消化速度快慢。小麦抗性淀粉的消化动力学常数大于马铃薯抗性淀粉,表明小麦抗性淀粉体外消化达到平衡浓度的速度比马铃薯抗性淀粉快,这可能是由于马铃薯抗性淀粉在淀粉酶作用下,淀粉分子链较短,分子聚合度较小,则分子容易聚集在一起而很难被酶作用,因此马铃薯抗性淀粉大较难被酶解,而表现出较小的水解指数。这与杨玥熹等[33]研究结果一致。计算得到小麦抗性淀粉和马铃薯抗性淀粉的血糖指数分别为40.62和40.50,属于低血糖指数淀粉(GI≤55),故在食品中加入抗性淀粉可有效降低食品的血糖指数。 由相关性分析结果可以看出,0 min的消化率与碘吸收峰、结晶度、热焓值分别之间显著负相关,与比表面积显著正相关;120 min的消化率与直链淀粉含量、碘吸收峰、结晶度、热焓值分别之间显著负相关,与比表面积显著正相关;240 min的消化率与直链淀粉含量之间显著负相关,碘吸收峰、结晶度、热焓值分别之间极显著负相关,与比表面积极显著正相关。说明直链淀粉、碘吸收峰、结晶度、热焓值越大,比表面积越小,抗性淀粉越耐消化,消化率越低。 表8 抗性淀粉结构特征与消化性间相关性 比较小麦、马铃薯抗性淀粉的结构特征及体外消化性,与小麦抗性淀粉相比,马铃薯抗性淀粉直链淀粉含量更高,不同抗性淀粉的颗粒形貌虽有所差异,但晶型结构及官能团和化学键组成相同,马铃薯抗性淀粉有更加致密的晶体结构,具有较强的酶抗性。马铃薯抗性淀粉的T0、Tp、Tc、ΔH均大于小麦抗性淀粉,说明马铃薯抗性淀粉具有较完整的双螺旋结构和较致密的结晶结构。经体外消化实验后,马铃薯抗性淀粉具有更强的抗消化能力。抗性淀粉体外消化率与其直链淀粉含量、碘吸收峰负相关、与其结晶度、热焓值显著负相关,抗性淀粉体外消化率与比表面积正相关。两种抗性淀粉血糖指数(GI)均小于55,属于低GI食品,马铃薯抗性淀粉具有致密的结构、热稳定性好等优点,抗消化性能更好。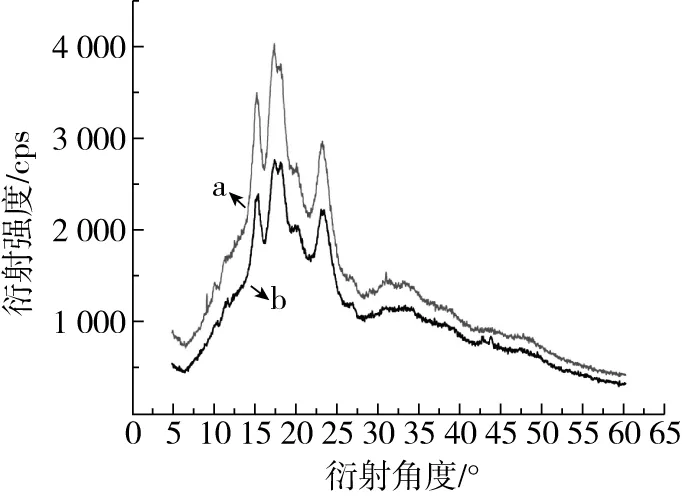

2.4 粒径的测定

2.5 扫描电镜分析

2.6 红外光谱的分析(FTIR)
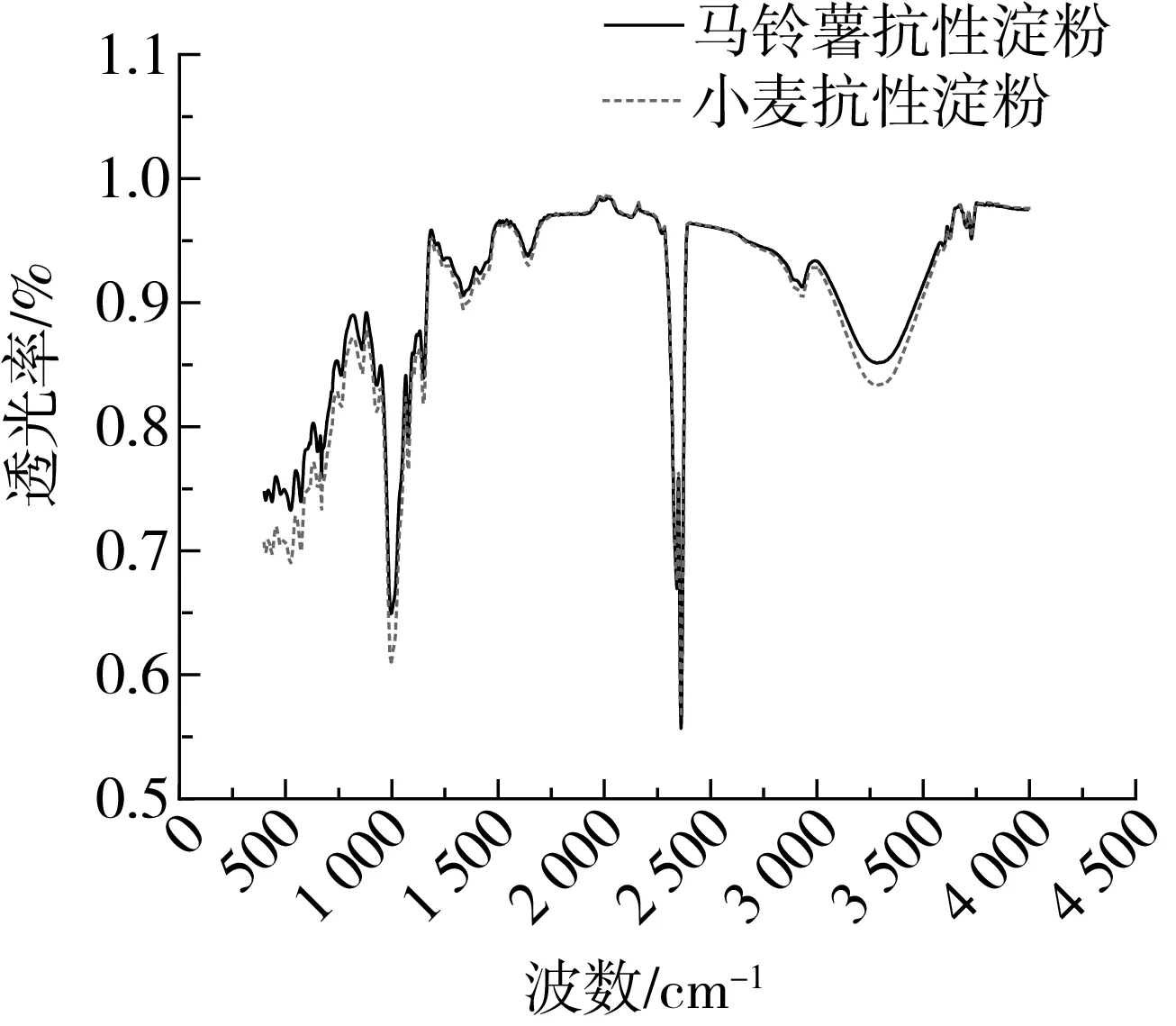
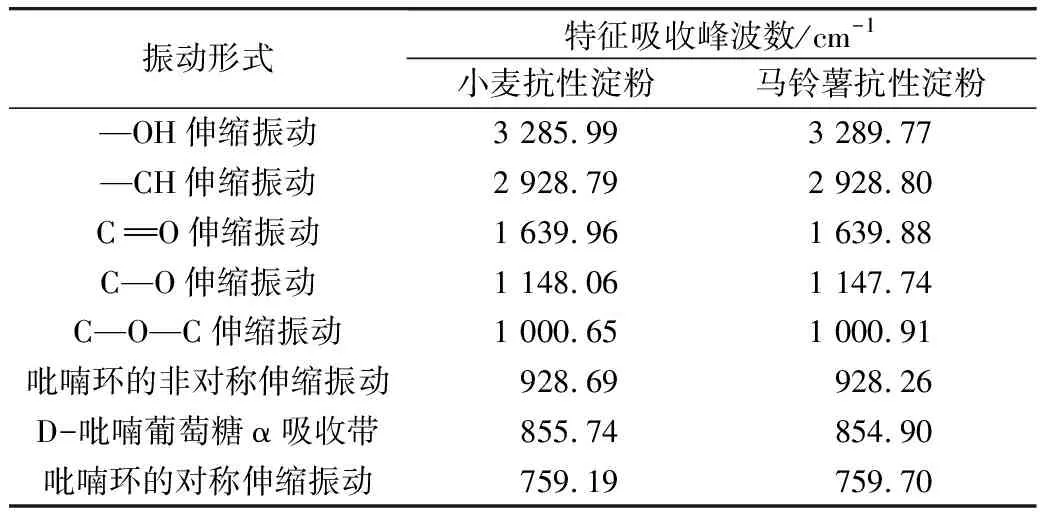
2.7 抗性淀粉的热力学性质分析
2.8 抗性淀粉的体外消化性


2.9 相关性分析
3 结论
