热预适应对大鼠肌肉组织中m6A修饰的影响
2022-06-22张静婷
张静婷
(河南师范大学 体育学院,河南 新乡 453007)
m6A修饰是指由甲基化转移酶复合体在转录后识别特定RNA序列,在腺苷酸第6位N原子添加1个甲基团形成N6-甲基腺嘌呤的甲基化修饰过程[1].m6A修饰在mRNA中的出现的频率最高,哺乳动物中m6A约占所有腺苷核苷酸的0.1~0.4%,每个mRNA分子中至少有1个位点,少数mRNA可能超过20个[2].通常m6A修饰发生在RRACH序列(R=A或G,H=A,C或U)上,其修饰位点主要聚集在终止密码子和3′非翻译区,能够调节mRNA转录、剪接、翻译和降解,参与体内多种生理和病理过程[3].甲基化转移酶包括METTL3/14、WTAP和KIAA1429等,其作用是催化腺苷酸发生m6A修饰,去甲基化酶包括FTO和ALKHB5等,其作用是消除RNA上腺苷酸上的甲基化修饰,使m6A修饰能够双向调节.
热预适应是指运动员重复暴露在自然或人工高温环境中产生一系列提高人体耐受能力和缓解高温损伤的可逆适应性反应.在生理层面,热预适应可提高下丘脑体温调节中枢的敏感性,下调温度调节点,加速出汗、增加体表血流量、增加机体应对高温高湿环境的抵抗力[4-5];在细胞和基因调控层面,热预适应的发生过程涉及多种热耐受和细胞保护反应,如抗炎症反应、抗凋亡和抗氧化反应增强、缺血性耐受性增强等,涉及的分子调控机制有热应激蛋白(HSP)信号通路、活性氧(ROS)清除基因、细胞凋亡基因Bcl-xl和Bad、炎性基因肿瘤坏死因子TNF-α和白细胞介素IL-1、缺氧诱导因子HIF等的表达调控[6-7].研究证明甲基化在热应激、炎症发生、肌肉发育和再生、活性氧代谢和缺氧应激[8-10]等多种热预适应相关通路中发挥重要作用.本研究选用健康大鼠作为研究对象,60 ℃高温重复刺激实验组至肛温42 ℃构建热预适应模型,同时利用实时定量PCR、蛋白印迹和液相色谱-质谱(LC-MS)分析检测m6A关键酶和m6A修饰水平在热预适应过程中的变化趋势.
1 材料与方法
1.1 热预适应大鼠模型建立
从北京维通利华实验动物公司选购成年雄性健康SD大鼠24只,体质量范围240~260 g.实验室温度为18~24 ℃,空气相对湿度45%~55%,自由饮水、饮食、运动和休息.预热组大鼠每100 g体质量注射0.6 mL质量分数为6%水合氯醛,腹腔注射麻醉,放置于60 ℃恒温水浴箱中,保证大鼠自由呼吸,等肛温升至42 ℃后,维持肛温42 ℃ 15 min,再置于常温环境下恢复体温,1 h后,升高体温42 ℃ 15 min,反复3次,连续5 d.对照组不进行任何处理.本实验中的动物饲养和处理程序均经学校动物伦理审查委员会审核,实验方案符合首都师范大学实验动物管理规程.
1.2 RNA与蛋白提取
使用总RNA分离试剂盒(Tiangen,北京)从100 mg组织样品中提取骨骼肌总RNA.总RNA的质量和浓度分别通过常规琼脂糖凝胶分析和分光光度法(ND-2000,Thermo Scientific)确定.
总蛋白质提取使用RIPA裂解液(碧云天,中国)然后用BCA法试剂盒测定蛋白质浓度.25 μg变性后的蛋白质样品在质量分数为12%SDS(十二烷基硫酸钠)-聚丙烯酰胺凝胶上进行分离并转移到聚偏二氟乙烯膜膜(PVDF)上.将PVDF膜置于质量分数为5%的脱脂奶粉(Amresco,美国)溶液中并在摇床上室温孵育2 h.然后将PVDF膜与FTO蛋白抗体4 ℃孵育过夜.用含有体积分数0.5%吐温-20(TBST)的Tris 缓冲液(TBS)洗涤4次,每次10 min.再将PVDF膜与二抗在室温孵育1.5 h,之后用TBST洗涤4次,每次8 min.使用SuperSignal West Pico Chemiluminescent Substrate试剂盒(Thermo,美国)和Tanon2500全自动数码凝胶成像系统(天能,上海)曝光蛋白免疫印迹图像.
1.3 实时定量PCR(RT-qPCR)
使用一步法cDNA合成试剂盒(Takara)将2 μg miRNA反转录.包括10 μL反应缓冲液,2 μL质量分数为0.1%BSA,2 μL miRNAPrimeScript®RT酶混合物,2 μg总RNA和不含RNA的ddH2O体积为20 μL.程序为37 ℃,60 min,85 ℃,5 s.cDNA产物储存在-20 ℃.RT-qPCR(ABI7500)反应体系在冰上制备,包含10 μL SYBR Premix Ex Taq,0.8 μL PCR正向引物(10 μmol/L),0.8 μL反向引物(10 μmol/L),0.4 μL ROX参考染料,2 μL cDNA(100 ng/L)和ddH2O,终体积为20 μL.将反应混合物在96孔板使用2步法进行反应:95 ℃预变性30 s,然后在95 ℃变性5 s,60 ℃退火30 s,40个循环.使用2-△△Ct方法确定对照组和热预适应组大鼠之间的mRNA表达差异,所有反应均重复3次,基因ALKBH5(NM_001191643.1),FTO(NM_001039713.1),GAPDH(NM_017008.4),METTL14(NM_001106470.1),METTL3(NM_001024794.1),KIAA1429(XM_032905901.1)定量引物参考PrimerBank数据库.
1.4 液相色谱-质谱(LC-MS)
使用RNeasy试剂盒(QIAGEN,德国)提取细胞中总RNA,取1 μg RNA加入到含有核酸酶的40 μL缓冲液(10 mmol/L TrisHCl pH 7.0,100 mmol/L NaCl,2.5 mmol/L ZnCl2)中,于37 ℃孵育0.5 h,然后加入1 U碱性磷酸酶,在37 ℃下孵育0.5 h.孵育结束,混合溶液用超纯水稀释10倍,取40 μL稀释后样品加入10 μL内标溶液和60 μL甲醇,混匀后进行检测,进样量5 μL.
Shimadzu 20AD液相色谱仪设置:C18色谱柱(3 μm,3.0 mm×100 mm),柱温40 ℃,流动相A为含有体积分数为0.1% FA的超纯水,流动相B为MeOH,采用梯度洗脱,流速为0.5 mL/min,总分析时间为4 min.质谱系统为美国AB SCIEX QTRAP 3200串联质谱仪,配有电喷雾离子源ESI,电离方式为ESI+.离子源温度550 ℃,电喷雾电压5 000 V,扫描方式为多反应监测(MRM)模式.RNA中发生m6A修饰的水平为Cm6A/(CA+Cm6A).
1.5 数据分析统计
定量数据来源于3次独立实验,数据采用均值±标准误.使用SPSS 18.0软件进行分析统计,多组数据通过单因素方差(Turkey检验)分析,2组数据采用独立样本T检验进行统计,P<0.05为有统计学意义.
2 结 果
2.1 甲基转移酶基因的转录水平检测
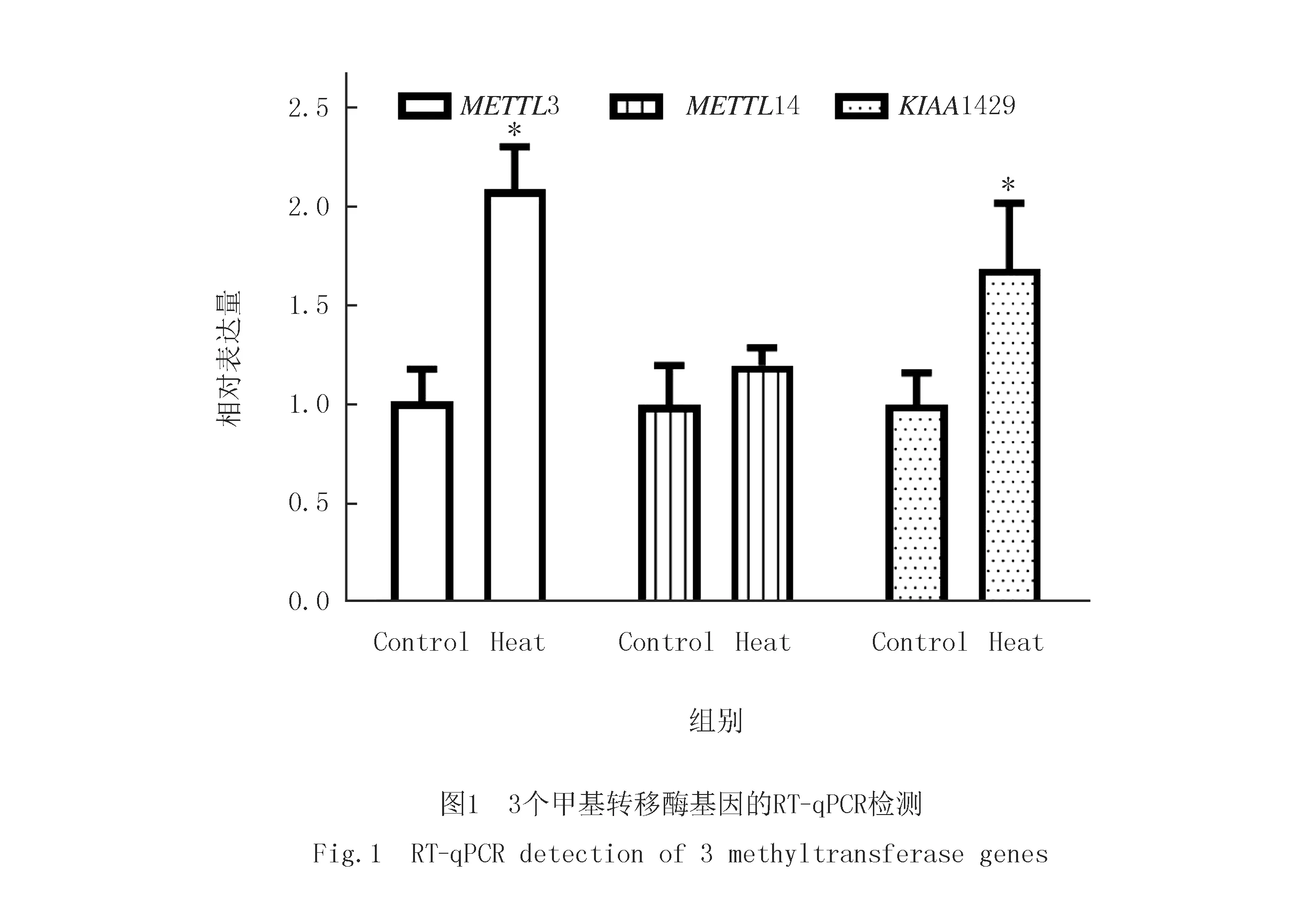
单因素方差分析显示3种酶在热预适应组的转录表达均有升高,其中METTL3上升2倍(P<0.05),KIAA1429上升1.5倍(P<0.05),METTL14有稍微上升(P>0.05,图1).
2.2 去甲基化酶基因的表达水平检测
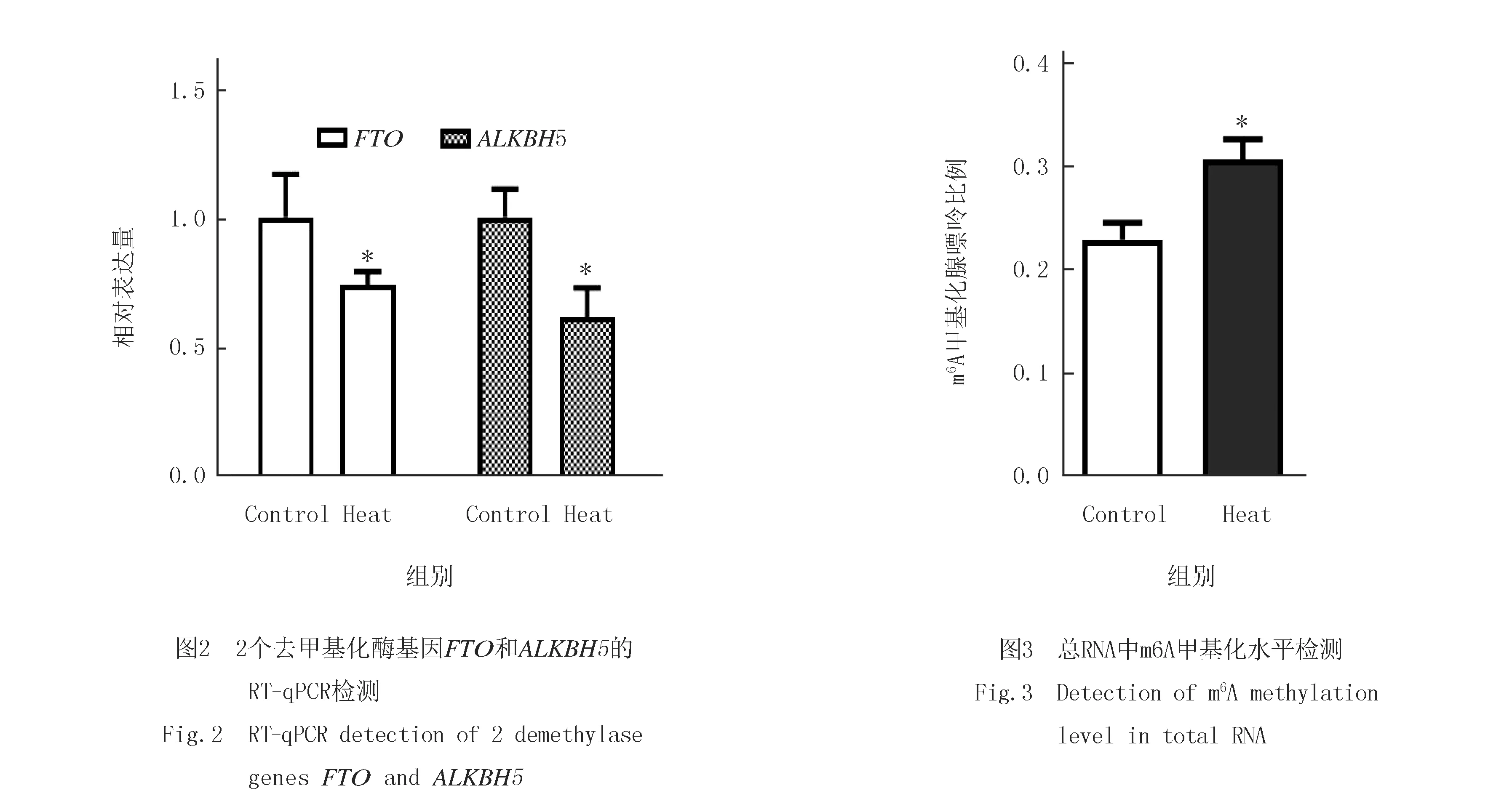
通过RT-qPCR和单因素方差分析发现两个去甲基化酶基因FTO和ALKBH5的转录水平在热预适应组中均有下降30%到40%(P<0.05)(图2).通过蛋白印迹检测发现FTO在热预适应组中的蛋白含量极显著低于对照组.
2.3 m6A甲基化水平检测
利用LC-MS分别检测对照组和热预适应组中总RNA中m6A甲基化的水平,发现热预处理组显著高于对照组(图3).
3 讨 论
3.1 热预适应对甲基转移酶的影响
mRNA的m6A修饰过程由一个多蛋白甲基转移酶复合体催化而成,该复合体由甲基转移酶样蛋白METTL3,METTL14和辅助因子组成,辅助因子包括肾母细胞瘤关蛋白WTAP,病毒样m6A甲基转移酶相关蛋白VIRMA/KIAA1429、含锌指CCCH型蛋白ZC3H13和RNA结合基序蛋白RBM15B等[11].其中,METTL3是甲基转移酶复合体促进m6A修饰形成的催化中心,METTL14是负责将复合物与RNA结合稳定整个复合物的结构,辅助因子WTAP能够将复合物固定于mRNA,VIRMA可将m6A与3′UTR结合,ZC3H13诱导复合物向核内转移,RBM15B能够结合在尿嘧啶富集区,促进甲基化过程[8-9,12].METTL3-METTL14形成的异二聚体复合物能够结合mRNA中大部分m6A位点,小鼠细胞中METTL3基因缺失或METTL14失活会导致poly(A)RNA中总m6A损失超过99%[13].
本实验发现热预适应处理能提高甲基转移酶复合体中METTL3、METTL14和KIAA1429的转录水平,其中以MRTTL3的变化最为显著,这可能与其是复合体的催化中心有关.卢增奎等[14]研究发现热应激处理能显著增加绵羊肝脏中METTL3和METTL14的表达,但是METTL3蛋白在热应激绵羊中上升倍数更高.试验中mRNA的变化有较大差异,这可能与实验处理的程度和时间、物种和采样组织存在差异有关.试验中观察到m6A甲基化修饰水平的上升,通过siRNA抑制METTL3表达能降低m6A水平,并影响其后期的移植能力[15].从METTL3条件敲除鼠模型中分离成肌干细胞,发现干细胞增殖和损伤后肌肉再生收到严重影响,而在METTL3敲入鼠中模型能促进增殖和损伤后的修复,进一步的研究发现METTL3通过甲基化修饰在翻译水平调节Notch信号通路参与这一过程[15].在人肝癌细胞系HepG2上的研究发现,41 ℃持续1 h的热休克处理后,METTL3的表达水平下降,而m6A特异性结合蛋白YTHDF2和热休克蛋白HSP70的表达水平上升,大量YTHDF2蛋白由细胞质转移到细胞核中,siRNA-METTL3会上调或下降HSP70,HSP60和HSP27[16-17].说明热预适应可能通过提高m6A甲基化修饰促进肌纤维再生或促进热应激蛋白表达等方式提高机体对热应激的抵抗力.
3.2 热预适应对去甲基转移酶的影响
mRNA的去甲基化过程由去甲基转移酶介导,当去甲基转移酶敲除或者表达水平降低时,转录本的m6A修饰水平升高.由于大部分RNA半衰期很短,m6A修饰被长期认为是不可逆的.m6A去甲基酶的发现改变了这一认知.2011年在人细胞上干扰和超表达FTO以及体外试验发现包含m6A的RNA是FTO的重要底物, m6A修饰是动态可逆的过程,进一步丰富了甲基化调节的分子机制[1].FTO通过N6-羟甲基腺苷(hm6A)和N6-甲酰腺苷(fm6A)中间体将m6A催化成A(腺嘌呤,Adenine),且该反应速度较快[3].2013年人们发现了第2个去甲基转移酶ALKB同源蛋白ALKBH5,为FTO的同系物,都属于Fe(II)和α-酮戊二酸依赖性ALKB加氧酶家族,与FTO一样促进体内和体外的mRNA脱甲基化,但ALKBH5可直接将m6A转化为A,且反应速度比FTO慢[18].本实验首先验证了热预适应能显著下调FTO和ALKBH5的mRNA转录水平,随后利用蛋白印迹显示了FTO在翻译水平的显著下降.FTO转录和翻译水平下降的结果与小鼠胚胎成纤维细胞(MEF)上的结果一致,当MEF细胞遭受1 h,42 ℃的热休克处理后,其mRNA和蛋白在处理后2 h内呈下降趋势,有助于增加5′UTR的甲基化[9].由此可以推测热预适应能够通过降低去甲基转移酶的转录和翻译水平,抑制肌肉中的去甲基转移酶活性.mRNA中m6A修饰是动物中最丰富的RNA修饰,一旦打破这种平衡将会引起严重的生理功能异常.
3.3 热预适应对m6A修饰水平的影响
本实验中发现热预适应可使肌肉中的m6A甲基化修饰水平显著升高,甲基转移酶表达水平上升和去甲基转移酶表达水平下降所产生的结果一致.一般认为m6A可以提高mRNA稳定性,促进细胞翻译出更多的蛋白质,使其正常的增殖、分化、发挥功能和抵抗应激,但m6A异常可能伴随癌症的发生.在热预适应过程中,细胞受到轻度热刺激的影响,细胞代谢增强,热应激响应基因和信号通路被激活,多种关键基因开始转录和翻译,m6A能通过提高mRNA稳定性和促进mRNA出核转移进而促进基因表达谱发生转变.
目前有多种方法检测m6A修饰水平,如2D-TLC,Dot-blot法,检测特定基因位点m6A水平的SCARLET法以及在全转录组中定位m6A位置的MeRIP-Seq法等[14].这些方法中有的需要放射性标记,有的无法检测RNA中所有位点,或者需要非特异性抗体以及检测灵敏度不理想等.综合比较后,本实验选择并改良了可以定量检测RNA中所有m6A位点的LC-MS法,具有样品前处理简单,仪器分析时间短,适用于大样本量的优点.本实验利用LC-MS法发现了m6A修饰在热预适应过程中总体水平的上升趋势,初步揭示其可能在热预适应过程中发挥调控作用,但是该实验却不能在检测已知靶基因如热应激蛋白、缺氧诱导因子和肿瘤坏死因子等在热预适应过程中的变化趋势,也不能通过m6A水平的变化检测参与热预适应调控的未知基因和信号通路.在未来的研究中,需要采用SCARLET,MeRIP-Seq和PA-m6A-Seq等可识别特定基因或在转录组中定位m6A位点方法,分析发现新的候选关键靶基因和信号通路,然后借助基因敲除或超表达等方法进行验证.
