基于UPLC-Q-TOF/MS的大鼠体内茵芋苷代谢特征分析
2022-06-21肖起明余茜茜俞鑫伟叶晓霞
肖起明,余茜茜,俞鑫伟,叶晓霞
温州医科大学药学院,浙江 温州 325035
茵芋苷(skimmin),别名香豆素-7-O-β-D-葡萄糖苷,分子式为C15H16O8,是从虎耳草科植物圆锥绣球茎部中提取的主要化学成分[1]。研究表明茵芋苷具有广泛的药理活性,包括肾脏保护[2-3]、镇痛[4]、抗炎[5]和抗阿米巴痢疾[6]等作用。然而,茵芋苷也可能对机体产生不良反应,ESKANDANI等[7]报道了茵芋苷的细胞毒性。同时,已有相关研究分析了茵芋苷的药代动力学特征,揭示了茵芋苷在体内的吸收分布和消除过程[8],但至今鲜有研究报道茵芋苷在体内的代谢特征。超高效液相色谱-四级杆串联飞行时间质谱法(ultraperformanceliquidchromatography-quadrupole-timeofflight/massspectrometry, UPLC-Q-TOF/MS)是近年来较为常用的运用于代谢研究的技术[9-10],本研究旨在采用UPLC-Q-TOF/MS法,分析大鼠灌胃及舌下静脉注射茵芋苷后的代谢产物,探究茵芋苷药效物质及其在体内的代谢特征,并为其进一步药理学研究和安全性评价提供依据。
1 材料和方法
1.1 材料和仪器
1.1.1 动物:健康Sprague-Dawley(SD)雄性大鼠24只,体质量(220±20)g,购自温州医科大学实验动物中心,饲养于温州医科大学动物实验中心,实验动物许可证号:SYXK(浙)2009-0129。
1.1.2 仪器:AcquityUltra超高效液相色谱系统及SynaptQ-TOF质谱仪购自美国Waters公司,配有电喷雾电离源(ESI)。MasslynxV4.1(数据处理软件)、MetaboLynx及MassFragmentTM数据处理系统(数据分析软件)。移液枪购自德国Eppendorf公司;SartoriusBS224S电子天平购自北京赛多利斯科学仪器有限公司;Allegra64R离心机购自美国BeckmanCoulter公司;KQ-500DE数控超声波清洗器购自昆山超声仪器有限公司;XW-80A涡旋混合器购自海门其林贝尔仪器制造有限公司。
1.1.3 试剂:茵芋苷(C15H16O,纯度≥98%,批号:MUST-18050905)购自成都曼斯特生物科技有限公司;甲醇为HPLC纯试剂,购自美国Merck公司;甲酸为HPLC纯试剂,购自美国ACS公司;乙腈为HPLC纯试剂,购自美国Merck公司;超纯水取自Milli-Q超纯水仪(美国Merck公司)。
1.2 方法
1.2.1 样品采集:取雄性SD大鼠24只,随机分成8组,分别为灌胃给药方式的血浆、尿液、胆汁、粪便组以及静脉给药方式的血浆、尿液、胆汁、粪便组。灌胃给药组大鼠以50mg·kg-1剂量灌胃给予茵芋苷溶液(以0.1%CMC-Na为溶媒),静脉注射给药组大鼠以5mg·kg-1剂量舌下静脉注射给予茵芋苷溶液(以含5%DMSO的0.9%氯化钠溶液为溶媒)[8]。给药前分别收集血浆、尿液、胆汁、粪便的空白样品,给药后分别收集0~4h、4~8h、8~12h、12~24h、24~36h、36~48h时间段的胆汁样品,0~12h、12~24h、24~36h、36~48h时间段的尿液和粪便样品,5min、15min、30min、45min、1h、3h、5h、8h、12h、24h、36h、48h时间点的血浆样品,所有血样采集后均以4500r/min离心10min,所有样品分析前置于-80℃保存[11]。
1.2.2 样品制备:采用蛋白质沉淀法预处理样品。在2mL血浆、1mL尿液和1mL胆汁中分别加入10mL甲醇,涡旋混合5min,4500r/min离心10min。称取100mg粪便样品,用100μL0.9%氯化钠溶液和900μL甲醇提取,涡旋混合5min并4500r/min离心10min后,再超声处理10min。将上清液置于30℃的氮气流下蒸发至干燥。将残余物复溶于100μL甲醇中,再次涡旋5min,13000r/min离心10min。将5μL上清液注入UPLC-Q-TOF/MS系统进行分析[8,11-12]。
1.2.3 色谱条件:使用ACQUITYUPLCHSST3柱(1.8μm,2.1×100mm)进行分离;流动相为含0.1%甲酸的超纯水(溶剂A)和含0.1%甲酸的乙腈溶液(溶剂B),梯度洗脱,0~2min,95%A;2~10min,95%~80%A;10~13min,80%~70%A;13~22min,70%~15%A;22~25min,15%A;25~25.5min,15%~95%A;25.5~30min,95%A[11]。每次进样前以流动相初始条件预平衡6min;流速:0.2mL/min;柱温:40℃;进样量:5μL。
1.2.4 质谱条件:通过正模式的电喷雾离子源(electronsprayionization, ESI)进行实验。为了确保质谱的准确性和重现性,使用亮氨酸脑啡肽(m/z554.2615)进行实时校正。质谱参数设定如下:毛细管电压,2.5kV;离子源温度,100℃;锥孔电压,40V;锥孔气流速,50L/h;去溶剂化气流速,800L/h。扫描范围为m/s100~1200,分辨率30000,扫描时间0.2s[8,11-12]。
1.2.5 数据处理:使用MassLynx4.1 软件处理UPLC-Q-TOF/MS的数据。将原始数据导入MassLynx4.1版软件中鉴定茵芋苷代谢物。代谢物的鉴定过程包括自动预测和人工验证两部分。首先使用实验室内部设计的Matlab程序进行自动预测,在该程序中输入茵芋苷及其代谢产物的化学式,并将电离设置为[M+H]+和[M-H]-,获得高分辨率质谱数据(highresolutionmassspectrometry, HRMS)。然后,基于71种典型的代谢反应预测茵芋苷的代谢物。人工验证是通过提取离子色谱图来筛选质量偏差<5ppm的预测代谢物。此外,提取MS2片段离子数据进行预测代谢物的结构确认。鉴于茵芋苷在体内的主要代谢产物是7-羟基香豆素[13],同时以7-羟基香豆素为模板,预测7-羟基香豆素的可能代谢物。
2 结果
2.1 茵芋苷的代谢产物 使用UPLC-Q-TOF/MS方法对血浆、胆汁、尿液和粪便样品进行分析,共发现了10种代谢产物,见表1。m/z为P(325.0922)、M1(297.0979)、M2(323.0765)、M3(307.0816)、M4(163.0395)、M5(165.0552)、M6(339.0716)、M7(177.0552)、M8(242.9963)、M9(193.0501)、M10(147.0446),其中,M1、M2、M3、M4为原型直接代谢,M5、M6、M7、M8、M9、M10为7-羟基香豆素的代谢产物,代谢产物见图1。
2.2 茵芋苷及其代谢产物的结构鉴定 茵芋苷的原型在保留时间为8.84min时检测到色谱峰,在正离子模式下准分子离子为m/z325.0922(C15H16O8)。高碰撞能量下主要产生m/z289、237、163、118,其中,m/z289是从m/z325中丢失两分子OH,m/z273是从m/z325中丢失C3H8O3,m/z163是从m/z325中丢失糖基(C6H12O5),m/z118是从m/z163中丢失一分子OH与一分子CO。原型产生碎片离子的机制见图2A。
M1:M1 在正离子模式下准分子离子为m/z297.0970(C14H16O7),在保留时间为13.12min时检测到色谱峰,根据精确相对分子质量,比原型低28,其分子式组成比原型少了CO,推测是茵芋苷分子失去羰基的结果,高碰撞能量下主要产生m/z279、232、164的特征碎片离子,其中m/z279是从m/z297丢失一分子H2O,m/z232是从m/z279丢失CH3O2,m/z164是m/z297丢失7-羟基香豆素(C9H6O3),M1产生碎片离子的机制见图2B。
M2:M2 在正离子模式下准分子离子为m/z323.0748(C15H14O8),在保留时间为12.20min时检测到色谱峰,根据精确相对分子质量,比原型低2,其分子式组成比原型少了2个H,推测是茵芋苷分子去饱和的结果,高碰撞能量下主要产生m/z263、194、120的特征碎片离子,其中m/z263是从m/z323丢失CO3,m/z194是从m/z263丢失C4H2O,m/z120是m/z323丢失C7H6O7,M2产生碎片离子的机制见图2C。
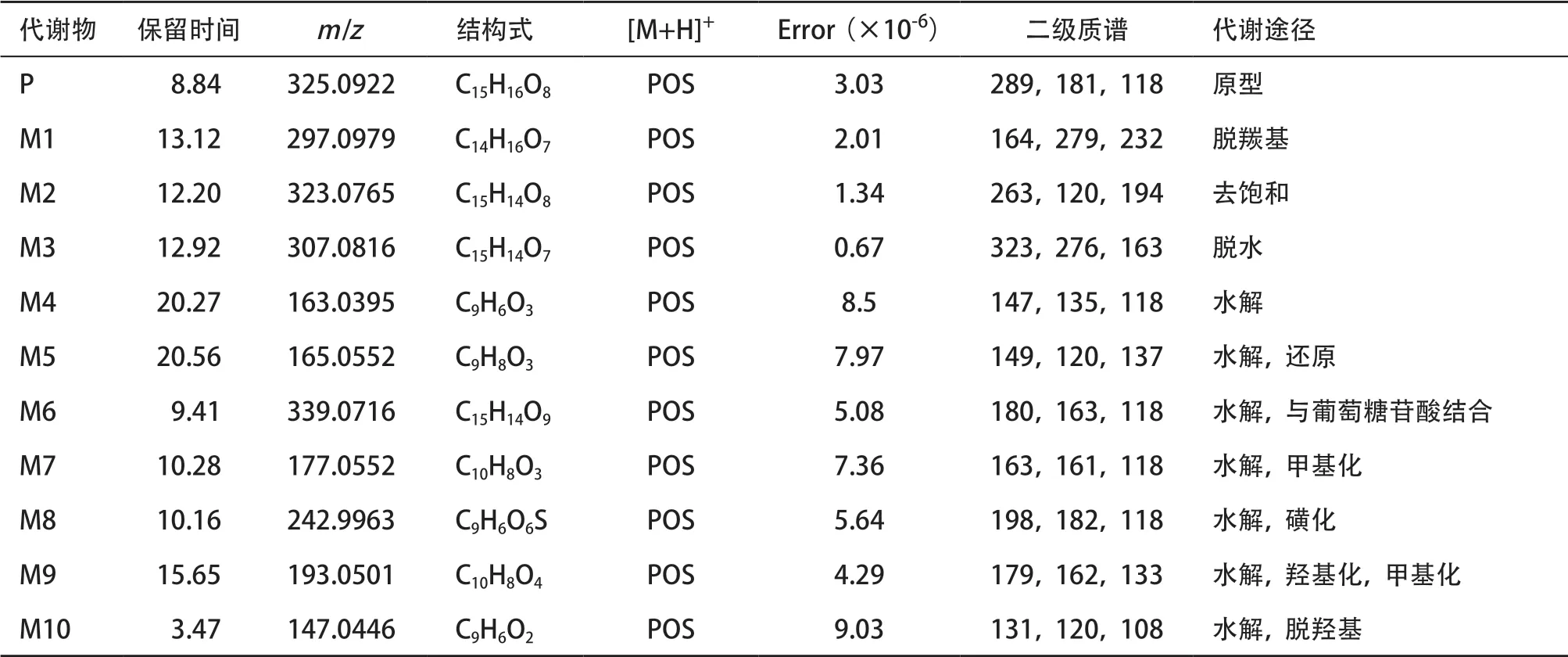
表1 茵芋苷(P)及其代谢物(M1-M10)的质谱数据
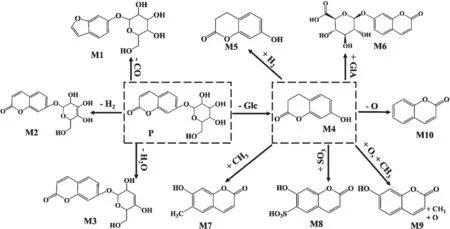
图1 茵芋苷在大鼠体内的代谢途径
M3:M3 在正离子模式下准分子离子为m/z307.0816(C15H14O7),在保留时间为12.92min时检测到色谱峰,根据精确相对分子质量,比原型低18,其分子式组成比原型少了H2O,推测是茵芋苷分子脱水的结果,高碰撞能量下主要产生m/z276、248、163的特征碎片离子,其中m/z276是从m/z307丢失C2H2O2,m/z232是从m/z307丢失C2H2O3,m/z163是m/z307丢失7-羟基香豆素(C9H6O3),M3产生碎片离子的机制见图2D。
M4:M4 在正离子模式下准分子离子为m/z163.0395(C9H6O3),在保留时间为20.27min时检测到色谱峰,根据精确相对分子质量,比原型低162,其分子式组成比原型少了C6H10O5,推测是茵芋苷分子水解为苷元的结果,高碰撞能量下主要产生m/z147、135、118的特征碎片离子,其中m/z147是从m/z163丢失一个O,m/z135是从m/z163丢失CO,m/z118是m/z135丢失一分子OH,M4产生碎片离子的机制见图2E。
M5:M5 在正离子模式下准分子离子为m/z165.0552(C9H8O3),在保留时间为20.56min时检测到色谱峰,根据精确相对分子质量,比7-羟基香豆素分子高2,其分子式组成比7-羟基香豆素分子多了H2,推测是7-羟基香豆素分子还原的结果,高碰撞能量下主要产生m/z149、137、120的特征碎片离子,其中m/z149是从m/z163丢失一个O,m/z137是从m/z163丢失CO,m/z120是m/z137丢失一分子OH,M5产生碎片离子的机制见图3A。
M6:M6 在正离子模式下准分子离子为m/z339.0716(C15H14O9),在保留时间为9.41min时检测到色谱峰,根据精确相对分子质量,比原7-羟基香豆素分子高176,其分子式组成比原型多了C6H8O6,推测是7-羟基香豆素分子与葡萄糖苷酸结合的结果,高碰撞能量下主要产生m/z180、163、118的特征碎片离子,其中m/z180是从m/z339丢失C9H6O3,m/z163是从m/z339丢失C6H8O6,m/z118是m/z163丢失一分子CHO2,M6产生碎片离子的机制见图3B。
M7:M7 在正离子模式下准分子离子为m/z177.5522(C10H8O3),在保留时间为10.28min时检测到色谱峰,根据精确相对分子质量,比原7-羟基香豆素分子高14,其分子式组成比原型多了CH2,推测是7-羟基香豆素分子甲基化的结果,高碰撞能量下主要产生m/z163、161、118的特征碎片离子,其中m/z163是从m/z177丢失CH2,m/z161是从m/z177 丢失一个O,m/z118 是m/z163 丢失一分子CHO2,M7产生碎片离子的机制见图3C。
M8:M8 在正离子模式下准分子离子为m/z242.9963(C9H6O6S),在保留时间为10.16min时检测到色谱峰,根据精确相对分子质量,比原7-羟基香豆素分子高79,其分子式组成比原型多了SO3,推测是7-羟基香豆素分子磺化的结果,高碰撞能量下主要产生m/z198、182、118的特征碎片离子,其中m/z198是从m/z242丢失CO2,m/z198是从m/z182丢失一个O,m/z118是m/z182丢失一分子SO2,M8产生碎片离子的机制见图3D。
M9:M9 在正离子模式下准分子离子为m/z193.0501(C10H8O4),在保留时间为15.65min时检测到色谱峰,根据精确相对分子质量,比原7-羟基香豆素分子高30,其分子式组成比原型多了CH2O,推测是7-羟基香豆素分子甲基化和羟基化的结果,高碰撞能量下主要产生m/z179、162、133、118的特征碎片离子,其中m/z179是从m/z193丢失CH2,m/z162是从m/z179丢失一个O,m/z133是m/z182丢失一分子CO3,m/z118是m/z113丢失一分子CH3,M9产生碎片离子的机制见图3E。
M10:M10在正离子模式下准分子离子为m/z147(C9H6O2),在保留时间为3.47min时检测到色谱峰,根据精确相对分子质量,比原7-羟基香豆素分子低16,其分子式组成比原型少了一个O,推测是7-羟基香豆素分子脱羟基的结果,高碰撞能量下主要产生m/z131、120、108的特征碎片离子,其中m/z131是从m/z147丢失一个O,m/z120是从m/z147丢CO,m/z108是m/z120丢失一个C,M10产生碎片离子的机制见图3F。
2.3 茵芋苷在大鼠体内的代谢分析 经过UPLC-QTOF/MS分析,茵芋苷在体内进行了广泛代谢,如表1、图1所示,在血浆、尿液、胆汁及粪便中,除原形药物外共检测到10种代谢物。在鉴定出的10种化合物中,M6、M7和M10仅在灌胃给药方式中检测到;M9仅在静脉给药方式中检测到;M4、M5和M7在血浆、尿液、胆汁及粪便样品中均可以检测到。
用MS相应的百分比表示相对丰度,茵芋苷在血浆、胆汁、尿液和粪便中的各代谢物的相对丰度见图4。其中,给药后血浆中主要为7-羟基香豆素和7-羟基香豆素的还原及甲基化代谢产物;胆汁中主要为茵芋苷、茵芋苷脱羰基的代谢产物、7-羟基香豆素和7-羟基香豆素的甲基化及葡萄糖苷酸结合的代谢产物;粪便中主要为7-羟基香豆素和7-羟基香豆素脱羟基的代谢产物;尿液中检测到的代谢产物最多,主要包括茵芋苷、茵芋苷去饱和及脱水的代谢产物、7-羟基香豆素和7-羟基香豆素的甲基化及羟基化的代谢产物。

图2 茵芋苷及其代谢产物(M1-M4)的二级质谱图及可能的裂解碎片和机制

图3 茵芋苷代谢产物(M5-M10)的二级质谱图及其可能的裂解碎片和机制

图4 大鼠血浆(A)、尿液(B)、粪便(C)、胆汁(D)中的代谢物相对丰度
3 讨论
茵芋苷属于香豆素家族,存在于许多药用植物中,包括:丽风毛菊、杭白芷、木橘等。近年来研究报道,茵芋苷对糖尿病肾病引起的肾脏损伤具有保护作用[3]。目前,糖尿病肾病尚无有效的治疗方法,在许多患者中,尽管高血糖得到了严格控制,但病情仍在继续恶化,最终由于肾功能衰竭而需要进行透析治疗。茵芋苷可能通过调节TGF-β1信号通路,降低血糖水平,在一定程度上可抑制糖尿病肾病,并延缓肾纤维化[3]。因此,茵芋苷被认为是一种具有广阔前景的预防或减缓糖尿病肾病临床和病理生理进展的候选药物。此外,茵芋苷对免疫复合物定位于肾小球上皮下区域所引起的膜性肾病具有保护作用,高剂量的茵芋苷给药后可显著减轻肾小管间质损伤[1]。IQBAL等[6]研究表明,茵芋苷对溶组织内阿米巴HM1:IMMS菌株具有良好的抗阿米巴活性。茵芋苷还具有抗肿瘤、抗疟原虫和神经保护等活性[14-16]。从广泛的药理活性来看,茵芋苷可能是一种潜在的治疗药物。因此,探究茵芋苷药效物质及其在体内的代谢特征,能为进一步药理学研究和安全性评价提供依据。
本研究通过UPLC-Q-TOF/MS方法分析了茵芋苷在大鼠体内以灌胃和静脉注射方式给药后血浆、胆汁、尿液和粪便中的10种主要的代谢产物,并根据质谱结果对代谢物的结构进行了初步鉴定。结果表明,茵芋苷的主要代谢物不仅在4种生物样品中存在差异,而且在灌胃和静脉2种给药方式中也存在差异。在茵芋苷灌胃给药后,血浆中检测到M4、M5、M7,尿液中检测到M2、M3、M4、M5、M6、M7、M8,粪便中检测到M1、M5、M7,胆汁中检测到P、M6、M7。而在茵芋苷静脉给药后,血浆中检测到P、M4、M5、M8,尿液中检测到P、M2、M3、M4、M5、M6、M8、M9,粪便中检测到M4、M5、M8、M10,胆汁中检测到M1、M3、M4。经分析发现,茵芋苷的代谢途径包括脱羰、去饱和、脱水和水解,并生成7-羟基香豆素。7-羟基香豆素的代谢途径包括还原、与葡萄糖苷酸结合、甲基化、磺化、羟基化以及脱羟基。其中尿液中的代谢产物最丰富,这说明大鼠给予茵芋苷后可能主要通过肾脏进行代谢。综上所述,本研究基于UPLC-Q-TOF/MS分析方法,证明了茵芋苷在大鼠体内进行广泛代谢,如水解、葡萄糖苷酸结合、氧化、羟基化等,同时为茵芋苷微量代谢物的鉴定提供了实用策略以及为其后续药理学研究提供了有效信息。
