脂氧素A4通过ERK1/2通路调控气道上皮细胞上皮间质转化
2022-06-21罗亚灿吴镇杰金敏莉楼乐静杨松蔡济豪蔡畅
罗亚灿,吴镇杰,金敏莉,楼乐静,杨松,蔡济豪,蔡畅
1.温州医科大学附属第一医院呼吸与危重症医学科,浙江 温州 325015;2.台州医院呼吸内科,浙江 台州 317000
气道重塑是哮喘的主要病理特征之一,是导致患者不可逆性肺功能下降的主要原因,与哮喘严重程度密切相关[1]。研究证实,上皮间质转化(epithelial-mesenchymaltransition, EMT)是气道重塑的重要机制之一[2]。
脂氧素A4(lipoxinA4, LXA4)是重要的内源性脂质介质[3]。临床研究显示,重度哮喘患者体液中LXA4水平明显降低,并与肺功能下降程度存在正相关性[4]。LXA4可在体外抑制结缔组织生长因子诱导的人肺成纤维细胞增殖[5]和胶原分泌[6]。15-epi-LXA4可以逆转博来霉素引起的肺纤维化[7]。成纤维细胞和气道上皮细胞等与气道重塑改变相关的细胞均普遍表达LX受体[5,8]。小鼠体内实验证实LXA4可以同时减轻哮喘小鼠的过敏性气道炎症和气道重塑[9],而在体外细胞实验中,上皮细胞中LX受体和LX的表达增加有助于受损气道上皮的修复[8]。这些证据均提示LXA4在气道重塑中发挥着重要作用。本研究探讨LXA4对人正常支气管上皮细胞EMT和卵清蛋白(ovalbumin, OVA)诱导的哮喘小鼠气道重塑的影响以及相关机制。
1 材料和方法
1.1 材料 BEAS-2B细胞株购自美国典型菌种保藏中心(AmericanTypeCultureCollection, ATCC);6~8周龄BALB/c雄性小鼠32只,体质量18~22g,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002],动物饲养在无特定病原体的条件下,室温维持在21~23℃,湿度保持40%~60%,12h/12h自然光照交替。LXA4购自美国CaymanChemical公司;DMEM培养基、胎牛血清购自美国Gibco公司;BCA试剂盒购于上海碧云天生物技术有限公司;ERK1/2、pERK1/2 抗体购自美国CellSignalTechnology公司;GAPDH抗体购自美国Abcam公司;SYBRGreenreal-timePCRMasterMix、反转录PCR试剂盒购于日本Takara公司;所有引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 小鼠分组和处理:将小鼠随机分成4组:对照组、OVA组、LXA4组和OVA+LXA4组,每组8只。OVA诱导建立哮喘小鼠模型:在第1天和第14天,给小鼠腹腔注射0.2mL含有20μgOVA和200μL1.36%氢氧化铝的0.9%氯化钠溶液以诱导过敏;从第24天开始,小鼠雾化吸入含2mg/mLOVA的0.9%氯化钠溶液处理30min,持续3d(对照组和LXA4组小鼠予以等量的0.9%氯化钠溶液)。OVA+LXA4组和LXA4组每次雾化处理前半小时尾静脉注射100μg/kgLXA4,对照组、OVA组注射等量0.9%氯化钠溶液。收集小鼠肺左叶,4%多聚甲醛浸泡固定,石蜡包埋切片。
1.2.2 HE和PAS染色:收集的小鼠肺组织石蜡包埋切片进行HE和PAS染色,观察肺组织形态学变化。
1.2.3 细胞培养和分组:正常肺气道上皮细胞BEAS-2B在含10%胎牛血清和1%青霉素-链霉素双抗溶液的DMEM培养基中培养,置于37℃,含5%CO2的加湿培养箱中。BEAS-2B细胞为贴壁生长,细胞汇集至70%~80%时,按1:4传代。细胞分为6组:对照组、IL-4组(20ng/mLIL-4)、IL-13组(20ng/mLIL-13)、TGF-β1组(20ng/mLTGF-β1)、IL-4/IL- 13/TGF-β1 联合刺激组(IL-4、IL-13 和TGF-β1 各20ng/mL)、LXA4预处理组(在添加IL-4、IL-13和TGF-β1前用200ng/mLLXA4预处理30min)。Beas-2B传代24h后更换为1%胎牛血清培养基,按上述分组予以不同处理,72h后收集细胞。
1.2.4 实时定量聚合酶链反应(r e a l-tim equantitativepolymerasechainreaction, RTqPCR):根据试剂盒说明,使用RNAisoplus提取各组细胞总RNA,分光光度计测RNA浓度和纯度。使用PrimeScriptTMRTMasterMix将RNA反转录成cDNA。使用SYBR®PremixExTaqTM通过实时PCR进行定量。相对转录水平通过2-ΔΔCT法进行数据分析。引物序列见表1,RPLP0用作内参。

表1 引物序列
1.2.5 Westernblot:从细胞中分离蛋白质,并用BCA试剂盒测定蛋白质浓度。蛋白质样品加载到10%SDS-PAGE凝胶上分离并转移到PVDF膜上,膜用5.0%牛奶室温封闭2h,然后与2%BSA稀释的一抗4℃孵育过夜,抗体浓度分别为:兔抗E-cadherin抗体、兔抗ERK1/2抗体和兔抗pERK1/2抗体1:1000,兔抗α-SMA抗体1:5000,鼠抗GAPDH抗体1:500。PBST洗膜3 次后,将膜与相应二抗室温下孵育1h。使用ECL试剂盒对条带进行可视化,使用ImageJ软件进行条带灰度值定量分析。
1.3 统计学处理方法 使用GraphPadPrism8.0软件进行统计学分析。所有实验数据均采用±s表示。各组间比较采用单因素方差分析,组间两两比较用LSD法检验,方差不齐采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 LXA4对OVA诱导的小鼠哮喘气道重塑的作用 HE染色结果显示:对照组、LXA4组小鼠的肺泡组织结构完整,无水肿,肺实质未见明显炎性细胞浸润;OVA组小鼠表现为明显的肺泡间隔增厚甚至肺泡结构破坏、水肿,有大量炎性细胞浸润,肺组织还可见出血。PAS染色显示:对照组和LXA4组未见明显气道上皮杯状细胞化生;OVA组支气管上皮组织中存在PAS强阳性染色区域,提示杯状细胞增生和黏液分泌增加。LXA4干预能明显改善OVA诱导的肺泡结构破坏和黏液产生。见图1。
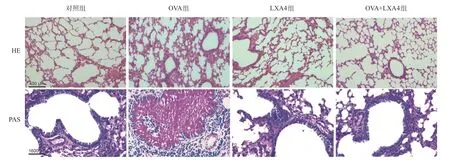
图1 各组小鼠肺组织HE和PAS染色图
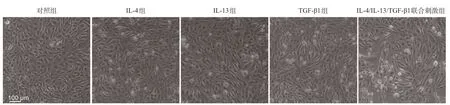
图2 各组细胞形态改变
2.2 IL-4、IL-13对TGF-β1诱导气道上皮细胞BEAS-2B发生EMT的作用 如图2所示:与对照组相比,单独使用IL-4 或IL-13 刺激的BEAS-2B细胞形态未见明显改变,TGF-β1组细胞连接变得松散,细胞间隙增加,呈长梭形;IL-4/IL-13/TGF-β1联合刺激后细胞形态较TGF-β1组梭状更为明显,细胞连接更松散,细胞间隙更宽。RT-qPCR和Westernblot结果显示:与对照组相比,单独使用IL-4 或IL-13 刺激时,BEAS-2B细胞α-SMA、E-cadherin的mRNA和蛋白表达均无明显改变(P>0.05);TGF-β1组细胞E-cadherinmRNA和蛋白表达均显著降低,α-SMAmRNA和蛋白表达明显升高(P<0.05或P<0.01);IL-4/IL-13/TGF-β1联合刺激组较TGF-β1组两种标志物的改变更为明显(P<0.05或P<0.01)。见图3。2.3 IL-4、IL-13、TGF-β1对气道上皮细胞中ERK1/2MAPK通路的影响 Westernblot结果显示:与对照组相比,单独使用IL-4、IL-13 后细胞ERK1/2 蛋白磷酸化水平未见明显变化(P>0.05),TGF-β1组ERK1/2 蛋白磷酸化水平升高(P<0.01),IL-4/IL-13/TGF-β1联合刺激后BEAS-2B细胞中pERK1/2表达较单独使用TGF-β1增加更为明显(P<0.05)。见图4。2.4 LXA4通过ERK1/2通路调控气道上皮细胞Beas-2BEMT 与IL-4/IL-13/TGF-β1 联合刺激组相比,LXA4预处理后细胞间隙明显变窄,细胞形态恢复椭圆形,仅少数细胞表现为梭形(见图5)。RT-qPCR和Westernblot结果显示,LXA4能够显著抑制IL-4、IL-13和TGF-β1联合刺激诱导的α-SMA和E-cadherinmRNA和蛋白质表达改变(P<0.01,P<0.001);明显下调IL-4、IL-13和TGF-β1联合刺激诱导的细胞内pERK1/2表达增加(P<0.01)。见图6。
3 讨论
哮喘气道重塑包括气道上皮完整性破坏、上皮下纤维化、杯状细胞增生、平滑肌增生肥大和血管增生[10]。本研究通过小鼠模型证实,LXA4能明显改善OVA诱导的杯状细胞化生、肺泡结构破坏、肺泡壁水肿以及肺间质炎性细胞浸润等气道改变,这与之前的研究[9]结果一致,但LXA4对参与气道重塑的结构细胞的影响尚未明确。

图3 各组细胞E-cadherin和α-SMAmRNA和蛋白表达水平的 比较

图5 各组BEAS-2B细胞的形态
研究表明,气道上皮细胞功能的完整性可能与气道重塑密切相关,抑制哮喘小鼠气道上皮异常活化可以有效缓解哮喘气道炎症和气道重塑[11]。气道上皮细胞EMT是气道重塑的重要机制之一。暴露于过敏原的小鼠气道上皮细胞会发生EMT并分化成肌成纤维细胞,引起上皮下纤维化,进而导致气道壁增厚[12]。E-cadherin是上皮细胞的重要标志物之一,其表达下降可能破坏细胞与细胞的连接,增加细胞对损伤的易感性[13]。E-cadherin水平下调、间质细胞标志物α-SMA水平上升被视为EMT的重要表现之一[14]。TGF-β1是公认的促纤维化细胞因子[15-16],常被用作EMT诱导剂。ZUO等[17]将气道上皮细胞暴露在TGF-β1后发现细胞形态发生变化,E-cadherin表达下降。本研究使用TGF-β1诱导BEAS-2B建立EMT模型,TGF-β1刺激BEAS-2B细胞72h,细胞形态发生改变,从紧密连接的椭圆形上皮细胞向连接松散的长梭形间质细胞转变,同时,与对照组相比,TGF-β1处理后E-cadherin表达显著降低,而α-SMA表达明显升高。
环境中的过敏原容易透过损伤的上皮屏障,激活嗜酸性粒细胞、肥大细胞等多种炎症细胞,导致Th1/Th2功能失衡。Th1/Th2失衡在哮喘气道重塑中起重要作用。IL-4 和IL-13 是重要的具有代表性的Th2源性细胞因子,能作用于气道上皮,诱导杯状细胞化生和黏液分泌,参与哮喘气道上皮重塑[18-19]。本研究结果显示,IL-4和IL-13 能显著增强TGF-β1诱导的EMT形态改变,抑制E-cadherin表达和诱导α-SMA表达的效力。以上结果可能提示Th2细胞因子失衡的气道微环境能促进TGF-β1诱导上皮细胞的EMT过程。
ERK1/2磷酸化可激活各种转录因子,调节细胞增殖、分化和凋亡。给予慢性哮喘大鼠ERK1/2 的激动剂能促进小鼠体内气道平滑肌细胞增殖[20]。ERK信号通路参与介导IL-13诱导的人支气管上皮细胞杯状细胞增生[21]。本研究发现,在IL-4/IL-13/TGF-β1联合刺激诱导气道上皮细胞BEAS-2B发生EMT时,细胞内pERK1/2蛋白表达增加。之前在胰腺[22]、肾小管上皮细胞[23]、肝脏[24]等的研究也显示组织器官发生EMT时ERK1/2MAPK磷酸化激活增加。因此我们推测,ERK1/2MAPK信号的激活可能同样参与调控气道上皮细胞EMT。
本课题组前期研究证实,LX与哮喘缓解密切相关[25-26]。研究表明:LXA4通过抑制子宫内膜EMT来干扰胚胎植入[27]。LXA4的类似物BML-111能减缓肝癌细胞的EMT和转移[28]。LXA4可以通过抑制ERK1/2MAPK通路的激活显著减轻肾脏的损伤[29]、减弱胰腺癌的细胞侵袭[30]。在本研究中,LXA4能显著抑制IL-4/IL-13/TGF-β1联合刺激诱导的气道上皮细胞E-cadherin表达下降和α-SMA表达增加,同时,LXA4预处理组与IL-4/IL-13/TGF-β1 联合刺激组相比,pERK1/2MAPK蛋白表达下降,说明LXA4能在一定程度上抑制气道上皮细胞EMT,而这种作用可能与ERK1/2磷酸化相关。
综上所述,本研究以气道上皮细胞为切入点,用IL-4 及IL-13 模拟重症哮喘患者气道上皮细胞所处的Th2细胞因子失衡的内环境,发现Th2偏转气道微环境能促进TGF-β1诱导的气道上皮细胞EMT;同时还发现LXA4能改善OVA诱导的哮喘小鼠模型的气道重塑,并能在体外减轻气道上皮细胞的EMT,这一过程可能与抑制ERK1/2MAPK通路磷酸化相关。
