先天性肾上腺发育不良症基因-1对垂体瘤细胞自噬和增殖的调控作用
2022-06-21陈贤斌胡琼霜吕芳芳卢江龙李群
陈贤斌,胡琼霜,吕芳芳,卢江龙,李群
1.温州医科大学附属第一医院神经外科,浙江 温州 325015;2.温州医科大学附属第二医院育英儿童医院儿童呼吸科,浙江 温州 325027
垂体腺瘤是颅内常见的肿瘤[1],主要包括泌乳素腺瘤、生长激素细胞腺瘤和无功能腺瘤等[2],其中泌乳素腺瘤是最常见的亚型[3]。目前泌乳素腺瘤首选药物治疗,常用治疗药物有溴隐亭(bromocriptine, BRC)和卡麦角林(cabergoline, CAB),这两种药物能够使80%~90%的患者获益[4]。但仍有10%~20%的患者对药物治疗不敏感、甚至无效,此类患者往往手术治疗后仍然难以恢复正常的泌乳素水平[5]。因此探寻泌乳素腺瘤发生发展机制和解决垂体瘤耐药问题至关重要。先天性肾上腺发育不良症基因-1(dosage-sensitivesexreversaladrenalhypoplasiacongenitaregionontheXchromosome1, DAX-1)基因属于核受体(nuclearreceptors, NRs)家族。最近发现其与肿瘤的发生发展具有密切关系[6],如乳腺癌[7]、宫颈癌[8]等,但未见其与垂体瘤增殖和自噬的相关研究。本研究主要讨论DAX-1 对垂体泌乳素腺瘤的增殖和药物敏感性的影响及其可能的机制。
1 材料和方法
1.1 材料 大鼠垂体瘤(MMQ)细胞系细胞购买于北京中原聚合生物科技有限公司。细胞培养所需的胎牛血清、马血清,以及F12K细胞培养基、青霉素/链霉素双抗购于美国Life公司;TRIzol和RNA抽提试剂购于美国Sigma公司,SYBRGreen、realtimePCRMasterMix、反转录试剂盒购自日本Takara公司;CCK-8检测试剂盒和BCA试剂盒购买于北京碧云天生物有限公司;实时荧光定量聚合酶链反应(real-timequantitativepolymerasechainreaction, RT-qPCR)所需引物由上海生工生物工程有限公司代为设计合成。
1.2 方法
1.2.1 细胞培养和转染:MMQ细胞培养于Ham’sF-12K(Kaighn’s)培养基中添加12.5%的马血清、2.5%的胎牛血清和1%的青霉素/链霉素,MMQ细胞培养传代于上述培养基,并在37℃、5%CO2环境下培养,待细胞生长至密度约70%时进行转染。转染:将MMQ细胞转至6孔板,每孔约3×105个细胞,24h后用Lipofectamine3000转染试剂将siRNA(由上海吉玛生物技术公司合成,序列5’-GCACGUGGCUCCUUAGCGAU-3’)转染至MMQ细胞敲低DAX-1的表达(DAX-1KD组);DAX-1过表达质粒(上海吉玛公司合成)转染至MMQ细胞提高DAX-1的表达(DAX-1OE组),6h换液,48h后收获细胞继续培养;并设正常对照组(NC组)。
1.2.2 细胞增殖实验:将预处理后的MMQ细胞接种于96孔细胞培养板(5×103个细胞/孔),分别培养24、48、72、96h后,根据CCK-8使用说明,每个孔加入10μLCCK-8溶液后,37℃孵育1~2h,用酶标仪在450nm处读取吸光度,并依据(A450样品-A450背景/A450对照-A450背景)计算细胞相对活性,每个样本设3个复孔;其中为了探究DAX-1对CAB和BRC的药物治疗有无促进作用,用CAB和BRC与DAX-1过表达共同作用于MMQ细胞。克隆实验:预处理的MMQ细胞(1×103细胞/孔)被接种到6孔板上培养14d,在肉眼可见克隆形成后去除培养基,并用4%多聚甲醛室温固定15min,然后用1%结晶紫染色液染色10min,0.9%NaCl溶液反复冲洗干净、拍照。
1.2.3 RT-qPCR实验:使用TRIzol试剂分别提取经过预处理的MMQ细胞中的总RNA,然后进行浓度测定和纯度判断,按照分光光度计读数2.0>A260/A280>1.8判断纯度。按照反转录试剂盒的操作说明将RNA反转录为cDNA模版,每个样本RNA总量为1000ng,然后按照SYBRGreen、RealtimePCRMasterMix试剂盒的操作要求行RT-qPCR,每个样本设3个复孔。获取数据采用2-ΔΔCt法进行数据处理,计算实验组相对于对照组的自噬相关基因表达倍数的变化,引物序列见表1。
1.2.4 蛋白质印迹(Westernblot)检测:细胞和组织样本用无菌管收集,并用冷PBS洗涤两次去除杂质,然后利用超声破碎仪破碎细胞和组织,加入适量的RIPA细胞蛋白裂解液裂解样本获取总蛋白;然后用BCA方法标定蛋白浓度,每个样本上样40μg蛋白总量,SDS-PAGE电泳分离、转膜蛋白样本并转移至PVDF膜。用5%脱脂牛奶室温封闭1~2h后用相应的蛋白一抗在4℃孵育过夜。然后在室温下,将膜与HRP标记的二抗孵育1h,TBST洗膜3次后显影,具体抗体见表2。

表1 RT-qPCR所用引物序列

表2 Westernblot实验所用抗体信息
1.2.5 免疫荧光实验:预处理的细胞爬片用PBS缓冲液轻轻洗3次,每次5min,用4%多聚甲醛浸没爬片,室温固定15min。然后用0.1%的TrionX-100破膜15min,PBS缓冲液洗3次。接下来用3%的BSA室温封闭30min后,加入LC3抗体(稀释比例1:100),浸没爬片,然后4℃冰箱平放过夜。过夜后获取爬片,PBS缓冲液洗3次后加入荧光二抗(invitrogen,A-11008),室温下避光孵育1h,PBS洗3次后用抗荧光淬灭剂封片处理后于倒置荧光显微镜下拍片。
1.2.6 裸鼠移植瘤实验:动物实验经温州医科大学附属第一医院实验动物伦理委员会审批[实验动物许可证号:SYXK(浙)2021-0007)],5周龄的雌性BALB/c无胸腺裸鼠购自上海实验动物研究中心,将不带有血清的NC组MMQ细胞株和DAX-1KD组MMQ细胞株(5×106)用基质凝胶和PBS缓冲液(美国BD生物公司,#356234)混匀后,皮下注射到每只裸鼠的左背部。当肉眼可见皮下肿瘤生成时,每4d用游标卡尺记录下肿瘤的长径(a)和短径(b),a×b2/2计算肿瘤体积,绘制肿瘤生长曲线。24h后麻醉处死小鼠,获取肿瘤,拍照并提取肿瘤蛋白标本。
1.2.7 转录组基因芯片及分析方法:本研究经温州医科大学第一附属医院临床研究伦理委员会批准(编号:2016-082)。将垂体瘤和正常垂体标本利用TRIzol提取总RNA,然后按照反转录试剂盒进行反转录后移交上海惠研生物科技有限公司,采用IlluminaHiseq2000测序平台的单端50bp测序模式对核酸样本进行高通量测序。原始数据经过引物与adaptor序列去除并经过对测序片段3’端的质量检验,并选择质量可靠的测序片段而将低质量碱基动态从3’末端删除以最终保留高测序质量的碱基片断。保留的测序序列(remainedreads)片断用于后续RNA-Seq项目分析模块的分析。然后将获得的数据转化分析,以差异倍数(Log2FC)>2,P<0.05为准,进行筛选绘制热图和火山图;本研究另一项侵袭性垂体瘤和非侵袭性垂体瘤差异表达数据来源于GEODataSets数据库(https://www.ncbi.nlm.nih.gov/geo/,GSE51618),利用内置GEO2R软件分析获得DAX-1差异表达数据,然后进行统计学分析。
1.3 统计学处理方法 采用GraphpadPrism8.0软件和SPSS20.0软件进行作图和数据分析。计量资料用±s 表示,两组间比较用独立样本t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 DAX-1在垂体瘤和侵袭性垂体瘤中的表达水平 利用高通量测序技术,筛选4例正常垂体和12例垂体瘤标本中的转录组水平差异,按照差异倍数2倍以上、P<0.05 的要求筛选差异基因,见图1A;分析火山图发现DAX-1 在垂体瘤组织中表达明显下调,差异有统计学意义(P<0.05),见图1B和图1C;与非侵袭性垂体瘤比,用GEO基因数据集筛选出GSE51618数据集中侵袭性垂体瘤中DAX-1的表达水平也降低,差异有统计学意义(P<0.05),见图1D。
2.2 DAX-1对MMQ细胞生长增殖的调控 与NC组比,DAX-1OE组细胞活性在72h和96h明显低于NC组,而DAX-1KD组细胞活性明显高于NC组(P<0.05),见图2A;平板克隆实验显示,与NC比,DAX-1OE组克隆形成数目减少,而DAX-1KD组与NC组比较细胞克隆形成数目增加,见图2B。与NC组比,DAX-1OE组CAB和BRC对MMQ细胞活性的抑制能力更强,差异有统计学意义(P<0.05),见图2C和2D,提示DAX-1可能能够促进CAB和BRC对MMQ细胞的药物杀伤作用。

图1 DAX-1 基因在垂体瘤中表达情况比较
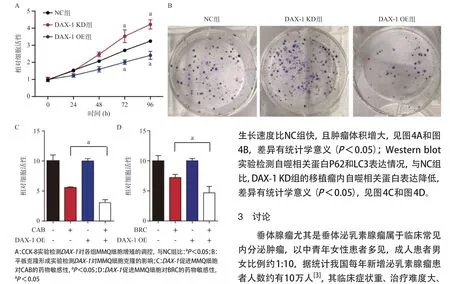
图2 DAX-1 对MMQ细胞增殖的调控
2.3 敲低DAX-1 对MMQ细胞内自噬的影响 检测MMQ细胞内自噬相关基因mRNA表达水平,与NC组比,DAX-1KD组中自噬相关基因ATG5、ATG7和ATG12的mRNA表达水平显著下调,差异有统计学意义(P<0.05),见图3A;Westernblot实验显示与NC组比,DAX-1KD组细胞内自噬标记蛋白LC3-II和P62的表达也降低,差异有统计学意义(P<0.05),见图3B;免疫荧光实验证明LC3蛋白在DAX-1 敲低后显著下降,见图3C。
2.4 敲低DAX-1对MMQ细胞体内生长和自噬的影响 每4d一次记录肿瘤生长曲线,MMQ细胞裸鼠移植瘤模型实验结果显示,DAX-1KD组MMQ细胞移植瘤
3 讨论
垂体腺瘤尤其是垂体泌乳素腺瘤属于临床常见内分泌肿瘤,以中青年女性患者多见,成人患者男女比例约1:10,据统计我国每年新增泌乳素腺瘤患者人数约有10万人[3],其临床症状重、治疗难度大、复发率高[9],主要临床表现为由高泌乳素血症引起的异常乳汁分泌、性功能减退、不孕不育、体质量增加等,同时由于巨大肿瘤的压迫效应,引起局部颅内压力增高而导致头痛、视力下降甚至失明等,药物甚至手术均无法完全解决泌乳素腺瘤引起的各种临床症状[10]。以往的研究表明,神经生长因子受体异常表达和PRDM2、PRB3等表达减少是垂体瘤发生发展或耐药的重要原因,但许多关键机制目前仍然不清楚。本研究通过探索DAX-1 基因与泌乳素腺瘤发生发展和药物治疗敏感性的相关性,旨在发现泌乳素腺瘤临床治疗的新靶标。
DAX-1 家族是一类配体激活转录因子家族,在个体的发育、代谢、分化以及其他各种疾病的发生发展中充当重要的角色[11]。1994年最初发现DAX-1位于X染色体的短臂(Xp21)上,其与肾上腺发育不良相关[12]。作为重要的转录因子,DAX-1 等异常表达或突变往往与肿瘤发生发展相关:例如DAX-1 的过度表达往往能够与SF-1 协同发挥作用从而引起小儿肾上腺皮质癌的发生[13];与正常的肝细胞组织比,在肝细胞癌中DAX-1 的表达下降,而分子机制研究表明DAX-1能够结合β-catenin蛋白,从而抑制β-catenin的转录活性,抑制肝癌细胞的增殖能力[14];在乳腺癌的研究中发现雄激素能够诱导DAX-1的表达上升,而DAX-1能够通过转录抑制作用抑制乳腺癌MCF-7细胞株中芳香酶的产生,从而抑制乳腺癌细胞的生长[15]。但目前为止鲜见DAX-1调控垂体瘤发生发展或药物治疗的相关研究。本研究发现DAX-1在垂体瘤中表达降低,并且过表达DAX-1能够抑制大鼠泌乳素瘤MMQ细胞增殖,而敲低DAX-1能够促进MMQ细胞的体内外增殖速度,因此DAX-1可能是和垂体泌乳素腺瘤发生发展相关的重要基因。
自噬是广泛存在于哺乳动物细胞内的降解-再循环系统,自噬对细胞中蛋白质降解、细胞器更新、细胞稳态维持起到重要的作用[16],自噬在泌乳素腺瘤的药物治疗机制中发挥极其重要的作用。多巴胺5型受体(dopaminetype5receptor, DRD5)激动剂SKF83959能够通过诱导ROS的积聚促进自噬的发生,引起MMQ细胞的自噬性死亡,并且DRD5激动剂能够有效抑制AKT/mTOR信号通路,该通路是自噬发生的重要通路[17];研究还发现临床一线抗疟药物氯喹能够有效增加CAB对MMQ细胞的杀伤作用,敲除自噬相关基因ATG7能显著逆转CAB诱导的细胞死亡[18]。长链非编码RNAH19和miR-93a能够通过调控ATG7 基因调控泌乳素瘤细胞的增殖速度和药物敏感性[19-21]。而本研究发现敲低DAX-1能够促进MMQ细胞的生长并且抑制自噬,而过表达DAX-1 又能够促进CAB和BRC的药物作用强度,体内实验结果也提示敲低DAX-1能够抑制自噬相关蛋白的表达。因此,DAX-1 介导的自噬可能和垂体泌乳素腺瘤的增殖以及药物治疗敏感性具有一定的相关性。但本研究未深入探索DAX-1 调整细胞内自噬水平的具体分子机制,有待后续研究。
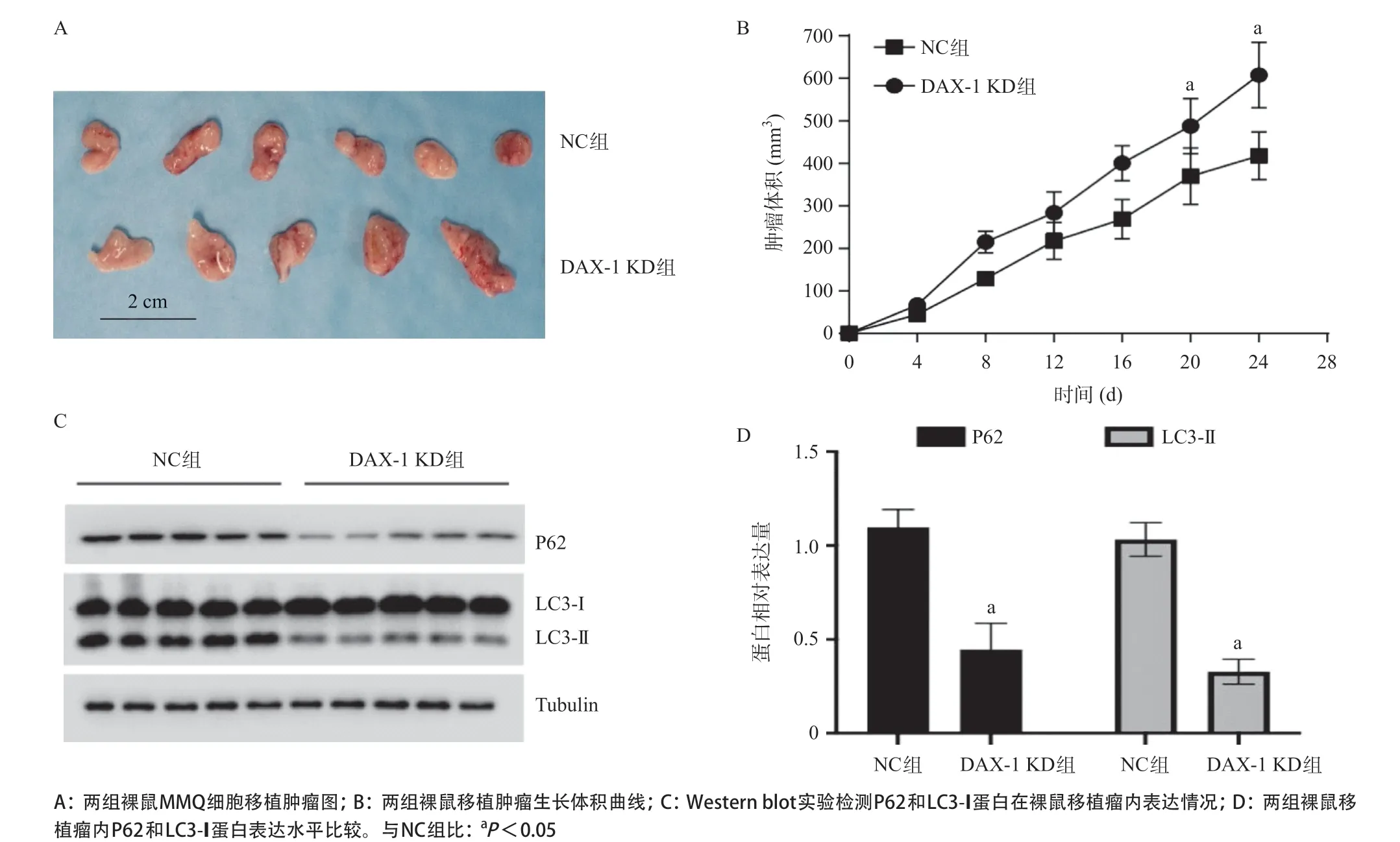
图4 敲低DAX-1 对垂体瘤细胞体内生长和自噬的影响
