肠道病毒A71型结构蛋白和非结构蛋白对p85表达及p38途径活化的影响
2022-06-18孙萍萍王佳慧杨世昭王蒋丽谢广成
孙萍萍,王佳慧,杨世昭,任 晴,王蒋丽,谢广成*
(1.承德医学院基础医学院,河北承德 067000;2.承德市疾病预防控制中心)
肠道病毒A71型(enterovirus-A71,EV-A71)作为手足口病(hand,foot,and mouth disease,HFMD)的主要病原体之一,其感染引起的HFMD给婴幼儿的身心健康带来巨大的负担[1]。我国自2008年发生大规模的HFMD暴发以来,就将HFMD列入国家法定传染病监测名录,进行全国范围内的流行监测[2]。EV-A71作为小RNA病毒科肠道病毒属病毒,其单股正链的基因组RNA只编码一个多聚前体蛋白并经自身编码的2A和3C蛋白酶剪切成熟为4个P1区结构蛋白(VP1、VP2、VP3和VP4)、3个P2区非结构蛋白(2A、2B和2C)及4个P3区非结构蛋白(3A、3B、3C和3D)[3,4]。
EV-A71能够感染不同类型的宿主细胞同时活化不同的相关信号途径,作者所在的课题组前期已经将该部分进行过详细综述[5]。可以明确的是,EV-A71感染宿主细胞后能够活化PI3K/AKT途径和p38途径[6-8],且EV-A71感染宿主细胞后Sam68与Src形成的复合物能够与PI3K的调节亚基p85结合[9]。上述研究是基于EV-A71完整活病毒感染宿主细胞完成的,然而EV-A71进入宿主细胞后,复制过程中产生的成熟的结构蛋白和非结构蛋白在EVA71与宿主细胞互作中的作用目前仍不清楚。因此,本文开展EV-A71的4个结构蛋白和8个非结构蛋白与宿主细胞互作的研究,重点关注EV-A71的亚单位蛋白对p85表达和p38途径的活化,以期为EV-A71与宿主细胞的互作提供科学依据。
1 材料与方法
1.1 材料
肠道病毒A71型阜阳株(GenBank:EU703812)为课题组前期实验用病毒株[10,11]。pcDNA3.1(+)/myc-His A真核表达载体购买自Invitrogen公司,质粒小量扩增后由本实验室保存。HEK293细胞为课题组前期使用的细胞并由本实验室保存[11]。50ml离心管、T25细胞培养瓶和6孔细胞培养板购JET BIOFIL公司;10μl、200μl和1ml无菌微量吸头、1.5ml离心管购自Axygen公司;PVDF膜购置Merck公司。
1.2 试剂
DMEM培养基、0.25%Trypsin-EDTA和Opti-MEM基础培养基购自Gibco公司;小牛血清购自Sigma公司;SuperFect转染试剂购自Qiagen公司;DH5α感受态细胞购自天根生化科技(北京)有限公司;蛋白胨和酵母提取物购自Oxoid公司;RIPA细胞裂解液、蛋白酶磷酸酶抑制剂混合物、BCA蛋白定量试剂盒、琼脂糖、BeyoRT™ II cDNA第一链合成试剂盒(RNase H-)和Easy-Load™ PCR Master Mix(Blue,2X)购自碧云天公司;限制性内切酶Hind III和Not I购买自New England Biolabs公司;T4 DNA连接酶购置Promega;青链霉素混合液、PBS缓冲液和氨苄青霉素粉末购自索莱宝公司;E.Z.N.A. Plasmid Mini Kit、E.Z.N.A. Endo-free Plasmid Maxi Kit购自OMEGA公司;Gel/PCR DNA Fragments Extraction Kit和Viral Nucleic Acid Extraction Kit II 购自Geneaid公司;兔抗人p85和兔抗人p-p38一抗购自CST公司;小鼠抗人β-actin、HRP标记的山羊抗兔和山羊抗小鼠IgG(H+L)购自碧云天公司;ECL化学发光底物试剂盒购自Biosharp公司;彩色预染蛋白marker购自Thermo公司。
1.3 方法
1.3.1 EV-A71结构蛋白和非结构蛋白基因的重组真核表达质粒构建 以EV-A71阜阳株的全基因组序列(GenBank:EU703812)为参考序列,采用Primer Premier 5对EV-A71基因编码区的11个基因片段进行全长扩增引物设计,其中正向和反向引物的5′端分别添加Hind III和Not I限制性内切酶的靶序列,送北京天一辉远公司进行引物合成。采用Viral Nucleic Acid Extraction Kit II进行病毒核酸提取,按照BeyoRT™ II cDNA第一链合成试剂盒(RNase H-)说明书进行cDNA合成,反应程序为42℃,60min;95℃,5min;4℃,5min;按照50μl的扩增体系,使用Easy-Load™ PCR Master Mix(Blue,2X)进行PCR扩增体系配制,其中正/反向引物各添加2.5μl、cDNA添加2.5μl。扩增反应程序为94℃,5min;(95℃,30s;55℃,30s;72℃,45s)×40;72℃,10min;4℃,5min。EV-A71的2BC基因片段扩增时使用2B的正向引物和2C的反向引物,3A和3AB基因片段扩增时使用3A共同的正向引物,反向引物为3A和3AB的各自反向引物。扩增产物经琼脂糖凝胶电泳后,在紫外切胶仪下进行目的片段的回收,并使用Gel/PCR DNA Fragments Extraction Kit进行目的产物的回收和纯化。对EV-A71结构蛋白和非结构蛋白基因的12个基因片段和pcDNA3.1(+)/myc-His A空载体进行Hind III和Not I双酶切反应,反应体系和反应条件按照试剂盒说明书进行。使用T4 DNA连接酶进行EV-A71目的基因与pcDNA3.1(+)/myc-His A载体的连接反应,4℃过夜。将连接产物通过42℃热激60s方式转化进DH5α感受态细胞,将转化产物均匀涂抹于含有氨苄青霉素的LB固体培养板,倒置37℃恒温培养箱培养过夜,提取单菌落加入到5ml含有氨苄青霉素的LB液体培养基中,37℃恒温培养箱培养过夜。使用E.Z.N.A. Plasmid Mini Kit进行重组质粒小量提取,送北京天一辉远公司进行测序和PCR扩增鉴定。
1.3.2 去内毒素的EV-A71亚单位基因的重组质粒制备 将经测序和PCR鉴定正确的EV-A71结构蛋白和非结构蛋白基因的12个基因重组真核表达质粒重新按照上述步骤进行转化和涂板操作,挑选单菌落加入到30ml含有氨苄青霉素的LB液体培养基中,37℃恒温培养箱培养过夜,次日将30ml培养过夜的培养产物均分成2份,分别加入到300ml含有氨苄青霉素的LB液体培养基中,37℃恒温培养箱培养过夜。5000rpm离心15min,弃上清收集菌体,直至所有菌体沉淀收集完成。使用E.Z.N.A. Endo-free Plasmid Maxi Kit进行去内毒素质粒的大量提取,并进行质粒浓度测定。
1.3.3 重组质粒转染 使用添加1%青链霉素的含有10%小牛血清的DMEM培养基培养HEK293细胞,将细胞丰度达90%左右的HEK293细胞用0.25%Trypsin-EDTA进行细胞消化并接种至6孔细胞培养板,待HEK293细胞丰度达60%~70%时开始转染。按照SuperFect Transfection Reagent试剂盒说明书使用无血清的Opti-MEM基础培养基配制转染复合物,每孔细胞按照2μg质粒的剂量进行转染,室温静止30min后,观察转染复合物的浑浊度;每孔按照100μl转染复合物的体积添加至细胞培养基中,37℃培养6h后,使用PBS缓冲液清洗细胞3次,加入到新鲜含有10%小牛血清的DMEM培养基中进行HEK293细胞培养,直至转染时间达24h,每个质粒转染设置3个独立平行实验组。1.3.4 免疫印迹检测 转染时间达24h后,尽量去除DMEM培养基,使用添加过蛋白酶和磷酸酶抑制剂的RIPA裂解液裂解HEK293细胞,收取总蛋白并使用BCA蛋白定量试剂盒进行蛋白定量,制备SDS-PAGE电泳上样蛋白样品,使用12%的分离胶进行SDS-PAGE凝胶电泳;使用含有20%甲醇的转膜液在100V下转膜60min,将蛋白转膜至PVDF膜;将转膜完成的PVDF膜加入到含有5%脱脂奶粉的PBST封闭液中进行室温封闭1h;将p85、p-p38和β-actin一抗按照1:1000的比例进行稀释,一抗4℃孵育PVDF膜过夜;PBST洗液清洗3次,每次10min;HRP标记的二抗也按照1:1000的比例进行稀释,室温孵育PVDF膜2h;PBST洗液清洗3次,每次10min;使用ECL化学发光底物试剂盒进行发光显影。
2 结果
2.1 EV-A71结构蛋白和非结构蛋白基因的重组真核表达质粒的鉴定
EV-A71基因组的P1区的4个结构蛋白基因VP1(891bp)、VP2(762bp)、VP3(726bp)和VP4(207bp);P2区的3个非结构蛋白基因2A(450bp)、2B(297bp)、2C(987bp);P3区的4个非结构蛋白基因3A(258bp)、3C(549bp)、3D(1386bp)、3AB(324bp)(因3B只有66bp,所以将3A、3B构建在一起),此外还构建了2BC(1284bp),均呈现预期大小的目的条带(图1)。因此,将构建的EV-A71基因组亚区域的12个真核质粒分别命名为pcDNA3.1-EV71-VP1/VP2/VP3/VP4/2A/2B/2C/2BC/3A/3C/3D/3AB。12个真核重组质粒经序列测定与EV-A71基因组(GenBank:EU703812)的序列一致。
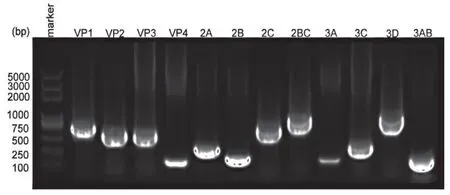
图1 EV-A71亚单位蛋白基因的PCR鉴定
2.2 EV-A71 P1区结构蛋白改变p85表达和p38途径的活化
将2μg的pcDNA3.1-EV71-VP1/VP2/VP3/VP4质粒转染至HEK293细胞24h后,EV-A71的P1区结构蛋白VP1、VP3和VP4能够上调p85的表达水平;EV-A71的结构蛋白VP2、VP3和VP4能够提升p38的磷酸化水平(图2)。
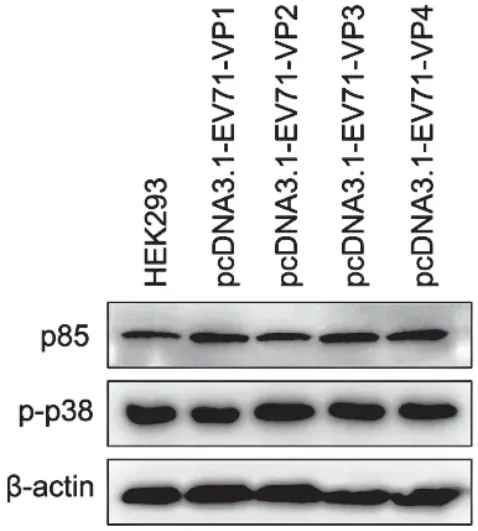
图2 EV-A71 P1区结构蛋白对p85表达和p38途径活化的影响
2.3 EV-A71 P2区非结构蛋白改变p85表达和p38途径的活化
将2μg的pcDNA3.1-EV71-2A/2B/2C/2BC质粒转染至HEK293细胞24h后,EV-A71的P2区4个非结构蛋白2A、2B、2C和2BC均能显著提升p85的表达水平和p38的磷酸化水平(图3)。
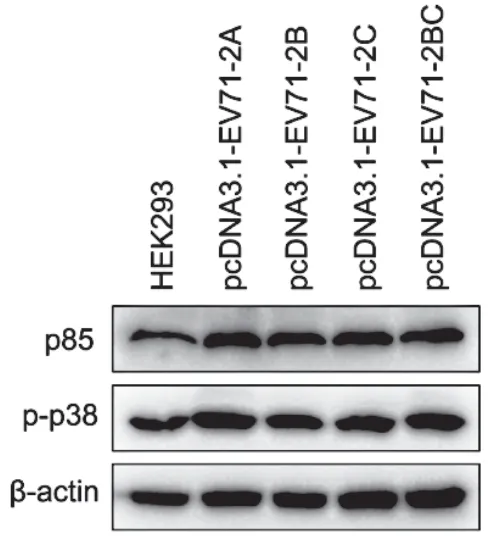
图3 EV-A71 P2区非结构蛋白对p85表达和p38途径活化的影响
2.4 EV-A71 P3区非结构蛋白改变p85表达和p38途径的活化
将2μg的pcDNA3.1-EV71-3A/3C/3D/3AB质粒转染至HEK293细胞24h后,EV-A71的3A、3C、3D和3AB均能提升p85的表达水平,特别是EV-A71 3A蛋白提升p85表达最为明显。EV-A71的3A、3C、3D和3AB均能提升p38的磷酸化水平,特别是EV-A71 3AB的提升效果最为明显(图4)。
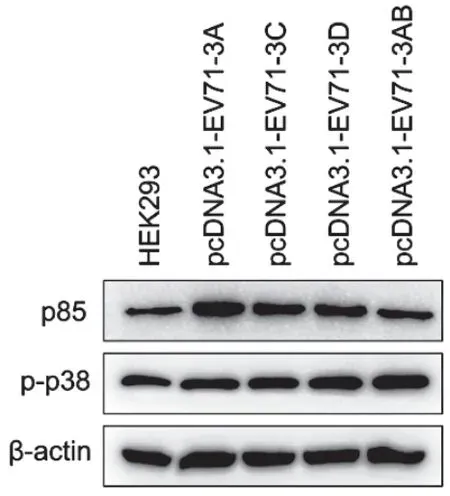
图4 EV-A71 P3区非结构蛋白对p85表达和p38途径活化的影响
3 讨论
磷酸肌醇-3激酶(phosphoinositide-3 kinase,PI3K)途径是细胞内一条重要的信号途径,该途径能够调控细胞增殖、细胞分化、细胞凋亡、细胞迁移和细胞代谢等不同过程[12]。PI3K家族依据结构和底物特异性的不同,可以分为PI3K IA和IB、PI3K II和PI3K III成员,其中PI3K IA是由催化亚基(p110α、p110β和p110δ)和调节亚基(p85α、p85β、p55γ、p55α和p50α)互作形成的异源二聚体[13]。前期研究和作者所在课题组的研究都表明,EV-A71感染宿主细胞后能够活化PI3K/AKT途径[6,7,14],同时明确EV-A71感染能够引起Sam68/Src复合物与p85互作[9],但是将EV-A71基因组编码经EV-A71的2A和3C蛋白酶剪切成熟的结构蛋白和非结构蛋白到底能不能与PI3K互作,目前仍是未知。关于EV-A71编码的结构蛋白和非结构蛋白的功能目前已经基本确定[3,15]。总的来说,EV-A71的4个结构蛋白构成EV-A71的衣壳,其中VP1、VP2和VP3位于衣壳表面、VP4位于衣壳内部[16]。VP1主要介导与病毒受体的结合[17],是表面抗原的同时还具有主要的抗原结合位点[18]。VP2和VP3同样与EV-A71的抗原性有关,VP2的142-146位氨基酸是一个线性、非中和抗原表位,将144位氨基酸进行S/T单点突变会导致VP2的抗原性丢失[19]。VP3的55-69位氨基酸是一个新的构象表位[20]。VP4蛋白能够插入到细胞膜上形成通道,让EV-A71的基因组RNA进入细胞内,进而完成脱壳过程[21]。目前已知EV-A71的非结构蛋白的主要功能是促进病毒复制,特别是EV-A71的2A和3C蛋白可通过剪切天然免疫的重要受体和配体分子实施免疫逃逸,进而促进病毒的复制[3,5,15,22]。另外,EV-A71的3D聚合酶还能够引起宿主细胞周期的阻滞[23]。本研究通过构建EV-A71的结构蛋白和非结构蛋白的真核重组质粒,将其转入到HEK293细胞内,发现除了EV-A71的结构蛋白VP2外,结构蛋白(VP1、VP3和VP4)及7个非结构蛋白均能提高PI3K的调节亚基p85的表达水平,这一结果意味着EVA71的这些亚单位蛋白能够潜在与p85互作,但是具体机制仍需要进一步的深入研究。目前的研究进展显示,流感病毒非结构蛋白NS1的YXXM基序(YLTDM,89-93aa)基序能够结合p85的SH2区,而NS1的PXXP(PSLP,164-167aa)基序能够结合p85的SH3区[24];塞姆利基森林病毒通过nsP3蛋白的YXXM基序(YEPM,369-372aa)与p85的SH2区结合活化PI3K/AKT途径,进而活化细胞糖酵解,最终促进SFV复制[25]。因此,本研究结果提示,EV-A71也有可能利用其结构蛋白或非结构蛋白,通过互作p85后活化PI3K/AKT途径,最后调控宿主细胞的糖代谢过程,并为EV-A71的复制提供能量来源,然而这一科学假设仍需要进一步的生物学实验进行验证。
p38信号途径也是细胞内的一条重要途径,涉及到组织自稳态、免疫反应、病毒复制等不同过程[26]。抑制人皮肤成纤维细胞和HeLa细胞的p38信号途径,进而抑制马亚罗病毒的复制[27]。另外,新城疫病毒[28]、丙型肝炎病毒(hepatitis C virus,HCV)[29]都能够在其感染过程中活化p38途径,促进病毒的复制水平。HCV还能够通过活化p38途径来介导细胞糖代谢过程,最终调控HCV子代病毒粒子的释放[30]。本研究证实了EV-A71的结构蛋白和非结构蛋白能够不同程度的调控p38的磷酸化,进而调控p38途径的活化,但是p38途径的活化是否也能够介导宿主细胞糖代谢过程最终影响EV-A71的复制,目前仍是未知,需要进一步研究。
综上所述,本研究确定了EV-A71的结构蛋白和非结构蛋白能够在一定程度上调控p85的表达和p38途径的活化,说明EV-A71在感染宿主细胞后的复制过程中能够通过其复制产生的成熟的结构蛋白和非结构蛋白与宿主细胞互作,进而影响宿主细胞的糖酵解、细胞凋亡等过程,但是具体机制仍需要进一步的深入研究。
