Lnc RNA CUDR敲低对肝癌侵袭、增殖和凋亡的影响
2022-06-18周健坤曹立宇
王 波,金 雯*,周健坤,陈 良,曹立宇
(1.铜陵职业技术学院医学护理系,安徽铜陵 244061;2.合肥市第二人民医院高压氧科;3.安徽医科大学第一附属医院病理科)
肝细胞癌(hepatocellular carcinoma,HCC)已成为全球第六大常见恶性肿瘤,且致死率居癌症中第三位[1]。早期转移与高复发是影响HCC患者预后的关键。研究显示,长链非编码RNA(long chain non-coding RNA,Lnc RNA)在HCC的发生、发展中起重要作用,其可与一些信号因子互相作用,发挥调节细胞周期、调控信号转导、干扰肿瘤耐药及影响肿瘤微血管生成等作用[2,3]。LncRNA CUDR是长链非编码RNA家族的成员之一,有研究表明,CUDR可通过激活AKT/ERK通路增强胰腺癌的恶性表型[4],而其在参与肝癌进展中的详细作用尚不明确。本研究旨在观察并探讨LncRNA CUDR表达下调对HCC侵袭、增殖和凋亡的影响。
1 材料与方法
1.1 细胞与主要试剂
SMMC-7721细胞(美国ATCC细胞库);CUDR shRNA慢病毒质粒(上海吉玛公司);DMEM(美国Gibco公司);RPMI 1640和PBS,pH7.4(美国Gibco公司);胎牛血清(Bio IND,04-002-1A)、Antibiotic-Antimycotic、Trypsin-EDTA(0.05%)和Lipofectamine 2000转染试剂(美国Lifetechnologies公司);TRIzol试剂及qPCR试剂盒(上海Beyotime公司)等。
1.2 方法
1.2.1 细胞培养与转染 SMMC-7721细胞于37℃、5%CO2培养箱10%胎牛血清中培养,相对湿度90%;37℃条件下用0.25%胰蛋白酶消化、清洗,加入DMEM/RPMI 1640完全培养基5ml,反复吹打,制成细胞悬液,接种于25ml培养瓶中,1:2分瓶传代培养,于对数期接种于6孔板中;至细胞达到80%~90%融合时,按照Lipofectamine 2000转染试剂说明书滴入CUDR shRNA慢病毒转染每孔细胞,48h后收集细胞;实验设CUDR敲低组、对照组、空质粒组,采用RT-PCR方法检测CUDR敲除效率,2-ΔΔCt法计算CUDR mRNA相对表达量。
1.2.2 RT-PCR检测CUDR mRNA的表达 按TRIzol试剂说明步骤,将细胞悬液滴入600μl Buffer RL,裂解、离心后,收集mRNA溶液;分光光度计定量测定总量;按照qPCR试剂盒说明配置反应体系行逆转录,RT-PCR检测CUDR mRNA相对表达量,引物序列设计为,CUDR-F:ACGCTAACTGGCACCTTGTT;CUDR-R:CTCCGGACTGCTTCAAGTGT;GAPDHF:AGAAGGCTGGGGCTCATTTG;GAPDH-R:AGGGCCATCCACAGTCTTC。
1.2.3 Transwell检测肝癌细胞侵袭力 接种前用PBS清洗24孔板和Transwell小室,室中铺80µl matrigel胶,37℃培养箱中放置30min;用0.25%胰蛋白酶消化细胞后,使用无血清DMEM培养基重悬细胞至密度达1×105个/mL,分别吸取0.2ml细胞悬液接种到Transwell小室内,下层加入0.8ml含10%胎牛血清的DMEM完全培养液,置于37℃培养箱中培养过夜;每孔加入1ml 4%多聚甲醛溶液,室温固定15min;吸去固定液,采用PBS清洗2次,每孔加入0.5%结晶紫溶液1ml,染色60min,PBS清洗、晾干;于100×显微镜下观察并计数下室细胞数。
1.2.4 瘤球成形实验检测肝癌细胞聚集、增殖能力 0.25%胰蛋白酶消化细胞后离心,用PBS清洗干净;细胞重悬于DMEM/F12培养基中;采用超低吸附细胞培养板,每孔植入500~5000个细胞,每3~4d补加培养基;10d后完成培养,观察细胞成球状态并拍照计数,计数标准:瘤球长径≥30µm。
1.2.5 流式技术检测细胞凋亡率 按试剂盒说明书步骤,测定细胞凋亡率。1000rpm离心各组细胞5min;当细胞密度达1×106/mL,取100μl细胞悬液,分别加入AnnexinVFITC结合物和PI solution 各5μl;室温孵育15min;加入400μl 1×Annexin V Binding Solution后,上流式细胞仪检测。
1.3 统计学方法
采用SPSS 22.0统计软件分析实验结果,计量资料采用均数±标准差表示,行方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CUDR shRNA转染效率
3组CUDR mRNA相对表达量分别为:CUDR敲低组3.230±0.339;对照组8.934±0.625;空质粒组9.373±0.770;CUDR敲低组与对照组和空质粒组比较均有统计学意义(F=96.215,P<0.001);对照组与空质粒组比较无差异(P=0.408),见图1。

图1 CUDR shRNA慢病毒质粒转染效率
2.2 Transwell侵袭检测结果
3组穿透下室细胞数分别为:CUDR敲低组(49.333±4.412)个;对照组(132.500±4.930)个;空质粒组(139.167±6.853)个。CUDR敲低组与对照组和空质粒组比较均有统计学意义(F=496.989,P<0.001);对照组与空质粒组比较无差异(P=0.053),见图2。

图2 敲低CUDR对SMMC-7721肝癌细胞侵袭的影响
2.3 肝癌瘤球成形实验结果
3组瘤球成形数分别为:CUDR敲低组(8.333±1.470)个;对照组(33.500±4.930)个;空质粒组(30.333±2.658)个。CUDR敲低组与对照组和空质粒组比较均有统计学意义(F=96.685,P<0.001);对照组与空质粒组比较无差异(P=0.122),见图3。
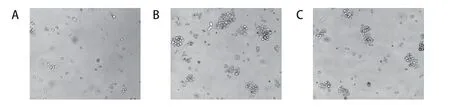
图3 敲低CUDR对SMMC-7721肝癌细胞聚集、增殖的影响
2.4 流式技术检测细胞凋亡率结果
3组细胞凋亡率分别为:CUDR敲低组(9.907±0.732)%;对照组(4.807±0.451)%;空质粒组(4.620±0.682)%。CUDR敲低组与对照组和空质粒组比较均有统计学意义(F=67.259,P<0.001);对照组与空质粒组比较无差异(P=0.731),见图4。

图4 敲低CUDR对SMMC-7721肝癌细胞凋亡的影响
3 讨论
手术切除是治疗HCC最为有效的方法之一,但由于HCC微转移发生早,高复发仍然是导致术后低生存率的关键。鉴于我国HCC患者初诊时多已处于中晚期,其术后中位生存期仅为2年左右[5]。持续的细胞恶性增殖是HCC发生、发展的重要生物学特征,抑制恶性增殖是肿瘤治疗的核心原则之一[6]。HCC的发生、发展是由多基因突变并涉及诸多信号转导通路的复杂生物学过程[7]。因此,探究HCC发生、发展的生物学机制可以为治疗HCC提供基础理论支撑。
LncRNAs异常表达与HCC进展关系密切,被认为是HCC诊疗的潜在靶点。LncRNA MALAT1可与miR-140靶向结合促进肝癌细胞的血管生成和免疫抑制[8]。Lnc RNA FOXD2-AS1可通过调节miR-206/MAP3K1信号轴促进肝细胞癌的发生、发展进程[9]。下调LncRNA MALAT1可能通过影响PI3K/Akt信号传导通路上关键靶点抑制肝癌细胞的增殖,迁移及体外成瘤能力[10]。上述表明,LncRNAs可在多条信号通路中扮演癌基因的角色,进一步明确LncRNAs的功能有助于深入认识HCC的复发和转移机制。LncRNA CUDR具有调节细胞分化和多能性的功能[11]。本研究采用CUDR shRNA慢病毒质粒转染SMMC-7721细胞并构建CUDR稳定表达的肝癌细胞系,RT-PCR检测显示,CUDR基因敲低组CUDR mRNA表达量与对照组和空质粒组比较显著下调,差异有统计学意义(P<0.001)。为探究CUDR在HCC中的作用意义,分别行Transwell侵袭实验和肝癌瘤球成形实验检测肝癌细胞的侵袭、聚集和增殖能力,结果显示CUDR敲低后肝癌细胞侵袭力、聚集和增殖能力与对照组和空质粒组相比显著降低,差异有统计学意义(P<0.001);流式技术检测细胞凋亡率结果显示CUDR敲低后肝癌细胞的凋亡率与对照组和空质粒组相比显著提高,差异有统计学意义(P<0.001)。上述提示,调低CUDR基因可以抑制HCC的侵袭和增殖并促进癌细胞的凋亡。研究显示,LncRNA CUDR可与P53(N340Q/L344R)形成复合物,该复合物进一步与PKM2的启动子区域结合,增强PKM2的表达、磷酸化以及激活系列级联反应进而促进HCC的进展[12]。LncRNA CUDR可与炎症细胞因子IL6相互作用,使MELLT3与SUV39h1 mRNA3'UTR结合,促进SUV39h1的表达,进而增强组蛋白H3对第九赖氨酸(H3K9me3)的甲基化,增强肝癌干细胞的恶性表型[13]。上述内容进一步说明LncRNA CUDR在HCC发生、发展中起致癌基因作用,调低CUDR可抑制HCC的进展,其可能成为HCC治疗的潜在靶点。
综上,LncRNA CUDR在HCC进展中发挥致癌基因的作用。本研究发现,敲低CUDR后可以抑制HCC的侵袭和增殖并促进癌细胞的凋亡,为HCC的靶向治疗提供理论依据。
